
- •Лабораторная работа № 4. Приготовление растворов заданного количественного состава. Определение концентрации растворов титрованием.
- •1. Разделы теоретического курса для повторения.
- •2. Теоретическая часть.
- •7. Моляльность. Моляльность раствора характеризуется количеством растворенного вещества в молях, приходящихся на 1 кг растворителя в данном растворе.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •В рабочем журнале оформите раздел 4 и распечатайте его для выполнения в лаборатории(2 стр. На листе).
- •Зависимость плотности раствора от массовой доли растворенного вещества 20◦ , (г/см3)
- •Данные для приготовления раствора заданного количественного состава
- •Результаты эксперимента по приготовлению раствора заданного количественного состава.
- •Количественный состав раствора с заданной массовой долей, выраженный иными способами.
- •Часть 2. Определение концентрации растворов кислот и щелочей титрованием.
- •Результаты титрования раствора щелочи раствором кислоты.
- •Лабораторная работа № 5 Химическая кинетика и химическое равновесие.
- •1. Разделы курса, необходимые для подготовки к лабораторной работе.
- •2. Теоретическая часть. Химическая кинетика.
- •Реагенты→ переходное состояние→ продукты реакции.
- •Химическое равновесие.
- •Смещение химического равновесия.
- •Влияние изменения концентрации на смещение химического равновесия.
- •Влияние изменения давления на смещение химического равновесия.
- •Влияние изменения температуры на смещение химического равновесия.
- •Влияние катализатора на состояние химического равновесия.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •В рабочем журнале оформите раздел 4 и распечатайте его для выполнения в лаборатории(2 стр. На листе).
- •Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ.
- •Зависимость скорости реакции от условной концентрации раствора
- •Опыт 2. Зависимость скорости реакции от температуры.
- •Зависимость скорости реакции от температуры.
- •Опыт 3. Влияние площади поверхности на скорость реакции в гетерогенной системе.
- •Часть 2. Химическое равновесие.
- •Влияние изменения концентрации реагентов и продуктов реакции на смещение химического равновесия.
- •Лабораторная работа № 6. Электролитическая диссоциация.
- •2. Теоретическая часть.
- •Зависимость силы электролита от значения константы его диссоцации.
- •Реакции в растворах электролитов.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •4.Экспериментальная часть.
- •Сравнение химической активности электролитов.
- •2. Влияние сильного электролита, содержащего одноименный ион, на диссоциацию слабого электролита.
- •3. Реакции обмена в растворах электролитов.
- •Лабораторная работа № 7 Водородный показатель. Гидролиз солей.
- •1. Разделы теоретического курса для повторения.
- •2. Теоретическая часть.
- •Определение рН среды колориметрическим методом.
- •Изменение окраски индикаторов в зависимости от реакции среды.
- •Определение рН среды потенциометрическим методом.
- •Гидролиз
- •Гидролиз солей.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •4. Экспериментальная часть.
- •1. Определение реакции среды колориметрическим методом.
- •Определение реакции среды и величины водородного показателя среды некоторых растворов колориметрическим методом.
- •Б) Определение реакции среды с помощью универсальной индикаторной бумаги.
- •2. Определение рН среды потенциометрическим методом.
- •Результаты определения величины рн среды потенциометрическим методом.
- •Порядок измерения величины рН растворов.
- •3. Влияние разбавления на глубину протекания процесса гидролиза.
- •4. Влияние нагревания на процесс гидролиза.
- •5. Взаимное усиление гидролиза.
- •6. Растворение активного металла в продуктах гидролиза.
- •7. Связь между константой гидролиза Кгидр. И константой диссоциации слабого электролита, образующего гидролизующуюся соль.
Химическое равновесие.
Наряду с практически необратимыми химическими реакциями, известны многочисленные обратимые процессы. В этом случае химическое превращение не доходит до конца, а возникает равновесная смесь всех участников и продуктов реакции, находящихся как в левой, так и в правой частях стехиометрического уравнения реакции. Так, при стандартных условиях обратимой является система:
2NO2(г)![]() N2O4(г).
N2O4(г).
Для обратимой реакции, которая, в общем виде, имеет вид:
mA
+ nB![]() pC
+ qD,
pC
+ qD,
согласно закону действующих масс значения скоростей для прямой (Vпрям) и обратной (Vобр) реакций описываются следующими кинетическими уравнениями:
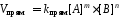
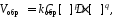 где:
где:
kпрям и kобр константы скорости, соответственно, прямой и обратной реакций.
В начальный момент времени концентрации исходных веществ [A] и [B], а следовательно, и скорость прямой реакции имеют максимальное значение. Концентрации продуктов реакции [С] и [D] и скорость обратной реакции в начальный момент равны нулю. В ходе реакции концентрации исходных веществ уменьшаются, что приводит к снижению скорости прямой реакции. Концентрации же продуктов реакции, а, следовательно, и скорость обратной реакции возрастают. Наконец, наступает момент, при котором скорости прямой и обратной реакций становятся равными.
Состояние системы, при котором скорость прямого процесса равна скорости обратного процесса (Vпрям = Vобр) называется химическим равновесием. Это равновесие является динамическим, поскольку в системе имеет место двусторонняя реакция в прямом (A и B реагенты, C и D продукты) и в обратном (A и B продукты, C и D реагенты) направлениях.
В обратимой системе, находящейся в состоянии равновесия, концентрации всех участников процесса называются равновесными концентрациями.
Количественную характеристику химического равновесия можно вывести, используя соответствующие кинетические уравнения:
Vпрям = Vобр,
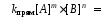
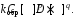
Так как константы скоростей реакций при фиксированной температуре постоянны, то будет постоянным и отношение
 ,
,
которое называют константой химического равновесия.
Приравнивая правые части кинетических уравнений для прямой и обратной реакций можно получить:
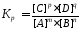 ,
,
где Kр константа химического равновесия, выраженная через равновесные концентрации участников реакции.
Константа химического равновесия представляет собой отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов.
Например, для обратимой реакции
2NO2(г)![]() N2O4(г)
N2O4(г)
выражения для константы равновесия имеет вид:
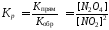 .
.
Если в процессе химического превращения участвуют две или несколько фаз, то в выражении для константы равновесия следует учитывать только те из них, в которых происходят изменения концентраций реагентов. Например, в выражение для константы равновесия для системы
CaCO3(т)![]() CaO(т)
+ CO2(г)
CaO(т)
+ CO2(г)
твердые вещества не включаются
Кр = [CO2].
Константа равновесия Kp количественная мера способности реакции протекать «слева направо» при заданном способе написания стехиометрического уравнения реакции.
Константа равновесия показывает, во сколько раз прямая реакция идет быстрее обратной при одинаковой температуре и концентрациях, равных 1 моль/л.
Если Kp = 1, то реакция находится в состоянии химического равновесия и протекает в прямом и обратном направлениях с одинаковым выходом. Большим значениям константы равновесия (Kp>>107) отвечают большие значения выхода (равновесных концентраций) продуктов прямой реакции; в равновесной смеси преобладают продукты прямой реакции.
При очень больших значениях константы равновесия обратная реакция практически не протекает (реакция необратима). В обратном случае, если константа равновесия имеет очень малое значение (Kp<<107), то прямая реакция практически не протекает, и необратимой является обратная реакция.
