
- •Лабораторная работа № 4. Приготовление растворов заданного количественного состава. Определение концентрации растворов титрованием.
- •1. Разделы теоретического курса для повторения.
- •2. Теоретическая часть.
- •7. Моляльность. Моляльность раствора характеризуется количеством растворенного вещества в молях, приходящихся на 1 кг растворителя в данном растворе.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •В рабочем журнале оформите раздел 4 и распечатайте его для выполнения в лаборатории(2 стр. На листе).
- •Зависимость плотности раствора от массовой доли растворенного вещества 20◦ , (г/см3)
- •Данные для приготовления раствора заданного количественного состава
- •Результаты эксперимента по приготовлению раствора заданного количественного состава.
- •Количественный состав раствора с заданной массовой долей, выраженный иными способами.
- •Часть 2. Определение концентрации растворов кислот и щелочей титрованием.
- •Результаты титрования раствора щелочи раствором кислоты.
- •Лабораторная работа № 5 Химическая кинетика и химическое равновесие.
- •1. Разделы курса, необходимые для подготовки к лабораторной работе.
- •2. Теоретическая часть. Химическая кинетика.
- •Реагенты→ переходное состояние→ продукты реакции.
- •Химическое равновесие.
- •Смещение химического равновесия.
- •Влияние изменения концентрации на смещение химического равновесия.
- •Влияние изменения давления на смещение химического равновесия.
- •Влияние изменения температуры на смещение химического равновесия.
- •Влияние катализатора на состояние химического равновесия.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •В рабочем журнале оформите раздел 4 и распечатайте его для выполнения в лаборатории(2 стр. На листе).
- •Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ.
- •Зависимость скорости реакции от условной концентрации раствора
- •Опыт 2. Зависимость скорости реакции от температуры.
- •Зависимость скорости реакции от температуры.
- •Опыт 3. Влияние площади поверхности на скорость реакции в гетерогенной системе.
- •Часть 2. Химическое равновесие.
- •Влияние изменения концентрации реагентов и продуктов реакции на смещение химического равновесия.
- •Лабораторная работа № 6. Электролитическая диссоциация.
- •2. Теоретическая часть.
- •Зависимость силы электролита от значения константы его диссоцации.
- •Реакции в растворах электролитов.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •4.Экспериментальная часть.
- •Сравнение химической активности электролитов.
- •2. Влияние сильного электролита, содержащего одноименный ион, на диссоциацию слабого электролита.
- •3. Реакции обмена в растворах электролитов.
- •Лабораторная работа № 7 Водородный показатель. Гидролиз солей.
- •1. Разделы теоретического курса для повторения.
- •2. Теоретическая часть.
- •Определение рН среды колориметрическим методом.
- •Изменение окраски индикаторов в зависимости от реакции среды.
- •Определение рН среды потенциометрическим методом.
- •Гидролиз
- •Гидролиз солей.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •4. Экспериментальная часть.
- •1. Определение реакции среды колориметрическим методом.
- •Определение реакции среды и величины водородного показателя среды некоторых растворов колориметрическим методом.
- •Б) Определение реакции среды с помощью универсальной индикаторной бумаги.
- •2. Определение рН среды потенциометрическим методом.
- •Результаты определения величины рн среды потенциометрическим методом.
- •Порядок измерения величины рН растворов.
- •3. Влияние разбавления на глубину протекания процесса гидролиза.
- •4. Влияние нагревания на процесс гидролиза.
- •5. Взаимное усиление гидролиза.
- •6. Растворение активного металла в продуктах гидролиза.
- •7. Связь между константой гидролиза Кгидр. И константой диссоциации слабого электролита, образующего гидролизующуюся соль.
Изменение окраски индикаторов в зависимости от реакции среды.
|
Индикатор
|
Окраска в среде | ||
|
Кислая среда |
Нейтральная среда
|
Щелочная среда
| |
|
Фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
Метилоранж |
красный |
оранжевый |
желтый |
|
Лакмус |
красный |
фиолетовый |
синий |
Определение рН среды потенциометрическим методом.
Потенциометрия - это электрохимический метод анализа, основанный на зависимости величины электродного потенциала, а, следовательно, и электродвижущей силы (ЭДС), составленного из соответствующих электродов гальванического элемента, от состава раствора.
Для определения величины водородного показателя (pH) среды применяются, так называемые, pН - индикаторные электроды, потенциал которых зависит от активности ионов водорода в растворе, например, водородный электрод, хингидронный электрод и, наиболее широко применяющийся в настоящее время, стеклянный электрод.
Главной частью стеклянного электрода является тонкостенный стеклянный шарик из специального сорта стекла. Внутрь шарика налит 0,1н. раствор соляной кислоты и введен внутренний хлорсеребряный электрод, который служит тоководом и проводит электроны обратимо во внутренний раствор и от него. Потенциал внутреннего электрода должен иметь постоянное значение. Когда электрод погружают в раствор, в поверхностные слои стекла электрода из раствора интенсивно проникают ионы водорода, вытесняя ионы содержащегося в стекле щелочного металла, например натрия:
H+раствор + Na+стекло H+ стекло + Na+ раствор
Это приводит к тому, что между стеклом и раствором возникает разность потенциалов, величина которой определяется
только активностью ионов водорода в растворе:
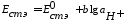
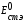 и
и
 - постоянные величины, зависящие от
используемых электродов.
- постоянные величины, зависящие от
используемых электродов.
Таким образом, стеклянный электрод работает как водородный электрод, так как его потенциал зависит от активности ионов водорода.
Для определения рН среды потенциометрическим методом составляется гальванический элемент, состоящий из двух электродов: измерительного (рабочего), потенциал которого зависит от активности (концентрации) ионов водорода в растворе, например, стеклянного, и электрода сравнения (например, хлорсеребряного), имеющего постоянную величину потенциала. Электродвижущая сила (ЭДС) такого гальванического элемента будет тоже зависеть от активности ионов водорода, а значит и рН среды.
Величина (ЭДС) таких гальванических элементов легко определяется практически с помощью катодных вольтметров или широко применяемых в настоящее время специальных приборов рН-метров (рН-340, рН-141, иономер рН-121 и др.).
Гидролиз
Гидролизом называется процесс взаимодействия вещества с водой, в результате которого нарушается ионное равновесие процесса диссоциации воды и меняется реакция среды.
Гидролиз является частным случаем реакций сольволиза, т. е. реакций обмена между растворителем и растворенным веществом. В рамках ионной теории Аррениуса механизм протекания гидролиза объясняется следующим образом. Вода, хотя и в незначительной степени, диссоциирует на ионы Н+ и ОН-. Если в результате гидролиза образуется малодиссоциирующее основание, то часть ионов ОН- оказываются связанными, а равное им количество ионов Н+ - свободными, что и обуславливает кислую реакцию раствора. Наоборот, если в результате гидролиза связывается часть ионов Н+, то равное количество ионов ОН- остается свободным, что и обуславливает щелочную среду раствора.
Гидролизу подвергаются:
Соли
Углеводы
Белки
Мыла
Сложные эфиры
Жиры
Феноляты (щелочная среда)
Алкоголяты
Галогенангидриды и другие вещества.
