
- •Лабораторная работа № 4. Приготовление растворов заданного количественного состава. Определение концентрации растворов титрованием.
- •1. Разделы теоретического курса для повторения.
- •2. Теоретическая часть.
- •7. Моляльность. Моляльность раствора характеризуется количеством растворенного вещества в молях, приходящихся на 1 кг растворителя в данном растворе.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •В рабочем журнале оформите раздел 4 и распечатайте его для выполнения в лаборатории(2 стр. На листе).
- •Зависимость плотности раствора от массовой доли растворенного вещества 20◦ , (г/см3)
- •Данные для приготовления раствора заданного количественного состава
- •Результаты эксперимента по приготовлению раствора заданного количественного состава.
- •Количественный состав раствора с заданной массовой долей, выраженный иными способами.
- •Часть 2. Определение концентрации растворов кислот и щелочей титрованием.
- •Результаты титрования раствора щелочи раствором кислоты.
- •Лабораторная работа № 5 Химическая кинетика и химическое равновесие.
- •1. Разделы курса, необходимые для подготовки к лабораторной работе.
- •2. Теоретическая часть. Химическая кинетика.
- •Реагенты→ переходное состояние→ продукты реакции.
- •Химическое равновесие.
- •Смещение химического равновесия.
- •Влияние изменения концентрации на смещение химического равновесия.
- •Влияние изменения давления на смещение химического равновесия.
- •Влияние изменения температуры на смещение химического равновесия.
- •Влияние катализатора на состояние химического равновесия.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •В рабочем журнале оформите раздел 4 и распечатайте его для выполнения в лаборатории(2 стр. На листе).
- •Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ.
- •Зависимость скорости реакции от условной концентрации раствора
- •Опыт 2. Зависимость скорости реакции от температуры.
- •Зависимость скорости реакции от температуры.
- •Опыт 3. Влияние площади поверхности на скорость реакции в гетерогенной системе.
- •Часть 2. Химическое равновесие.
- •Влияние изменения концентрации реагентов и продуктов реакции на смещение химического равновесия.
- •Лабораторная работа № 6. Электролитическая диссоциация.
- •2. Теоретическая часть.
- •Зависимость силы электролита от значения константы его диссоцации.
- •Реакции в растворах электролитов.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •4.Экспериментальная часть.
- •Сравнение химической активности электролитов.
- •2. Влияние сильного электролита, содержащего одноименный ион, на диссоциацию слабого электролита.
- •3. Реакции обмена в растворах электролитов.
- •Лабораторная работа № 7 Водородный показатель. Гидролиз солей.
- •1. Разделы теоретического курса для повторения.
- •2. Теоретическая часть.
- •Определение рН среды колориметрическим методом.
- •Изменение окраски индикаторов в зависимости от реакции среды.
- •Определение рН среды потенциометрическим методом.
- •Гидролиз
- •Гидролиз солей.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •4. Экспериментальная часть.
- •1. Определение реакции среды колориметрическим методом.
- •Определение реакции среды и величины водородного показателя среды некоторых растворов колориметрическим методом.
- •Б) Определение реакции среды с помощью универсальной индикаторной бумаги.
- •2. Определение рН среды потенциометрическим методом.
- •Результаты определения величины рн среды потенциометрическим методом.
- •Порядок измерения величины рН растворов.
- •3. Влияние разбавления на глубину протекания процесса гидролиза.
- •4. Влияние нагревания на процесс гидролиза.
- •5. Взаимное усиление гидролиза.
- •6. Растворение активного металла в продуктах гидролиза.
- •7. Связь между константой гидролиза Кгидр. И константой диссоциации слабого электролита, образующего гидролизующуюся соль.
Гидролиз солей.
Гидролиз солей – это обменное взаимодействие ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды и меняется реакция среды.
Соли - это сложные вещества, диссоциирующее на катионы металла и аниона кислотного остатка. Соли могут быть образованы:
сильным основанием и сильной кислотой;
сильным основанием и слабой кислотой;
слабым основанием и сильной кислотой;
слабым основанием и слабой кислотой.
Гидролизу подвергаются только те соли, которые образуют при диссоциации ион от слабого электролита. Соли, образованные сильными основаниями и сильными кислотами гидролизу не подвергаются. Таким образом, возможность протекания гидролиза соли определяется наличием иона от слабого электролита (от кислоты или от основания, реакцией между которыми могла быть образована данная соль).
Соли, образованные слабым основанием и слабой кислотой, гидролизуются практически полностью, а в других случаях гидролиз идет незначительно и преимущественно по первой ступени (один моль ион слабого электролита взаимодействует только с одним молем молекул воды).
Реакцию среды при гидролизе можно определить по иону сильного электролита. Если соль образована катионом сильного основания и анионом слабой кислоты(S2-, CO32-, CN-и др.), то происходит гидролиз по аниону, а среда будет щелочной.
Например, карбонат натрия Na2CO3 в растворе подвергается гидролизу по аниону, так как соль образована слабой угольной кислотой (CO32- - анион от слабого электролита).
Процесс гидролиза сопровождается образованием малодиссоциирующего гидрокарбонат-иона. Так как в растворе появляется избыток гидроксид-ионов, то раствор будет иметь щелочную реакцию среды (рН>7).
Na2CO3 + Н2О NaНСО3 + NaOH
2Na+ + CO3 2- +HOH HCO3- + 2Na+ + OH-
среда щелочная рН > 7
Процесс гидролиза протекает тем интенсивнее, чем слабее электролит, образовавший соль в процессе реакции нейтрализации. Если соль образована катионом слабого основания и анионом сильной кислоты, то происходит гидролиз по катиону, а среда будет кислотной.
Примером служит процесс взаимодействия с водой нитрата меди (II) Сu(NO3)2. Гидролиз в этом случае обусловлен образованием малодиссоциирующих частиц (CuOH)+. В результате равновесие электролитической диссоциации воды смещается и в растворе появляется избыток ионов водорода, поэтому реакция среды становится кислой (рН<7).
Очевидно, чем слабее основание, тем полнее идет гидролиз. Гидролиз обычно протекает незначительно и, преимущественно, по первой ступени.
Сu(NO3)2 + Н2О СuOHNO3 + HNO3
Cu 2+ + 2NO3 - + HOH (CuOH)+ + H + + 2NO3 –
среда кислая рН < 7
Соль, образованная катионом слабого основания и анионом слабой кислоты подвергается гидролизу по катиону и по аниону.
Примером служит процесс взаимодействия сульфида хрома (III) Cr2S3 с водой. Растворы солей такого типа, в зависимости от соотношения констант диссоциации образующихся при гидролизе кислоты и основания, могут иметь либо слабокислую, либо слабощелочную реакцию среды, т.е. реакция среды в растворах таких солей близка к нейтральной, а величина водородного показателя среды близка к 7 (рН ≈7).
Гидролиз солей, образованных слабым основанием и слабой кислотой, протекает достаточно глубоко (практически полностью).
Cr2S3 + 6Н2О 2 Cr(OH)3↓+ 3H2S↑
среда близка к нейтральной, рН ≈ 7
Гидролиз некоторых солей, образованных очень слабыми основаниями и кислотами, является практически необратимым процессом, например гидролиз сульфидов и карбонатов Al3+, Cr3+, Fe3+. Эти соединения нельзя получить в водном растворе. При взаимодействии солей Al 3+, Cr3+ и Fe3+ в растворе с сульфидами и карбонатами в осадок выпадают не ожидаемые сульфиды и карбонаты этих катионов, а их гидроксиды:
2AlCl3 + 3Na2S + 6H2O 2Al(OH)3 ↓ + 3H2S ↑+ 6NaCl
2CrCl3 + 3Na2CO3 + 6H2O 2Cr(OH)3↓+ 3CO2↓ + 6NaCl
В рассмотренных примерах происходит взаимное усиление гидролиза двух солей (AlCl3 и Na2S или CrCl3 и Na2CO3) и реакции протекают практически до конца.
Cr2S3 + 6Н2О 2 Cr(OH)3 ↓+ 3H2S ↑
среда близка к нейтральной рН ≈ 7
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. В этом случае равновесие диссоциации воды в присутствии ионов соли почти не нарушается. Поэтому растворы таких солей практически нейтральную реакцию среды.
NaCl– гидролиз не протекает, так как соль образована сильным основанием и сильной кислотой. Среда нейтральная, рН = 7.
Если соль содержит однозарядный катион (анион) и многозарядный анион (катион), то возможен ступенчатый гидролиз. Образующиеся в результате гидролиза по аниону по первой ступени кислые соли могут подвергаться дальнейшему взаимодействию с водой. Однако, вторая и последующая ступени гидролиза выражены менее сильно. Это обусловлено изменением величин констант диссоциации соответствующих электролитов. Например, поскольку ион HCO3- диссоциирует слабее, чем Н2СО3, то он образуется в первую очередь при гидролизе карбоната натрия:
I ступень: Na2CO3 + Н2О NaНСО3 + NaOH
II ступень: NaНСО3+ Н2О NaOH + H2CO3
Гидролиз солей слабых многоосновных кислот по второй и третьей ступеням протекает незначительно, и содержание в растворе продуктов гидролиза по этим ступеням ничтожно мало.
Al2(SO4)3 –эта соль подвергается гидролизу, так как образована слабым основанием и сильной кислотой. Среда - кислая. Гидролиз протекает незначительно и, преимущественно, по первой ступени.
Молекулярное уравнение гидролиза:
Al2(SO4)3 + 2Н2О 2AlOHSO4 + H2SO4
Полное ионно- молекулярное уравнение гидролиза:
2Al 3+ + 3SO4 2- + 2HOH 2AlOH 2+ + 2H + + 3SO4 2-
среда кислая рН < 7
Краткое ионно- молекулярное уравнение гидролиза:
2Al 3+ + 2HOH 2AlOH 2+ + 2H +
Al 3+ + HOH AlOH 2+ + H +
Гидролиз солей, в ряде случаев, может протекать очень сложно. Продукты гидролиза некоторых солей можно установить точно лишь на основании аналитического исследования.
Поскольку при обратимом гидролизе устанавливается динамическое равновесие, то в соответствии с законом действующих масс, можно сместить равновесие в ту или иную сторону введением в раствор кислоты или основания. Этим часто пользуются для усиления или подавления процесса гидролиза.
Константа диссоциации воды увеличивается при повышении температуры в большей степени, чем константы диссоциации продуктов гидролиза – слабых кислот и оснований, поэтому при нагревании степень гидролиза возрастает.
Так как реакция нейтрализации является реакцией экзотермической, то гидролиз, будучи противоположным ей процессом, является процессом эндотермическим. Поэтому, в соответствии с принципом Ле - Шателье, повышение температуры вызывает усиление гидролиза.
В соответствии с тем же принципом процесс гидролиза проходит полнее при разбавлении раствора, так как увеличивается концентрация воды.
Одной из количественных характеристик процесса гидролиза является степень гидролиза ( h )
Степень
гидролиза
– это
отношение числа молекул, подвергшихся
гидролизу (N)
к общему числу молекул в растворе (N0).
h
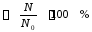
 Степень
гидролиза изменяется в пределах от 0 до
100%.
Степень
гидролиза изменяется в пределах от 0 до
100%.
Другой количественной характеристикой процесса гидролиза является константа гидролиза.
Константа гидролиза представляет собой константу равновесия обратимого процесса гидролиза.
Если соль образована слабой кислотой и сильным основанием, то константа гидролиза может быть рассчитана как отношение константы воды к константе диссоциации слабой кислоты (см. табл.8 приложения).
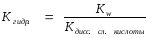
Если соль образована сильной кислотой и слабым основанием, то константа гидролиза равна отношению константы воды к константе диссоциации слабого основания.
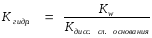
Если соль образована и слабым основанием и слабой кислотой, то константа гидролиза равна отношению константы воды, произведению констант диссоциации слабой кислоты и слабого основания.

Из приведенных формул следует, что чем слабее электролит, образовавший соль, тем больше значение константы гидролиза, и тем глубже протекает процесс гидролиза.
