
- •Лабораторная работа № 4. Приготовление растворов заданного количественного состава. Определение концентрации растворов титрованием.
- •1. Разделы теоретического курса для повторения.
- •2. Теоретическая часть.
- •7. Моляльность. Моляльность раствора характеризуется количеством растворенного вещества в молях, приходящихся на 1 кг растворителя в данном растворе.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •В рабочем журнале оформите раздел 4 и распечатайте его для выполнения в лаборатории(2 стр. На листе).
- •Зависимость плотности раствора от массовой доли растворенного вещества 20◦ , (г/см3)
- •Данные для приготовления раствора заданного количественного состава
- •Результаты эксперимента по приготовлению раствора заданного количественного состава.
- •Количественный состав раствора с заданной массовой долей, выраженный иными способами.
- •Часть 2. Определение концентрации растворов кислот и щелочей титрованием.
- •Результаты титрования раствора щелочи раствором кислоты.
- •Лабораторная работа № 5 Химическая кинетика и химическое равновесие.
- •1. Разделы курса, необходимые для подготовки к лабораторной работе.
- •2. Теоретическая часть. Химическая кинетика.
- •Реагенты→ переходное состояние→ продукты реакции.
- •Химическое равновесие.
- •Смещение химического равновесия.
- •Влияние изменения концентрации на смещение химического равновесия.
- •Влияние изменения давления на смещение химического равновесия.
- •Влияние изменения температуры на смещение химического равновесия.
- •Влияние катализатора на состояние химического равновесия.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •В рабочем журнале оформите раздел 4 и распечатайте его для выполнения в лаборатории(2 стр. На листе).
- •Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ.
- •Зависимость скорости реакции от условной концентрации раствора
- •Опыт 2. Зависимость скорости реакции от температуры.
- •Зависимость скорости реакции от температуры.
- •Опыт 3. Влияние площади поверхности на скорость реакции в гетерогенной системе.
- •Часть 2. Химическое равновесие.
- •Влияние изменения концентрации реагентов и продуктов реакции на смещение химического равновесия.
- •Лабораторная работа № 6. Электролитическая диссоциация.
- •2. Теоретическая часть.
- •Зависимость силы электролита от значения константы его диссоцации.
- •Реакции в растворах электролитов.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •4.Экспериментальная часть.
- •Сравнение химической активности электролитов.
- •2. Влияние сильного электролита, содержащего одноименный ион, на диссоциацию слабого электролита.
- •3. Реакции обмена в растворах электролитов.
- •Лабораторная работа № 7 Водородный показатель. Гидролиз солей.
- •1. Разделы теоретического курса для повторения.
- •2. Теоретическая часть.
- •Определение рН среды колориметрическим методом.
- •Изменение окраски индикаторов в зависимости от реакции среды.
- •Определение рН среды потенциометрическим методом.
- •Гидролиз
- •Гидролиз солей.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •4. Экспериментальная часть.
- •1. Определение реакции среды колориметрическим методом.
- •Определение реакции среды и величины водородного показателя среды некоторых растворов колориметрическим методом.
- •Б) Определение реакции среды с помощью универсальной индикаторной бумаги.
- •2. Определение рН среды потенциометрическим методом.
- •Результаты определения величины рн среды потенциометрическим методом.
- •Порядок измерения величины рН растворов.
- •3. Влияние разбавления на глубину протекания процесса гидролиза.
- •4. Влияние нагревания на процесс гидролиза.
- •5. Взаимное усиление гидролиза.
- •6. Растворение активного металла в продуктах гидролиза.
- •7. Связь между константой гидролиза Кгидр. И константой диссоциации слабого электролита, образующего гидролизующуюся соль.
Лабораторная работа № 5 Химическая кинетика и химическое равновесие.
1. Разделы курса, необходимые для подготовки к лабораторной работе.
Понятие о системе. Гомогенные и гетерогенные системы. Открытые, закрытые и изолированные системы. Скорость химической реакции. Факторы, влияющие на скорость реакций. Закон действующих масс. Кинетические уравнения химических реакций. Константа скорости химической реакции. Энергетические диаграммы химических процессов. Энергия активации. Зависимость константы скорости реакции от энергии активации (уравнение Аррениуса). Влияние температуры на скорость реакции (правило Вант-Гоффа). Температурный коэффициент реакции. Катализ. Катализаторы и ингибиторы. Химическое равновесие. Константа химического равновесия. Факторы, способствующие смещению химического равновесия. Принцип Ле Шателье.
При изучении теории по этому разделу и для подготовки к лабораторной работе рекомендуется воспользоваться материалом, изложенным в гл. 6 учебного пособия Рыбальченко В.С. « Основы общей химии» и изучить материал, предлагаемый в следующем разделе.
2. Теоретическая часть. Химическая кинетика.
Химическая кинетика раздел химии, изучающий химическую реакцию как процесс, протекающий во времени, механизм этого процесса, его зависимость от условий осуществления.
Химическая кинетика устанавливает временные закономерности протекания химических реакций, связь между скоростью реакции и условиями ее проведения, выявляет факторы, влияющие на скорость и направление химических реакций.
Любой химический процесс представляет собой превращение реагентов в продукты реакции:
Реагенты→ переходное состояние→ продукты реакции.
Реагенты (исходные вещества) вещества, вступающие в процесс химического взаимодействия.
Продукты реакции вещества, образующиеся в конце процесса химического превращения. В обратимых процессах продукты прямой реакции являются реагентами обратной реакции.
Химические реакции могут быть как необратимыми, так и обратимыми.
Необратимые реакции реакции, протекающие при данных условиях практически в одном направлении (обозначают знаком →).
Например:
CaCO3 → CaO + CO2 ↑
 Обратимые
реакции
реакции, протекающие одновременно в
двух противоположных направлениях
(обозначают знаком ).
Обратимые
реакции
реакции, протекающие одновременно в
двух противоположных направлениях
(обозначают знаком ).
Например:
 H2
+ I2
2HI
H2
+ I2
2HI
Переходное состояние (активированный комплекс) это состояние химической системы, являющееся промежуточным между исходными веществами (реагентами) и продуктами реакции. В этом состоянии происходит разрыв старых химических связей и образования новых химических связей. Далее активированный комплекс превращается в продукты реакции.
Большинство химических реакций являются сложными и состоят из нескольких стадий, называемых элементарными реакциями.
Элементарная реакция единичный акт образования или разрыва химической связи. Совокупность элементарных реакций, из которых складывается химическая реакция, определяет механизм химической реакции.
В уравнении химической реакции обычно указывается начальное состояние системы (исходные вещества) и её конечное состояние (продукты реакции). В то же время фактический механизм химической реакции может быть достаточно сложным и включать в себя целый ряд элементарных реакций. К сложным химическим реакциям относятся обратимые, параллельные, последовательные и другие многостадийные реакции (цепные реакции,сопряженные реакциии пр.).
Если скорости различных стадий химической реакции существенно различаются, то скорость сложной реакции в целом определяется скоростью самой медленной ее стадии. Такую стадию (элементарную реакцию) называют лимитирующей стадией.
В зависимости от фазового состояния реагирующих веществ, различают два типа химических реакций: гомогенные и гетерогенные.
Фазой называется часть системы, отличающаяся по своим физическим и химическим свойствам от других частей системы и отделенная от них поверхностью раздела. Системы, состоящие из одной фазы, называются гомогенными системами, из нескольких фаз – гетерогенными. Примером гомогенной системы может быть воздух, представляющий собой смесь веществ (азот, кислород и др.), находящихся в одинаковой газовой фазе. Суспензия мела (твердого вещества) в воде (жидкость) является примером гетерогенной системы, состоящей из двух фаз.
Соответственно, реакции, в которых взаимодействующие вещества находятся в одной фазе, называются гомогенными реакциями. Взаимодействие веществ в таких реакциях происходит по всему объёму реакционного пространства.
К гетерогенным реакциям относят реакции, протекающие на границе раздела фаз. Примером гетерогенной реакции может служить реакция цинка (твердая фаза) с раствором соляной кислоты (жидкая фаза). В гетерогенной системе реакция всегда происходит на поверхности раздела двух фаз, так как только здесь реагирующие вещества, находящиеся в разных фазах, могут сталкиваться между собой.
Скорости химических реакций могут существенно отличаться. Химические реакции могут протекать крайне медленно, а могут протекать практически мгновенно.
Скорость химической реакции служит количественной мерой интенсивности ее протекания.
В общем случае под скоростью химической реакции понимают число элементарных актов реакции, происходящих в единицу времени в единице реакционного пространства.
Так как для гомогенных процессов реакционным пространством является объем реагирующих веществ, то для гомогенных реакций скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема.
Учитывая, что количество вещества, содержащееся в определенном объеме, характеризует концентрацию вещества, то скорость реакции это величина, показывающая изменение молярной концентрации одного из веществ в единицу времени.
Это определение можно записать в виде производной:
v = dc/dt, где:
v – скорость реакции; t – время, c – концентрация.
Эту скорость легко определить, если есть экспериментальные данные по зависимости концентрации вещества от времени. По этим данным можно построить график, который называется кинетической кривой.
Если время измерять в секундах, а концентрацию – в молях на литр, то скорость реакции измеряется в единицах моль/(л·с). Таким образом, скорость реакции не зависит от объема реакционной смеси. Величина dt всегда положительна, тогда как знак dc зависит от того, как изменяется со временем концентрация – уменьшается (для исходных веществ) или увеличивается (для продуктов реакции). Для того чтобы скорость реакции всегда оставалась величиной положительной, в случае ее определения по изменению концентрации исходных веществ перед производной ставят знак минус:
v = –dc/dt.
Если реакция идет в газовой фазе, то вместо концентрации веществ в уравнении скорости часто используют давление. Если газ близок к идеальному, то давление р связано с концентрацией с простым уравнением:
p = cRT.
Так как для гетерогенных реакций реакционным пространством является поверхность, на которой протекает реакция, то для гетерогенных химических реакций скорость реакции относится к единице площади поверхности, на которой протекает реакция.
Скорость химической реакции зависит от целого ряда факторов:
• природы реагирующих веществ;
• концентрации реагирующих веществ;
• давления (для газовых систем);
• температуры системы;
• площади поверхности (для гетерогенных систем);
• наличия в системе катализатора и других факторов.
Так как каждое химическое взаимодействие является результатом столкновения частиц, то увеличение концентрации (числа частиц в заданном объеме) приводит к более частым их столкновениям, и как следствие, к увеличению скорости реакции. Зависимость скорости химических реакций от молярных концентраций реагирующих веществ описывается основным законом химической кинетики законом действующих масс.
Закон действующих масс гласит: скорость элементарной химической реакции при постоянной температуре прямо пропорциональна произведению молярных концентраций реагирующих веществ в степенях, равных их стехиоме-трическим коэффициентам.
Уравнение, выражающее зависимость скорости реакции от концентрации каждого вещества, называют кинетическим уравнением реакции.
В общем случае, если в элементарную реакцию вступают одновременно т молекул вещества А и n молекул вещества В:
mА + nВ = С,
то уравнение для скорости реакции (кинетическое уравнение) имеет вид:
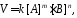 где
где
k коэффициент пропорциональности, который называется константой скорости химической реакции;
[А] молярная концентрация вещества А;
[B] молярная концентрация вещества B;
m и n стехиометрические коэффициенты в уравнении реакции.
Константа скорости реакции k численно равна скорости реакции, в которой концентрации реагирующих веществ (или их произведение в кинетических уравнениях) равны единице.
Константа скорости реакции k зависит от природы реагирующих веществ и температуры, но не зависит от значения концентрации реагентов.
Для гетерогенных реакций концентрация твердой фазы в выражение для скорости химической реакции (кинетическое уравнение) не включается.
Например, в реакции синтеза метана:
С(т)
+ 2H2(г)
![]() CH4(г),
CH4(г),
согласно законудействующих масс, скорость реакции определяется только концентрацией водорода, а площадь поверхности твердого углерода учитывается константой скорости химической реакцииk. Кинетическое уравнение для этой реакции будет имеет вид:
V = k [H2]
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
при повышении температуры на каждые 100С скорость химической реакции возрастает в два - четыре раза.
 ,
где:
,
где:
V1 – скорость реакции при начальной температуре системы t1,
V2 – скорость реакции при конечной температуре системы t2,
γ – температурный коэффициент реакции (коэффициент Вант-Гоффа), равный 2÷4.
Знание величины температурного коэффициента γ дает возможность рассчитать изменение скорости реакции при увеличении температуры от Т1 до Т2. В этом случае можно использовать формулу:

Очевидно, что при повышении температуры в арифметической прогрессии скорость реакции возрастает в геометрической прогрессии. Влияние температуры на скорость реакции тем значительнее, чем больше значение температурного коэффициента реакции.
Катализаторы это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождаются (регенирируются) в конце реакции.
Явление ускорения химических реакций при введении катализаторов называется катализом.
Различают гомогенный катализ (катализатор образует с реагирующими веществами гомогенную систему, например, газовую смесь) и гетерогенный катализ (катализатор и реагирующие вещества находятся в разных фазах и каталитический процесс идет на поверхности раздела фаз).
Вещества, повышающие активность катализатора называют промоторами (или активаторами). При этом, сами промоторы могут и не обладать каталитическими свойствами.
Каталитические яды посторонние примеси в реакционной смеси, приводящие к частичной или полной потере активности катализатора. Так, следы фосфора и мышьяка вызывают быструю потерю катализатором V2O5 активности в реакции окисления SO2 в SO3.
Биохимические реакции в растительных и животных организмах ускоряются биохимическими катализаторами ферментами.
Резко замедлить протекание нежелательных химических процессов можно при добавлении в реакционную среду специальных веществ ингибиторов. Например, для торможения нежелательных процессов коррозионного разрушения металлов широко используются различные ингибиторы коррозии металлов.
