
- •Лабораторная работа № 4. Приготовление растворов заданного количественного состава. Определение концентрации растворов титрованием.
- •1. Разделы теоретического курса для повторения.
- •2. Теоретическая часть.
- •7. Моляльность. Моляльность раствора характеризуется количеством растворенного вещества в молях, приходящихся на 1 кг растворителя в данном растворе.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •В рабочем журнале оформите раздел 4 и распечатайте его для выполнения в лаборатории(2 стр. На листе).
- •Зависимость плотности раствора от массовой доли растворенного вещества 20◦ , (г/см3)
- •Данные для приготовления раствора заданного количественного состава
- •Результаты эксперимента по приготовлению раствора заданного количественного состава.
- •Количественный состав раствора с заданной массовой долей, выраженный иными способами.
- •Часть 2. Определение концентрации растворов кислот и щелочей титрованием.
- •Результаты титрования раствора щелочи раствором кислоты.
- •Лабораторная работа № 5 Химическая кинетика и химическое равновесие.
- •1. Разделы курса, необходимые для подготовки к лабораторной работе.
- •2. Теоретическая часть. Химическая кинетика.
- •Реагенты→ переходное состояние→ продукты реакции.
- •Химическое равновесие.
- •Смещение химического равновесия.
- •Влияние изменения концентрации на смещение химического равновесия.
- •Влияние изменения давления на смещение химического равновесия.
- •Влияние изменения температуры на смещение химического равновесия.
- •Влияние катализатора на состояние химического равновесия.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •В рабочем журнале оформите раздел 4 и распечатайте его для выполнения в лаборатории(2 стр. На листе).
- •Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ.
- •Зависимость скорости реакции от условной концентрации раствора
- •Опыт 2. Зависимость скорости реакции от температуры.
- •Зависимость скорости реакции от температуры.
- •Опыт 3. Влияние площади поверхности на скорость реакции в гетерогенной системе.
- •Часть 2. Химическое равновесие.
- •Влияние изменения концентрации реагентов и продуктов реакции на смещение химического равновесия.
- •Лабораторная работа № 6. Электролитическая диссоциация.
- •2. Теоретическая часть.
- •Зависимость силы электролита от значения константы его диссоцации.
- •Реакции в растворах электролитов.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •4.Экспериментальная часть.
- •Сравнение химической активности электролитов.
- •2. Влияние сильного электролита, содержащего одноименный ион, на диссоциацию слабого электролита.
- •3. Реакции обмена в растворах электролитов.
- •Лабораторная работа № 7 Водородный показатель. Гидролиз солей.
- •1. Разделы теоретического курса для повторения.
- •2. Теоретическая часть.
- •Определение рН среды колориметрическим методом.
- •Изменение окраски индикаторов в зависимости от реакции среды.
- •Определение рН среды потенциометрическим методом.
- •Гидролиз
- •Гидролиз солей.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •4. Экспериментальная часть.
- •1. Определение реакции среды колориметрическим методом.
- •Определение реакции среды и величины водородного показателя среды некоторых растворов колориметрическим методом.
- •Б) Определение реакции среды с помощью универсальной индикаторной бумаги.
- •2. Определение рН среды потенциометрическим методом.
- •Результаты определения величины рн среды потенциометрическим методом.
- •Порядок измерения величины рН растворов.
- •3. Влияние разбавления на глубину протекания процесса гидролиза.
- •4. Влияние нагревания на процесс гидролиза.
- •5. Взаимное усиление гидролиза.
- •6. Растворение активного металла в продуктах гидролиза.
- •7. Связь между константой гидролиза Кгидр. И константой диссоциации слабого электролита, образующего гидролизующуюся соль.
7. Моляльность. Моляльность раствора характеризуется количеством растворенного вещества в молях, приходящихся на 1 кг растворителя в данном растворе.
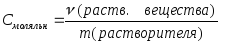
Наконец, характеризуя количественный состав системы, можно говорить об отношениях массы (или объема или количеств вещества) компонента к массе (или объему или количеству вещества) всей системы. В этом случае мы имеем дело с отношением, которое может быть, соответственно: массовым, объемным или молярным.
Например, если объемное отношение концентрированной серной кислоты и воды равно:
V (H2SO4) : V (H2O) = 1 : 2
это значит, что для приготовления данного раствора необходимо к 1 объему концентрированной серной кислоты добавить 2 объема воды.
При решении задач на смешивание растворов одного и того же вещества или при решении задач на разбавление более концентрированных растворов более разбавленными растворами или водой удобно пользоваться “правилом смешения растворов” (квадратом Пирсона):
раствор с большей масса раствора с большей
массовой долей массовой долей
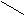

ω1 раствор с требуемой ωтреб – ω2 => m1
массовой долей
ωтреб.
ω2 ω1 – ωтреб. => m2
раствор с меньшей масса раствора с меньшей
массовой долей массовой долей
В случае разбавления раствора с большей массовой долей растворенного вещества водой, значение массовой доли более разбавленного раствора (в данном случае воды) принимается равным нулю (ω2 = 0).
Для практического определения количественного состава растворов в лабораторной практике часто используется метод титрования
Титрование (титриметрия) — метод количественного анализа, основанный на измерении объема раствора реактива с точно известной концентрацией, прореагировавшего с определенным объемом раствора анализируемого вещества.
При проведении титрования к измеренному пипеткой или пипет-дозатором объему анализируемого раствора, находящегося в конической колбе, постепенно прибавляют из бюретки титрованный раствор реактива (т.е. раствор с известной концентрацией). Титрование заканчивают, когда анализируемое вещество полностью прореагирует с добавляемым реактивом. Конец титрования (точку эквивалентности) устанавливают по изменению окраски соответствующего индикатора или другими способами (по электропроводности, светопропусканию, потенциалуиндикаторного электрода и т.д.) Далее по шкале бюретки определяют объем раствора реагента, пошедшего на титрование.
Используя закон эквивалентов для растворов, в соответствии с которым произведение нормальной концентрации раствора одного из взаимодействующих веществ на объем этого раствора равно произведению нормальной концентрации раствора другого взаимодействующего вещества на объем раствора этого вещества можно найти искомую величину нормальной концентрации определяемого вещества в растворе.
Снорм 1 ∙ V1 = Снорм. 2 ∙ V2 где:
Снорм. 1 и V1 - нормальная концентрация (молярная концентрация эквивалента) и объем раствора анализируемого вещества,
Снорм. 2 и V 2- нормальная концентрация (молярная концентрация эквивалента) и объем раствора с известной концентрацией.
Титриметрический анализ может быть основан на различных типах химических реакций:
кислотно-основное титрование- реакциинейтрализации;
окислительно-восстановительное титрование-окислительно-восстановительные реакции;
осадительное титрование- реакции, протекающие с образованием малорастворимого соединения;
комплексиметрическое титрование- реакции, основанные на образовании прочныхкомплексных соединений.
