
- •Раздел I
- •Глава 2
- •Генциалы, потенциалы покоя и действия некоторых ни разных авторов)
- •Вну трепни* потенциал
- •Время, мс ф
- •Осциллограф
- •Наружная сторона Потенциал
- •Рефрактерный период
- •Глава 3
- •0.2 СРис. 28. Кривые двух одиночных сокращений н :u.U про найми го мышечного ммокна.
- •Длина саркомера 3.6 мим
- •Раздел II
- •Глава 5
- •I3»4cTpatM6t04Hafl f среда
- •Глава 6
- •7 Физиология человека
- •Глава 9
- •Состав различных физиологических растворов
- •Гемоглобин 68000
- •Альбумин 69000
- •-Липопротеин
- •Фибриноген 400000
- •Окончательный фибрин (фибрин „Iй)
- •I ♦Плазмин
- •I фаза и фазаIii фаза
- •При мышечном сокращении.
- •0 20 40 60 80 100 Напряжение 02 в мм рт.Ст.
- •В кнанян
- •Глава 12
- •Пе механизму воздействий
- •I датчик мастика циографа; 2 — электроды лля отведении биопотенциалов жеигмельиых мышц.
- •Вил капсулы изображен в нижней части рисунка. I трубка для отсасывании аоз- духа из внешней камеры капсулы; 2 — трубка для оттока слюны из внутренней камеры капсулы.
- •Блок-схема элеитрогастрографа эгс-3
- •Электрогастрографа
- •1 2345678 123456789 10 1 234 5 6 Часы
- •Пусковые внешние воздействия
- •Глава 13
- •22,4 Л углекислого газа 46,63-22,4 —.37 04зл сОг.Далее, исходя из дыхательного коэффициента,
- •Глава 14
- •Глава 15
- •Глава 14 635
- •Глава 15 642
- •Глава 16 761
- •Глава 18 852
- •Глава 16
- •Глава 17
- •Глава 18
- •Глава 19
- •Глава 14 635
- •Глава 15 642
- •Глава 16 761
- •Глава 18 852
Эритроцит Плазма
Нлетни
Альвеолярный
Эритроцит Плазма воздух
В
легиич
Рис.
153. Процессы, происходящие в эритроците
при поглощении или отдаче кровью
кислорода и двуокиси углерода (схема).
В кнанян

троцитах оказывается невысоким. Поэтому все новые количества двуокиси углерода диффундируют внутрь эритроцитов. Концентрация ионов НСОз", образующихся при диссоциации солей угольной кислоты, в эритроцитах возрастает. Мембрана эритроцитов обладает высокой проницаемостью для анионов. Поэтому часть ионов НСОз" поступает в плазму крови. Взамен ионов НС03" в эритроциты из плазмы входят ионы С1", отрицательные заряды которых уравновешиваются ионами К+В плазме крови увеличивается количество бикарбоната натрия(NaHC03).
Накопление ионов внутри эритроцитов сопровождается повышением в них осмотического давления. Поэтому объем эритроцитов в капиллярах большого круга кровообращения несколько увеличивается.
Для связывания большей части двуокиси углерода исключительно большое значение имеют свойства гемоглобина как кислоты. Оксигемоглобин имеет константу диссоциации в 70 раз большую, чем дезоксигемоглобчн. Оксигемоглобин — более сильная кислота, чем угольная, а дезоксигемоглобин — более слабая. Поэтому в артериальной крови оксигемоглобин, вытеснивший ионы К+из бикарбонатов, переносится в виде соли КНЬ02. В тканевых капиллярах часть КНЬ02отдает кислород и превращается в КНЬ. Из него угольная кислота как более сильная вытесняет ионы К+:
КНЬСЬ + НаСОз « КНЬ + 02+ КНСОз"-
Таким образом, превращение оксигемоглобина в гемоглобин сопровождается увеличением способности крови связывать двуокись углерода. Это явление носит название эффекта Хрлдейна.Гемоглобин служит источником катионов (К+), необходимых для связывания угольной кислоты в форме бикарбонатов.
Итак, в эритроцитах тканевых капилляров образуется дополнительное количество бикарбоната калия, а также карбгемоглобин, а в плазме крови увеличивается количество бикарбоната натрия. В таком виде двуокись углерода переносится к легким.
В капиллярах малого круга кровообращения напряжение двуокиси углерода снижается. От карбгемоглобина отщепляется С02Одновременно происходит образование оксигемоглобина, увеличивается его диссоциация. Оксигемоглобин вытесняет калий из бикарбонатов. Угольная кислота в эритроцитах (в присутствии карбоангидразы) быстро разлагается на Н20 и С02. Ионы НСОз входят в эритроциты, а ионы СГ выходят в плазму крови, где уменьшается количество бикарбоната натрия. Двуокись углерода диффундирует в альвеолярный воздух. Схематически все эти процессы представлены на рис. 153.
ОБМЕН ГАЗОВ В ТКАНЯХ
Наименьшее напряжение кислорода наблюдается в местах его потребления — митохондриях клеток, в которых кислород используется для процессов биологического окисления. Молекулы кислорода, освобождающиеся по ходу кровеносных капилляров в результате диссоциации оксигемоглобина, диффундируют в направлении более низких величин напряжения кислорода. Напряжение кислорода в тканях зависит от многих факторов: скорости тока крови, геометрии капилляров и расстояния между ними, расположения клеток по отношению к капиллярам, интенсивности окислительных процессов ит.д. В тканевой жидкости около капилляров напряжение кислорода значительно ниже (20—40 мм рт. ст.), чем в крови. Особенно низко оно в участках тканей, равноудаленных от соседних капилляров. При большой интенсивности окислительных процессов напряжение кислорода в клетках может приближаться к нулю. Увеличение скорости кровотока резко повышает напряжение кислорода в тканях. Например, увеличение скорости тока крови вдвое может повысить напряжение кислорода в нервной клетке на 10 мм рт. ст. В мышцах увеличению снабжения кислородом способствует раскрытие так называемых резервных капилляров.
Наибольшее напряжение двуокиси углерода (до 60 мм рт. ст.) отмечается в клетках в результате образования этого газа в митохондриях. В тканевой жидкости напряжение двуокиси углерода изменчиво (в среднем 46 мм рт. ст.), а в артериальной крови составляет 40 мм рт. ст. Двуокись углерода диффундирует по градиенту напряжений в кровеносные капилляры и транспортируется кровью к легким.
РЕГУЛЯЦИЯ ДЫХАНИЯ
Вентиляция легких осуществляется возвратно-поступательным движением воздуха в результате периодических сокращений дыхательных мышц. Частота, сила и форма этих сокращений соответствуют потребностям организма.
Иннервация дыхательных мышц.Подобно другим скелетным мышцам, дыхательные мышцы иннервируются соматическими нервными волокнами. Если перерезать нервы, подходящие к дыхательным мышцам, последние оказываются парализованными. Например, перерезка диафрагмального нерва ведет к прекращению сокращений соответствующей половины диафрагмы. Значит, периодические сокращения дыхательных мышц вызываются импульсами, поступающими из мозга.
Мотонейроны, аксоны которых иннервируют диафрагму, находятся в спинном мозге в передних рогах серого вещества /// и IV шейных сегментов.Мотонейроны межреберных мышц и мышц живота расположены в грудных сегментахспинного мозга. Вместе с интернейронами, участвующими в координации сокращений, мотонейроны образуют спинномозговые центры дыхания (ядра дыхательных мышц).
После отделения головного мозга от спинного на уровне верхних шейных сегментов дыхательные движения прекращаются. Лишь изредка удается наблюдать слабые сокращения дыхательных мышц, но они имеют неправильные ритм и форму. Если перерезать мозг на уровне нижних шейных сегментов, дыхательная активность диафрагмы сохраняется, а межреберных мышц — прекращается. Следовательно, в регуляции дыхания принимают участие и центры головного мозга.
ДЫХАТЕЛЬНЫЙ ЦЕНТР
После перерезки мозгового ствола между средним мозгом и мостом (децеребрация) дыхание у животных в состоянии покоя существенно не нарушается. Значит, центральные механизмы, управляющие дыхательными движениями, находятся в продолговатом мозге и мосту. Совокупность сгруппированных здесь нейронов носит название булъбопонтин- ного дыхательного центра.После отделения моста от продолговатого мозга дыхательный ритм может сохраниться, но будет отличаться от нормального. Следовательно, важнейшие структуры дыхательного центра находятся в продолговатом мозге. Это бульбарный дыхательный центр.Его разрушение локальным повреждением полностью прекращает периодические сокращения дыхательных мышц.
Дыхательный цикл.Явления, происходящие в аппарате внешнего дыхания между началом следующих друг за другом вдохов, называются дыхательным циклом.Его длительность у человека составляет от 3 до 5 с. Все уровни дыхательного центра обеспечивают характерный рисунок (паттерн) возбуждения дыхательных мышц.
В определенный момент возникает возбуждение диафрагмальных мотонейронов (начало фазы инспирации). Это возбуждение постепенно усиливается (рис. 154) за счет увеличения частоты разрядов отдельных мотонейронов, а также вследствие вовлечения в возбуждение новых («поздних») мотонейронов (в диафрагмалвном нерве содержится около 1000 аксонов мотонейронов). При спокойном дыхании у человека возбуждение усиливается в течение 1—2,5 с. В результате сила сокращения диафрагмы постепенно возрастает. Затем возбуждение диафрагмальных мотонейронов резко ослабевает: инспирация сменяется фазой экспирации. Через 2—3,5 с наступает следующая инспирация. Как правило, длительность инспирации меньше, чем экспирации.
Возбуждение инспираторных межреберных мышц имеет рисунок возбуждения, близкий к возбуждению диафрагмы, но обычно возникает несколько позже, чем возбуждений диафрагмы.

Рис.
154. Форма инсмираторной и экспираторной
активности.
1
-- потенциалы дейстния одиночного
двигательного волокна днафрагмального
нерва; 2 — интегрированные потенциалы
действия днафрагмального нерва; 3 —
интегрированные потенциалы действия
экспираторной мышцы: 4 — отметка времени
1 с.
Рис.
155.
Потенциалы действия одиночных
инспнраторного (I)
н
экспираторного
(2)
нейронов. 3
— интегрированные потенциалы действия
днафрагмального нерва; 4 — фазы дыхательно!
и цикли: И - инспирация; Э -- экспирация.
При активном выдохе возбуждение мышц живота и внутренних межреберных мышц усиливается по ходу экспирации и резко ослабевает перед началом следующей инспирации (см. рис. 154).
Дыхательные нейроны.Для установления локализации дыхательного центра использовали методы разрушения и раздражения ограниченных участков мозга. Однако основные сведения о расположении структур дыхательного центра были получены при помощи микроэлектродов путем регистрации потенциалов действия отдельных нейронов, возбуждающихся в соответствии с фазами дыхательного цикла.
Обнаружены две основные группы дыхательных нейронов — инспираторные и экспираторные. Потенциалы действия типичных инспираторных нейронов возникают за 0,1 — 0,2 с до начала вдоха. При вдохе частота разрядов постепенно увеличивается и к концу инспирации достигает 70—100 в 1 с (при сильных вдохах до 300). При смене вдоха выдохом разряды прекращаются или их частота резко уменьшается.
Частота потенциалов действия экспираторных нейронов увеличивается в течение выдоха. Прекращение разрядов или уменьшение их частоты происходит перед самым началом следующей инспирации (рис. 155).
Реже встречаются инспираторные и экспираторные нейроны, максимальная частота разрядов которых соответствует началу данной фазы дыхательного цикла («ранние» нейроны) или моменту смены дыхательных фаз (инспираторно-экспираторные и экспираторно-инспираторные нейроны).
Локализация дыхательных нейронов.В правой и левой половинах продолговатого мозга содержатся по два скопления дыхательных нейронов — дорсальныеи вентральные дыхательные ядра.Ориентиром их расположения служит задвижка (обекс), находящаяся у нижнего угла ромбовидной ямки.
Дорсальное дыхательное ядро входит в состав серого вещества, окружающего одиночный пучок (ядро одиночного пучка) (рис. 156). Оно содержит преимущественно инспираторные нейроны, аксоны которых направляются в основном к диафрагмальным ядрам шейного отдела спинного мозга. Коллатерали аксонов следуют также в вентральное дыхательное ядро, образуя возбуждающие синапсы на инспираторных нейронах. Таким образом, возбуждение нейронов дорсального дыхательного ядра тормозит возбуждение экспираторных нейронов вентрального дыхательного ядра. Экспираторные нейроны в дорсальном дыхательном ядре встречаются редко (их здесь около 5%).
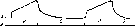
Рис.
156.
Дыхательные
ядра продолговатого
мозга, а
- проекция дыхательных ядер на дорсальную
поверхность продолговатого мозга:
I — обекс; 2 — дорсальное дыхательное
ядро; 3 вентральное дыхательное ядро;
4 — граница моста и продолговатого
мозга; 5 — заднее двухолмие; С1
— корешок спинного мозга. Слева —
оЛластн скопления инсинраторных
нейронов, справа - области скопления
экспираторных нейронов; б — схема
поперечного среза продолговатого
мозга на уровне obex;
Д
— дорсальное дыхательное ядро; В —
вентральное дыхательное ядро; С - стройное
ядро; К — клиновидное ядро; О —одиночный
пучок; CTV
—
ядро спинального тракта тройничного
нерва; РФ ретикулярная формация. XII -
подъязычный нерв, а и — пирамида.
ретроамбигуальиым ядром. Вентральное дыхательное ядро расположено в вентролате- ральной области продолговатого мозга. В вентральном дыхательном ядре содержатся как инспираторные, так и экспираторные нейроны.
Большая часть нейронов вентрального дыхательного ядра посылает аксоны к спинномозговым ядрам дыхательных мышц, в основном межреберных мышц и мышц живота. Примерно 25% волокон разветвляется в области диафрагмальных ядер, 90% аксонов инспираторных нейронов и все аксоны экспираторных нейронов перекрещиваются в продолговатом мозге и следуют к спинномозговым ядрам в вентральном канатике и передней части бокового канатика белого вещества противоположной стороны спинного мозга. Кроме того, в вентральном дыхательном ядре имеются нейроны, аксоны которых оканчиваются в продолговатом мозге (проприобулъбарные нейроны).
Небольшое количество дыхательных нейронов встречается и вне дыхательных ядер — в ретикулярной формации продолговатого мозга и моста.


Третье компактное скопление дыхательных нейронов было обнаружено у животных после перерезки блуждающих нервов в передней части моста, сразу за четверохолмием. Это скопление находится в медиальном парабрахиальном ядре (латеральнее его). При сохраненных блуждающих нервах нейроны этих ядер имеют непрерывную тоническую импульсную активность. Дыхательное ядро переднего моста носит название пневмотак-
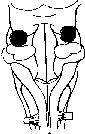

Рис.
157. Локализация пневмо- таксического
центра, а
— проекция пневмотаксического центра
на дорсальную поверхность моста: б —
схема поперечного среза через переднюю
часть моста. Выделен пневмотаксический
центр. ПБМ — медиальное парабрахналь-
ное ядро; СИ — средние ножки мозжечка;
V — тройничный нерв; П - пирамида.
Зависимость деятельности дыхательного центра
от газового состава крови
Деятельность дыхательного центра, определяющая частоту и глубину дыхания, зависит прежде всего от напряжения газов, растворенных в крови, и концентрации в ней водородных ионов. Ведущее значение в определении величины вентиляции легких имеет напряжение двуокиси углерода в артериальной крови: оно как бы создает запрос на нужную величину вентиляции альвеол.
Образование в тканях двуокиси углерода пропорционально интенсивности окислительных процессов. Количество этого газа в крови в значительной степени обусловливает ее кислотно-щелочное состояние. Отсюда следует целесообразность поддержания на постоянном уровне напряжения двуокиси углерода в артериальной крови.
Организм здорового человека в обычных условиях снабжается кислородом в достаточном (а не минимальном) количестве. Исключение составляют лишь условия напряженной физической работы. Так, парциальное давление кислорода в альвеолярном воздухе может быть снижено до 80 мм рт. ст. без заметных нарушений в организме. С другой стороны, увеличение содержания кислорода во вдыхаемом воздухе до 40% (парциальное давление 304 мм рт. ст.) также является безвредным.
Таким образом, организм наземных животных и человека в процессе эволюции приспособился к дыханию атмосферным воздухом при обычном (на уровне моря) или несколько сниженном (на небольших высотах) атмосферном давлении. При этом напряжение двуокиси углерода поддерживается на относительно постоянном уровне, при котором организм обеспечивается вполне достаточным количеством кислорода.
Для обозначения повышенного, нормального и сниженного напряжения двуокиси углерода в крови используют термины «гиперкапния», шормокапния»и "гипокапния" соответственно. Нормальное содержание кислорода называется нормоксией,а недостаток кислорода в организме и тканях — гипоксией, в крови — гипоксемией.Увеличение напряжения кислорода есть гипероксия.Состояние при котором гиперкапния и гипоксия существуют одновременно, называется асфиксией.
Нормальное дыхание в состоянии покоя называется эйпноэ.Гиперкапния, а также снижение величины рН крови (ацидоз) сопровождаются увеличением вентиляции легких — гиперпноэ,направленным на выведение из организма избытка двуокиси углерода. Вентиляция легких возрастает преимущественно за счет глубины дыхания (увеличения дыхательного объема), но при этом возрастает и частота дыхания.
Гипокапния и повышение уровня рН крови ведут к уменьшению вентиляции, а затем и к остановке дыхания — апноэ.
Развитие гипоксии вначале вызывает умеренное гиперпноэ (в основном в результате возрастания частоты дыхания), которое при увеличении степени гипоксии сменяется ослаблением дыхания и его остановкой. Апноэ вследствие гипоксии смертельно опасно. Его причиной является ослабление окислительных процессов в мозге, в том числе в нейронах дыхательного центра. Гипоксическому апноэ предшествует потеря сознания.
Гиперкапнию можно вызвать вдыханием газовых смесей с повышенным до 6% содержанием двуокиси углерода. Деятельность дыхательного центра человека находится под произвольным контролем. Произвольная задержка дыхания на 30—60 с вызывает асфик- тические изменения газового состава крови, после прекращения задержки наблюдается гиперпноэ. Гипокапнию легко вызвать произвольным усилением дыхания, а также избыточной искусственной вентиляцией легких (гипервентиляция). У бодрствующего человека даже после значительной гипервентиляции остановки дыхания обычно не возникает вследствие контроля дыхания передними отделами мозга. Гипокапния компенсируется постепенно, в течение нескольких минут.
Гипоксия наблюдается при подъеме на высоту вследствие снижения атмосферного давления, при крайне тяжелой физической работе, а также при нарушениях дыхания, кровообращения и состава крови.
Во время сильной асфиксии дыхание становится максимально глубоким, в нем принимают участие вспомогательные дыхательные мышцы, возникает неприятное ощущение удушья. Такое дыхание называется диспноэ.
В целом поддержание нормального газового состава крови основано на принципе отрицательной обратной связи.Так, гиперкапния вызывает усиление активности дыхательного центра и увеличение вентиляции легких, а гипокапния — ослабление деятельности дыхательного центра и уменьшение вентиляции.
Роль хеморецепторов в регуляции дыхания
Давно установлено, что деятельность дыхательного центра зависит от состава крови, поступающей в мозг по общим сонным артериям.
Это было показано Фредериком (1890) в опытах с перекрестным кровообращением. У двух собак, находившихся под наркозом, перерезали и соединяли перекрестно сонные артерии и отдельно яремные вены (рис. 158). После такого соединения и перевязки позвоночных артерий голова первой собаки снабжалась кровью второй собаки, голова второй собаки — кровью первой. Если у одной из собак, например у первой, перекрывали трахею и вызывали таким путем асфиксию, то гиперпноэ развивалось у второй собаки. У первой же собаки, несмотря на увеличение в артериальной крови напряжения двуокиси углерода и снижение напряжения кислорода, через некоторое время наступало апноэ. Это объясняется тем, что в сонную артерию первой собаки поступала кровь второй собаки, у которой в результате гипервентиляции в артериальной крови снижалось напряжение двуокиси углерода.
Двуокись углерода, водородные ионы и умеренная гипоксия вызывают усиление дыхания, действуя не непосредственно на нейроны дыхательного центра. Возбудимость дыхательных нейронов, как и других нервных клеток, под влиянием этих факторов снижается. Следовательно, эти факторы усиливают деятельность дыхательного центра, оказывая влияние на специальные хеморецепторы. Имеется две группы хеморецепторов, регулирующих дыхание: периферические (артериальные)и центральные (медуллярные).
Артериальные хеморецепторы.Хеморецепторы, стимулируемые увеличением напряжения двуокиси углерода и снижением напряжения кислорода, находятся в каротидных синусах и дуге аорты. Они расположены в специальных маленьких тельцах, обильно снабжаемых артериальной кровью. Важными для регуляции дыхания являются каротид- ные хеморецепторы. Аортальные хеморецепторы на дыхание влияют слабо и имеют большее значение для регуляции кровообращения.
Каротидные тельца расположены в развилке общей сонной артерии на внутреннюю и наружную. Масса каждого каротидного тельца всего около 2 мг. В нем содержатся относительно крупные эпителиоидные клетки I типа, окруженные мелкими интерстициальными клетками II типа. С клетками I типа контактируют окончания афферентных волокон синусного нерва (нерва Геринга), который является ветвью языкоглоточного нерва. Какие структуры тельца — клетки I или II типа либо нервные волокна — являются собственно рецепторами, точно не установлено.
Хеморецепторы каротидных и аортальных телец являются уникальными рецептор- ными образованиями, на которые гипоксия оказывает стимулирующее влияние. Афферентные сигналы в волокнах, отходящих от каротидных телец, можно зарегистрировать и при нормальном (100 мм рт. ст.) напряжении кислорода в артериальной крови. При снижении напряжения кислорода от 80 до 20 мм рт. ст. частота импульсов увеличивается особенно значительно.
Кроме того, афферентные влияния каротидных телец усиливаются при повышении в артериальной крови напряжения двуокиси углерода и концентрации водородных ионов. Стимулирующее действие гипоксии и гиперкапнии на данные хеморецепторы взаимно усиливается. Наоборот, в условиях гипероксии чувствительность хеморецепторов к двуокиси углерода резко снижается.
Хеморецепторы телец особенно чувствительны к колебаниям газового состава крови. Степень их активации возрастает при колебаниях напряжения кислорода и двуокиси
Рис. 158. Схема опыта Фредерика с перекрестным кровообращением. рисРасположение хсморс це и го ров на вентральной , поверхности продолговатого
углерода в артериальной крови даже в зависимости от фаз М03Га.
вдоха и выдоха при глубоком и редком дыхании.
Чувствительность хеморецепторов находится ПОД ^ем/и и; Я'руЧ-Л мТостЮ 111 Г-"
нервным контролем. Раздражение эфферентных пара- пирамида; V ихп-- черепнп-
симпатических ВОЛОКОН снижает чувствительность, а мозговые нервы; С, - первый
J спинномозговой
корешок.
раздражение симпатических волокон повышает ее
Хеморецепторы (особенно каротидных телец) информируют дыхательный центр о напряжении кислорода и двуокиси углерода в крови, направляющейся к мозгу.
Центральные хеморецепторы.После денервации каротидных и аортальных телец исключается усиление дыхания в ответ на гипоксию. В этих условиях гипоксия вызывает только снижение вентиляции легких, но зависимость деятельности дыхательного центра от напряжения двуокиси углерода сохраняется. Она обусловлена функцией центральных хеморецепторов.
Центральные хеморецепторы были обнаружены в продолговатом мозге латеральнее пирамид (рис. 159). Перфузия этой области мозга раствором со сниженным рН резко усиливает дыхание. Если рН раствора увеличить, то дыхание ослабевает (у животных с денервированными каротидными тельцами останавливается на выдохе, наступает апноэ). То же присходит при охлаждении или обработке местными анестетиками этой поверхности продолговатого мозга.
Хеморецепторы расположены в тонком слое мозгового вещества на глубине не более 0,2 мм. Обнаружены два рецептивных поля, обозначаемые буквам М и L. Между ними находится небольшое полеS. Оно нечувствительно к концентрации ионов Н+, но при его разрушении исчезают эффекты возбуждения полей М иL. Вероятно, здесь проходят афферентные пути от сосудистых хеморецепторов к дыхательному центру.
В обычных условиях рецепторы продолговатого мозга постоянно стимулируются ионами Н+, находящимися в спинномозговой жидкости. Концентрация Н+в ней зависит от напряжения двуокиси углерода в артериальной крови, она увеличивается при гиперкапнии.
Центральные хеморецепторы оказывают более сильное влияние на деятельность дыхательного центра, чем периферические. Они существенно изменяют вентиляцию легких. Так, снижение рН спинномозговой жидкости на 0,01 сопровождается увеличением вентиляции легких на 4 л/мин.
Вместе с тем центральные хеморецепторы реагируют на изменение напряжения двуокиси углерода в артериальной крови позже (через 20—30 с),чем периферические хеморецепторы (через 3—5 с). Указанная особенность обусловлена тем, что для диффузии стимулирующих факторов из крови в спинномозговую жидкость и далее в ткань мозга необходимо время.
Сигналы, поступающие от центральных и периферических хеморецепторов, являются необходимым условием периодической активности дыхательного центра и соответствия вентиляции легких газовому составу крови. Импульсы от центральных хеморецепторов усиливают возбуждение как инспираторных, так и экспираторных нейронов дыхательного центра продолговатого мозга.
Роль механорецепторов в регуляции дыхания
Рефлексы Геринга и Брейера.Смене дыхательных фаз, т. е. периодической деятельности дыхательного центра, способствуют сигналы, поступающие от механорецепторов легких по афферентным волокнам блуждающих нервов. После перерезки блуждающих нервов, выключающей эти импульсы, дыхание у животных становится более редким и глубоким. При вдохе инспираторная активность продолжает нарастать с прежней скоростью до нового, более высокого уровня (рис. 160). Значит афферентные сигналы, поступающие от легких, обеспечивают смену вдоха на выдох раньше, чем это делает дыхательный центр, лишенный обратной связи с легкими. После перерезки блуждающих нервов удлиняется и фаза выдоха. Отсюда следует, что импульсы от рецепторов легких способствуют и смене выдоха вдохом, укорачивая фазу экспирации.
Геринг и Брейер (1868) сильные и постоянные дыхательные рефлексы обнаружили при изменениях объема легких. Увеличение объема легких вызывает три рефлекторных эффекта. Во-первых, раздувание легких при вдохе может его преждевременно прекратить (инспираторно-тормозящий рефлекс).Во-вторых, раздувание легких при выдохе задерживает наступление следующего вдоха, удлиняя фазу экспирации (экспираторно-облег- чающий рефлекс).В-третьих, достаточно сильное раздувание легких вызывает короткое (0,1—0,5 с) сильное возбуждение инспираторных мышц, возникает судорожный вдох — «вздох» (парадоксальный эффект Хэда).
Уменьшение объема легких обусловливает усиление инспираторной активности и укорочение выдоха, т. е. способствует наступлению следующего вдоха (рефлекс на спадение легких).
Таким образом, деятельность дыхательного центра зависит от изменений объема легких. Рефлексы Геринга и Брейера обеспечивают так называемую объемную обратную связьдыхательного центра с исполнительным аппаратом дыхательной системы.
Значение рефлексов Геринга и Брейера состоит в регулировании сортношения глубины и частоты дыхания в зависимости от состояния легких. При сохраненных блуждающих нервах гиперпноэ, вызываемое гиперкапнией или гипоксией, проявляется увеличением как глубины, так и частоты дыхания. После выключения блуждающих нервов учащения дыхания не происходит, вентиляция легких постепенно растет только вследствие увеличения глубины дыхания. В результате максимальная величина вентиляции легких оказывается сниженной приблизительно вдвое. Таким образом, сигналы от рецепторов легких обеспечивают повышение частоты дыхания при гиперпноэ, наступающем при гиперкап- нии и гипоксии.
У взрослого человека в отличие от животных значение рефлексов Геринга и Брейера в регуляции спокойного дыханияневелико. Временная блокада блуждающих нервов местными анестетиками не сопровождается существенным изменением частоты и глубины дыхания. Однако увеличение частоты дыхания при гиперпноэ у человека, как и животных, обеспечивается рефлексами Геринга и Брейера: это увеличение выключается блокадой блуждающих нервов.
Рефлексы Геринга и Брейера хорошо выражены у новорожденных. Эти рефлексы играют важную роль в укорочении дыхательных фаз, в особенности выдохов. Величина
Рис. 160. Измненения дыхания после перерезки блуждающих нервов. Интегрированная инспи- раторная активность диафрагмального нерва.
1 —до перерезки блуждающих нервов; 2 — после перерезки блуждающих нервов; 3 -- отметка времени I с.
рефлексов Геринга и Брейера уменьшается в первые дни и недели после рождения. В легких имеются многочисленные окончания афферентных нервных волокон. Известны три группы рецепторов легких: рецепторы растяжения легких, ирритантные рецепторы и юкстаальвеолярные рецепторы капилляров (j-рецепторы). Специализированные хеморецепторы для двуокиси углерода и кислорода отсутствуют.
Рецепторы растяжения легких.Возбуждение этих рецепторов возникает или усиливается при возрастании объема легких. Частота потенциалов действия в аффе рентных волокнах рецепторов растяжения увеличивается при вдохе и снижается при выдохе. Чем глубже вдох, тем больше частота импульсов, посылаемых рецепторами растяжения вдыхательный центр. Рецепторы растяжения легких обладают разными поро гами. Приблизительно половина рецепторов возбуждена и при выдохе, в некоторых из них редкие импульсы возникают даже при полном спадении легких, однако при вдохе частота импульсов в них резко увеличивается (низкопороговые рецепторы).Другие рецепторы возбуждаются только при вдохе, когда объем легких увеличивается сверх функциональ ной остаточной емкости (высокопороговые рецепторы).При длительном, на многие секунды, увеличении объема легких частота разрядов рецепторов убывает очень медлен но (рецепторам свойственна медленная адаптация).Частота разрядов рецепторов растяжения легких уменьшается при увеличении содержания двуокиси углерода в про свете воздухоносных путей.
В каждом легком около 1000 рецепторов растяжения. Они расположены преимущественно в гладких мышцах стенок воздухоноеных путей — от трахеи до мелких бронхов. В альвеолах и плевре таких рецепторов нет.
Увеличение объема легких стимулирует рецепторы растяжения косвенно. Непосредственным их раздражителем является внутреннее напряжение стенки воздухоносных путей, зависящее от разности давлений по обе стороны их стенки. С увеличением объема легких возрастает эластическая тяга легких. Стремящиеся спадаться альвеолы растягивают стенки бронхов в радиальном направлении. Поэтому возбуждение рецепторов растяжения зависит не только от объема легких, но и от эластических свойств легочной ткани, от ее растяжимости. Возбуждение рецепторов внелегочных воздухоносных путей (трахеи и крупных бронхов), находящихся в грудной полости, определяется в основном отрицательным давлением в плевральной полости, хотя и зависит также от степени сокращения гладкой мускулатуры их стенок.
Раздражение рецепторов растяжения легких вызывает инспираторно-тормозящии рефлекс Геринга и Брейера.Большая часть афферентных волокон от рецепторов растяжения легких направляется в дорсальное дыхательное ядро продолговатого мозга, активность инспираторных нейронов которого изменяется неодинаково. Около 60% инспиратор ных нейронов в этих условиях тормозится. Они ведут себя в соответствии с проявлением инспираторно-тормозящего рефлекса Геринга и Брейера. Такие нейроны обозначаются как 1а. Остальные инспираторные нейроны при раздражении рецепторов растяжения, наоборот, возбуждаются (нейроны 1(3). Вероятно, нейроны 1(3 представляют собой промежуточную инстанцию, через которую осуществляется торможение нейронов 1а и инспиратор ной активности в целом. Предполагают, что они входят в состав механизма выключения вдоха.

электростимуляции. Электростимуляция этих волокон низкими частотами (20—40 в 1 с), наоборот, вызывает удлинение вдохов и укорочение выдохов. Вероятно, относительно редкие разряды рецепторов растяжения легких на выдохе способствуют наступлению следующего вдоха.
Ирритантные рецепторы и их влияние
на дыхательный центр
Названные так рецепторы располагаются преимущественно в эпителии и субэпителиальном слое всех воздухоносных путей. Особенно много их в области корней легких. Ирритантные рецепторы обладают одновременно свойствами механо- и хеморецепторов. Они раздражаются при достаточно сильных изменениях объема легких, причем как при увеличении, так и при уменьшении. Пороги возбуждения ирритантных рецепторов выше, чем у большинства рецепторов растяжения легких. Импульсы в афферентных волокнах ирритантных рецепторов возникают только на короткое время в форме вспышек, во время изменения объема (проявление быстрой адаптации).Поэтому иначе их называют быстро адаптирующимися механорецепторами легких. Часть ирритантных рецепторов возбуждается при обычных вдохах и выдохах. Ирритантные рецепторы стимулируются также пылевыми частицами и накапливающейся в воздухоносных путях слизью.
Кроме того, раздражителями ирритантных рецепторов могут служить пары едких веществ (аммиак, эфир, двуокись серы, табачный дым), а также некоторые биологически активные вещества, образующиеся в стенках воздухоносных путей, в особенности гистамин.
Раздражению ирритантных рецепторов способствует снижение растяжимости легочной ткани. Сильное возбуждение ирритантных рецепторов происходит при ряде заболеваний (бронхиальная астма, отек легких, пневмоторакс, застой крови в малом круге кровообращения) и обусловливает .характерную одышку. Раздражение ирритантных рецепторов вызывает у человека,. ;неприятньге ощущения типа першения и жжения.
При раздражении ирритантных рецепторов трахеи возникает кашель, а если раздражаются такие же рецепторы бронхов, усиливается инспираторная активность и укорачиваются выдохи за счет более раннего наступления следующего вдоха. В результате возрастает частота дыхания. Ирритантные рецепторы участвуют также в формировании рефлекса на спадение легких, их импульсы вызывают рефлекторное сужение бронхов (бронхоконстрикция).
Раздражение ирритантных рецепторов обусловливает фазное инспираторное возбуждение дыхательного центра в ответ на раздувание легких. Значение этого рефлекса заключается в следующем. Спокойно дышащий человек периодически (в среднем 3 раза в час) глубоко вздыхает. Ко времени наступления такого «вздоха» нарушается равномерность вентиляции легких, снижается их растяжимость. Это способствует раздражению ирритантных рецепторов. На один из очередных вдохов наслаивается «вздох». Это ведет к расправлению легких и восстановлению равномерности их вентиляции.
J-рецепторы.Эти рецепторы находятся вблизи от капилляров малого круга кровообращения в ингерсгициальной ткани альвеол. Они стимулируются введением в малый круг кровообращения биологически активных веществ, особенно фенилдигуанида, а также химическими веществами, добавляемыми в виде паров ко. вдыхаемому воздуху. Сигналы отJ-рецепгоров проводятся в мозг тонкими афферентными волокнами, примущесгвенно группы С.
У здоровых животных J-рецепгоры находятся в состоянии слабого тоническою возбуждения, но значение их в регуляции дыхания у здоровых животных и людей неизвестно. Полагают, что основной их раздражитель — увеличение объема ингерсгициальной жидкости в легочной ткани Сильное и устойчивое во времени возбуждениеJ-рецепгоров наблюдается при пневмониях, отеке легких, эмболии мелких сосудов легких, застое крови в малом круге кровообращения, т. е. в основном при повреждении легочной ткани.
При раздражении этих рецепторов возникают характерное частое и поверхностное дыхание (одышка), а также рефлекторная бронхоконстрикция. При заболевании легких в возникновении одышки имеет значение сочеганное раздражение J-рецепторов и ирригантных рецепторов.
Рецепторы плевры.Значение рецепторов плевры в регуляции нормального дыхания невелико. В ней не обнаружены рецепторы растяжения и хеморецепторы, оказывающие значительное влияние на деятельность дыхательного центра.
При нарушениях гладкости листков плевры в результате ее воспаления (плевриты) у человека дыхательные движения сопровождаются сильными болевыми ощущениями. Боль возникает преимущественно вследствие раздражения рецепторов париетального листка плевры.
МЕХАНИЗМ ПЕРИОДИЧЕСКОЙ ДЕЯТЕЛЬНОСТИ
ДЫХАТЕЛЬНОГО ЦЕНТРА
Рецепторы легких, дыхательных мышц, верхних дыхательных путей раздражаются дыхательными движениями, однако дыхательный центр ствола мозга способен обеспечить смену дыхательных фаз за счет деятельности своих внутренних механизмов.
При введении животному миорелаксантов (вещества, превращающие передачу возбуэдения с двигательных нервных волокон на мышцы) наступал полный паралич скелетной мускулатуры, в том числе и дыхательной. Животных переводили на искусственную вентиляцию легких, которую через некоторое время прекращали. Смена фаз инспирации и экспирации продолжалась и в этих условиях, о чем свидетельствовало периодическое возбуждение диафрагмальных мотонейронов и других дыхательных нейронов.
Таким образом, дыхательный центр содержит механизмы,, необходимые для формирования спонтанного периодического возбу эдения своих нейронов, и в этом смысле обладает автоматизмом.
Автоматизм дыхательного центра отличается рядом признаков от автоматизма водителя сердечного ритма. 1. Периодическое возбуждение дыхательного центра обусловлено взаимодействием многих нервных клеток,среди которых особо важную роль играют тормозные нейроны. 2. Для автоматической деятельности дыхательного центра необходимо постоянное (тоническое) поступление к нему сигналов,повышающих возбудимость дыхательных нейронов, от хеморецепторов, а также от ретикулярной формации ствола мозга. 3. Автоматическая деятельность дыхательного центра человека находится под сильно выраженным произвольным контролем.Человек может в широких пределах изменять частоту и глубину своего дыхания.
Теории возникновения периодической деятельности дыхательного центра. Механизмы периодической деятельности дыхательного центра полностью еще не выяснены. В частности, несмотря на продолжающиеся исследования, нет достаточных сведений о связях между группами (популяциями) дыхательных нейронов. Неизвестна природа торможения инспираторных нейронов при смене вдоха на выдох.
Рассмотрим модель механизма периодической деятельности дыхательного центра. В этой модели обобщены многие экспериментальные данные, и она является предметом современных исследований.
Основа модели—два нейронных механизма: 1)генератор центрального инспира- торного возбуждения (ЦИВ) и 2)механизм выключения инспирации.
Генератор ЦИВ обеспечивает возникновение и постепенное усиление возбуждения инспираторных мышц по ходу вдоха. Он представляет собой совокупность инспираторных нейронов 1а, тормозящихся при раздражении рецепторов растяжения легких. Условием возникновения ЦИВ является достаточно интенсивный поток возбуждающих сигналов от центральных и периферических хеморецепторов (рис. 161). От стимуляции хеморецепторов и, следовательно, от газового состава крови зависит скорость нарастания инспира- торной активности по ходу вдоха: чем больше активируются хеморецепторы, тем больше скорость нарастания ЦИВ.
i
200
Рис.
161. Модель механизма смены дыхательных
фаз.
400
100
I 2
Длительность
вдоха с
300
3
о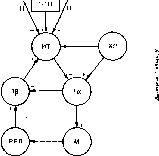

ХР - хеморецепторы; 1о — генератор центрального инспнраторного возбуждения; 1р — инсгжраторные нейроны, на которых конвергируют импульсы нейронов 1а и рецепторов растяжения легких (РРЛ); ИТ — инспнраторно-тормозящие нейроны: М — мотонейроны дыхательных мыши и сами мышцы; ПТЦ — пневмо- таксическнй центр; Н — нисходящие^«Ййия на бульбарнын дыхательный центр; н водоуждающне
связи; — — тормозные связи.
<WW
Рис. 162. Зависимость длительности вдохов от их глубины.
За 100 % принят дыхательный объем при эйпноэ. Прямые, начинающиеся от нуля,— скорость развития вдохов до их перерыва (точки пересечения с кривыми), а — до перерезки блуждающих нервов, б — после перерезки блуждающих нервов.
У животного при помощи гипервентиляции вызывали гипокапническое апноэ. Затем гипервентиляцию прекращали. Появлялось редкое поверхностное дыхание. По мере накопления двуокиси углерода в крови глубина дыхания увеличивалась. Добавляя во вдыхаемый воздух двуокись углерода, наблюдали увеличение глубины дыхания до максимальных величин. Это можно представить графически (рис. 162). Величины дыхательного объема, пропорциональные ЦИВ, отложены на оси ординат, а на абсциссе — длительность вдохов (Ti). Прямые от начала координат отражают развитие во времени ЦИВ.
Основой механизма торможения инспирации считают инспираторные нейроны 1(3, возбуждаемые афферентными сигналами от рецепторов растяжения легких. Когда возбуждение нейронов 1(3 достигает определенного порогового уровня, возбуждение инспи- раторных нейронов резко ослабевает или прекращается, т. е. вдох сменяется выдохом. Одновременно экспираторные нейроны вентрального дыхательного ядра освобождаются от тормозящего влияния нейронов 1а (см. рис. 161). Возбуждение экспираторных нейронов, обусловленное сигналами от хеморецепторов, усиливается по ходу выдоха.
На рис. 162 моменты выключения инспираций соединены кривой (так называемая кривая порогов выключения инспираций). Кривая близка к гиперболе. Чем сильнее раздражение хеморецепторов, тем больше скорость развития ЦИВ, меньше длительность инспираций и больше дыхательный объем.
Примечательно, что влияние сигналов от рецепторов растяжения легких до достижения порога возбуждения нейронов 1(3 не сказывается на скорости развития ЦИВ. После перерезки блуждающих нервов, выключающей влияния рецепторов растяжения легких, скорость увеличения ЦИВ по ходу вдоха при данном газовом составе крови не изменяется. Значит, инспираторная активность тормозится скачком (по принципу «все или ничего»).
Установлено, что нейроны 1(3 не оказывают непосредственного тормозящего влияния на нейроны 1а. Поэтому предполагают существование инспираторно-тормозящих нейронов. Какие нейроны выполняют эту функцию, точно неизвестно. Предполагается, что ими могут быть инспираторно-экспираторные или «ранние» экспираторные нейроны. Чтобы объяснить увеличение дыхательного объема при усилении раздражения хеморецепторов, сделано предположение, что сигналы от хеморецепторов не только повышают возбуждение нейронов 1а, но и снижают возбудимость инспираторно-тормозящих нейронов,
Во многих условиях период выдоха определяется длительностью предшествующего вдоха, причем эта зависимость носит линейный характер. При данном газовом составе крови преждевременное выключение инспирации (например, коротким раздражением рецепторов растяжения легких) приводит к пропорциональному укорочению экспирации. Предполагают, что возбуждение инспираторно-тормозящих нейронов после выключения инспирации прекращается не сразу, а затухает постепенно. Генератор ЦИВ постепенно освобождается от торможения. Когда возбуждение инспираторно-тормозящих нейронов снижается до определенного уровня, возникает очередная инспирация.
При развитии гиперпноэ длительность выдохов уменьшается за счет двух факторов: редкой импульсации рецепторов растяжения легких и усиления раздражения ирритант- ных рецепторов. Оба фактора способствуют более раннему наступлению следующей инспирации.
Рассмотренные нейронные механизмы (генератор ЦИВ, механизм выключения вдоха, экспираторные нейроны) находятся в продолговатом мозге, они входят в состав дорсальных и вентральных дыхательных ядер. Эти механизмы испытывают постоянные нисходящие влияния, в частности от пневмотаксического центра моста.
Пневмотаксический центр.Поперечная перерезка моста ниже четверохолмия сопровождается изменениями дыхания, сходными с теми, которые наступают после перерезки блуждающих нервов. Частота дыхания снижается вследствие увеличения продолжительности как вдохов, так и выдохов. Если дополнительно произвести перерезку блуждающих нервов, вдохи становятся необычайно длительными, они продолжаются десятки секунд или минуты. Долго непрерывающиеся вдохи называются апнейзисами(рис. 163). Структуры передней части моста, разрушение которых после перерезки блуждающих нервов ведет к возникновению апнейзисов, получили название пневмотаксического центра.
Установлены двусторонние -связи бульварного дыхательного и пневмотаксического центров. При раздражении отдельных зон пневмотаксического центра может быть преждевременно вызван вдох или выдох.
■ 1111
Рис.
1вЗ. Изменения дыхания после перерезки
блуждающих нервов и разрушения
пневмотаксического центра.
а
— нормальное дыхание -- эйпноэ; б —
после перерезки блуждающих нервов
и разрушения пнев- мотаксического
центра вдохи стали необычно
продолжительными (апнейэисы); в —
отметка времени 10 с.
скорость развития инспираторной активности и повышает возбудимость механизма вык лючения вдоха. Помимо этого, пневмотаксический центр ускоряет наступление следую щей инспирации.
Пневмотаксический центр не является генератором дыхательной периодики, но он постоянно участвует в регуляции частоты дыхания.
На периодической деятельности дыхательного центра сказывается активность ретикулярной формации средних и нижних областей моста. После разрушения этих областей остановки дыхания не возникают. У бульварных животных (после перерезки мозга между мостом и продолговатым мозгом) обычно наблюдается судорожное дыхание, или гаспинг.Для него характерны короткие быстрые вдохи и длительные (10—20 с) экспираторные паузы. Реже отмечается дыхание, напоминающее эйпноэ, однако ритм такого дыхания неравномерен, а вентиляция легких недостаточна для поддержания газового состава крови на нормальном уровне.
Влияние на дыхательный центр раздражения
различных рецепторов и отделов ЦНС;
условнорефлекторная регуляция дыхания
Влияние гипоталамуса на деятельность дыхательного центра.Центры гипоталамуса играют большую роль в регуляции дыхания во время поведенческих актов. Вследствие влияния центров гипоталамуса на дыхательный центр происходит усиление дыхания при общей защитной реакции организма, в частности при болевых раздражениях, во время физической работы, при эмоциональном возбуждении.
Центры терморегуляции, находящиеся в гипоталамусе, обеспечивают увеличение частоты дыхания при повышении температуры тела (тепловая одышка). Нейроны гипоталамуса при этом специфически влияют на генератор ЦИВ, повышая скорость нарастания инспираторной активности увеличения дыхательного объема, т. е. изменяя частоту дыхания. При частом дыхании возрастает вентиляция мертвого пространства, что способствует теплоотдаче.
Значение рецепторов верхних дыхательных путей.На деятельность дыхательного центра оказывают влияние сигналы, идущие от верхних дыхательных путей. При дыхании инспираторным потоком воздуха раздражаются рецепторы слизистой оболочки носа, преимущественно холодовые рецепторы. При этом имеют значение температура вдыхаемого воздуха и испарение воды с поверхности слизистой оболочки, сопровождающееся ее охлаждением. В меньшей степени раздражаются механорецепторьг. Импульсы от рецепторов слизистой оболочки полости носа, раздражаемых потоками воздуха, поступают в мозг по волокнам тройничного нерва и оказывают на дыхательный центр слабое тормозящее влияние.
Примесь к вдыхаемому воздуху паров пахучих веществ раздражает обонятельные рецепторы, расположенные в верхних носовых ходах. Сначала возникают короткие быстрые вдохи («принюхивание»), способствующие поступлению пахучих веществ к обонятельным рецепторам.
Раздражением рецепторов верхних дыхательных путей вызывается ряд защитных рефлексов. В результате действия воды на область нижних носовых ходов возникает рефлекторное апноэ, предупреждающее попадение воды в дыхательные пути («рефлекс ныряльщиков»).Дыхание тормозится также во время глотания, при попадании в полость носа едких веществ, например паров аммиака. Если в гортань попадают инородные частицы, происходят рефлекторное смыкание голосовых связок и сужение бронхов, препятствующие попаданию инородных частиц в нижние дыхательные пути.
Раздражение слизистой оболочки воздухоносных путей накапливающейся слизью, пылью, инородными телами вызывает чиханье или кашель. Чиханье обусловлено раздражением чувствительных окончаний тройничного нерва в слизистой оболочке полости носа, кашель — раздражением рецепторов гортани и трахеи.
Кашель и чиханье начинаются с глубокого вдоха, за которым следует смыкание голосовых связок. Затем происходит сокращение экспираторных мышц, а голосовые связки расходятся.
Влияние артериальных прессорецепторов на дыхание.Повышение артериального давления усиливает раздражение прессорецепторов каротидного синуса и дуги аорты. Одновременно с депрессорным рефлексом наблюдаются незначительные торможение деятельности дыхательного центра и уменьшение вентиляции легких. При снижении артериального давления вследствие ослабления раздражения прессорецепторов вентиляция легких, наоборот, несколько увеличивается.
Значение проприорецепторов дыхательных мышц.Дыхательные мышцы содержат разное количество рецепторов растяжения.
В диафрагме рецепторов растяжения (мышечные веретена и сухожильные рецепторы) удивительно мало (10—30). В соответствии с этим проприорецептивные рефлексы диафрагмы очень слабы и в регуляции дыхания существенного значения не имеют. Это не значит, что дыхательный центр не получает информации об эффективности сокращения диафрагмы, так как от сокращения диафрагмы в значительной степени зависит увеличение объема легких, происходит раздражение их рецепторов, что оказывает мощное влияние на деятельность дыхательного центра. Таким образом, обратная связь между дыхательным центром и диафрагмой осуществляется через рецепторы легких. Так, если перед вдохом частично перекрыть воздухоносные пути (увеличить их сопротивление току воздуха), возрастание объема легких будет меньше, ослабнет поток импульсов от рецепторов растяжения легких. Это увеличит длительность и силу сокращения диафрагмы и других инспираторных мышц.
Межреберные мышцы и мышцы стенок живота, напротив, снабжены большим количеством рецепторов растяжения. Среди них преобладают рецепторы мышечных веретен. Так, в каждом межреберном промежутке содержится около 100 мышечных веретен.
Частота сигналов от рецепторов мышечных веретен увеличивается при двух условиях: 1) растяжении мышцы и 2) сокращении внутриверетенных (интрафузальных) волокон, вызываемом импульсами у-эфферентных волокон. Афферентная импульсация от веретен испираторных межреберных мышц возрастает во время вдохов, а экспираторных мышц—во время выдохов.
Возбуждение рецепторов мышечных веретен усиливается при увеличении механического сопротивления сокращению мышцы, в которой находятся веретена. Длина мышцы оказывается большей, чем при сокращении, преодолевающем меньшее сопротивление. Поэтому частота афферентных сигналов возрастает. Возбуждение рецепторов мышечных веретен вызывает рефлекс на растяжение — возрастает сила сокращений мышц, в которых находятся веретена. Сигналы от рецепторов веретен направляются в спинной мозг и усиливают возбуждение соответствующих а-мотонейронов.
Значение рефлексов на растяжение дыхательных мышц заключается в автоматической регуляции силы их сокращений в зависимости от величины сопротивления дыханию. Сопротивление дыханию возрастает, например, при уменьшении растяжимости легких, сужении бронхов и голосовой щели, набухании слизистой оболочки носа. Наиболее резкое увеличение сопротивления дыханию — перекрытие воздухоносных путей. Во всех случаях сегментарные рефлексы на растяжение усиливают сокращение межреберных мышц и мышц передней брюшной стенки.
В условиях обычного дыхания проприорецепторы дыхательных мышц существенного значения в регуляции деятельности дыхательного центра не имеют. Отчетливые изменения активности дыхательного центра наблюдаются лишь при необычных сильных и резких раздражениях проприорецепторов межреберных мышц. Например, интенсивное сдавление грудной клетки может преждевременно выключить вдох.
Регуляция дыхания полушариями большого мозга.Регуляция дыхания обеспечивает две группы процессов. Прежде всего поддержание постоянного газового состава артериальной крови. Эту функцию выполняет в основном дыхательный центр (гомеопатическая регуляция).Вторая группа — процессы, приспосабливающие дыхание к изменяющимся условиям окружающей среды и жизнедеятельности организма. При любом изменении дыхательный центр испытывает возмущающие влияния, идущие из многих других функциональных структур ЦНС {поведенческая регуляция).Практически каждый поведенческий акт у человека сопровождается изменением частоты и глубины дыхания. Изменения дыхания могут быть вызваны разнообразными внешними воздействиями, в том числе световыми и звуковыми. Изменения дыхания сопровождают психические процессы (мышление, внимание, эмоции). Сложные изменения дыхания происходят при речи: и пении, во время которых экспираторное движение воздуха через верхние дыхательные пути обеспечивает возникновение звуков. Характерным образом дыхание изменяется во время сна.
Таким образом, дыханию человека свойственно, с одной стороны, постоянство, а с другой — чрезвычайная изменчивость частоты и глубины.
Особенно большое значение в тонком приспособлении дыхания к изменяющимся условиям существования организма имеют полушария большого мозга, оказывающие прямые влияния через кортико-бульбарные путии при посредстве подкорковых структур — стриопаллидарнойи лимбической систем, гипоталамуса, ретикулярной формации ствола мозга.
В коре большого мозга нет участков, специально изменяющих деятельность дыхательного центра. Разнообразные изменения дыхания можно вызвать раздражением большинства областей коры. Вместе с тем наиболее существенные колебания дыхания наблюдались при раздражениях соматосенсорной и орбитальной зон. Удаление коры большого мозга у животных сопровождается увеличением частоты дыхания и показателей вентиляции легких. Отсюда следует, что преобладает тоническое тормозящее влияние коры мозга на деятельность дыхательного центра. В то же время изменения дыхания при движениях животного становились чрезмерно сильными. Это свидетельствует о регулирующем влиянии коры на подкорковые механизмы регуляции дыхания.
Важные приспособительные изменения дыхания осуществляются посредством ус ловных рефлексов.
Вдыханием воздуха с повышенной, концентрацией двуокиси углерода у испытуемых вызывали гиперпноэ. Перед этим воздействием включали индифферентный раздражитель — удары метронома. После нескольких повторений такого сочетания стук метронома становился условным раздражителем: он один вызывал у испытуемых увеличение вентиляции легких.
За счет условнорефлекторных изменений осуществляется опережающая регуляция дыхания. Особенно четко она выражена у спортсменов в предстартовом состоянии. Физическая работа еще не началась, но дыхательная и другие вегетативные системы уже подготовлены к ее выполнению, в частности к увеличению доставки в организм кислорода и выведения двуокиси углерода. Выработка подобных условных рефлексов возможна в процессе тренировки к любой мышечной работе.
Особенно отчетливо влияние полушарий большого мозга на дыхание проявляется при произвольных изменениях дыхания. Человек может задержать дыхание на 40—60 с. Наоборот, возможно произвольное увеличение вентиляции легких на короткое время — до 170 л в 1 мин (максимальная вентиляция легких). Человек может длительное время поддерживать заданный звуковыми сигналами искусственный ритм дыхания. Произвольное управление дыханием широко используется во время речи, пения, игры на духовых музыкальных инструментах, занятий дыхательной гимнастикой. С влиянием полушарий большого мозга связана способность дыхательного центра функционировать относительно независимо от сигналов хеморецепторов сосудов и механорецепторов легких. Ранее отмечалось, что у человека после гипервентиляции обычно не наступает апноэ, а блокада блуждающих нервов не вызывает уменьшения частоты дыхания.
Деятельность коры большого мозга позволяет субъективно оценивать изменения в дыхательном аппарате. Обычно здоровые люди не ощущают своего дыхания. Вместе с тем человек способен достаточно точно почувствовать увеличение сопротивления дыханию (например, при дыхании через трубки, клапаны и т. д.) и изменения глубины дыхания. Неприятные ощущения возникают при тяжелой одышке.
ОСОБЕННОСТИ ДЫХАНИЯ В РАЗНЫХ УСЛОВИЯХ
Дыхание при мышечной работе
Во время физической нагрузки мышцам необходимо очень большое количество кислорода. У человека в покое потребление кислорода составляет 250—350 мл в 1 мин, при быстрой ходьбе до 2,5 л, а при чрезмерно тяжелой работе — до 4 л в 1 мин. Одновременно увеличивается образование в мышцах двуокиси углерода и кислых продуктов обмена веществ, подлежащих удалению из организма. Обеспечение организма кислородом достигается сочетанным усилением дыхания и кровообращения.
Вентиляция легких при мышечной работе.Вентиляция легких возрастает пропорционально затратам энергии организма. Она может увеличиваться в 10—20 раз и достигать 120—150 л в 1 мин.
Механизмы регуляции вентиляции легких при физической работе сложны. Вентиляция легких увеличивается в начале работы, когда газовый состав крови еще не успел измениться. Значит, гиперпноэ возникает под влиянием нервных факторов. Кора большого мозга, вызывая произвольные движения, активирует и деятельность дыхательного центра (как прямыми влияниями, так и через гипоталамус). Помимо этого, вентиляция легких увеличивается под влиянием сигналов от проприорецепторов (механорецепторов) сокращающихся мышц. Усиление вентиляции легких наблюдается, например, при сокращении мышц, вызванном раздражением передних корешков спинного мозга, пассивными движениями конечностей. Это увеличение сохраняется и в условиях, при которых исключено поступление венозной крови от работающих мышц в общий кровоток (например, при наложении жгута).
Позднее во время продолжающейся физической работы происходит более медленное возрастание вентиляции легких до устойчивых величин. В развитии этой фазы гиперпноэ имеет значение раздражение артериальных и центральных хеморецепторов. Однако способ, которым достигается увеличение вентиляции легких под влиянием сигналов от хеморецепторов, далеко не прост. Дело в том, что во время физической работы, даже достаточно напряженной, вследствие возросшей вентиляции легких напряжение двуокиси углерода в артериальной крови может не изменяться (или даже снижаться), а напряжение кислорода оставаться без изменений. Даже удаление каротидных телец не исключает увеличения вентиляции легких при мышечной работе и тем не менее сигналы от хеморецепторов имеют существенное значение в увеличении вентиляции легких. Объясняется это тем, что при физической работе повышается чувствительность дыхательного центра к гиперкапнии и гипоксии, возрастает и возбудимость хеморецепторов. Дыхание чистым кислородом во время физической работы значительно снижает вентиляцию легких, уменьшая возбудимость артериальных хеморецепторов. Раздражение хеморецепторов усиливается при воздействии молочной кислоты, образующейся в работающих мышцах и снижающей рН артериальной крови. Имеет значение также повышение температуры тела: этот фактор через центры гипоталамуса увеличивает частоту дыхания.
При физической нагрузке, имеющей периодический характер, частота дыхания приспосабливается к ритму работы, соответствуя ритму движений или становясь кратной ей.
После окончания физической работы вентиляция легких сразу снижается в результате прекращения действия нервных факторов, усиливавших возбуждение дыхательного центра, но не до исходного уровня. Вентиляция легких продолжает оставаться высокой в течение нескольких минут под влиянием накопившейся в работавших мышцах молочной кислоты.
Таким образом, гиперпноэ при физической работе обеспечивается сложным комплексом нервных и гуморальных механизмов.
Рассмотренные механизмы не полностью объясняют точное соответствие вентиляции легких уровню метаболизма в мышцах. Предполагают, что существуют хеморецепторы в самих мышцах («метаборецепторы») и венозной части малого круга кровообращения. Однако, несмотря на усилия исследователей, такие рецепторы обнаружить не удалось.
Транспорт газов крови при мышечной работе. В состоянии покоя кровь насыщается кислородом почти полностью (на 96%). Транспорт кислорода может быть увеличен либо путем ускорения кровотока, либо повышением кислородной емкости крови.
Действительно, интенсивность кровообращения при мышечной деятельности значительно возрастает. Частота сердечных сокращений может увеличиваться с 70 до 150—200 в 1 мин, систолический объем — с 70 до 200 мл, минутный объем крови — с 4—5 л до 25—30 л в 1 мин. Резко возрастает кровоток через работающие мышцы вследствие расширения в них сосудов (рабочая гиперемия).
Кислородная емкость крови повышается вследствие поступления из кровяных депо крови, богатой эритроцитами. Кроме того, при длительной физической работе организм теряет часть воды за счет потения, что ведет к сгущению крови и увеличению в ней концентрации эритроцитов и гемоглобина.
Усиление снабжения работающих мышц кислородом в значительной степени обеспечивается возрастанием диссоциации оксигемоглобина вследствие очень низкого напряжения кислорода в них. Диссоциация оксигемоглобина возрастает также в результате увеличения напряжения двуокиси углерода, снижения рН и повышения температуры в работающих мышцах. В результате при физической работе коэффициент утилизации кислорода повышается с 30—40 до 50—60%.
Во время физической работы увеличивается напряжение двуокиси углерода в венозной крови, так как в больших количествах этот газ диффундирует из мышц в кровь. Кроме того, кислые продукты обмена веществ (в частности, молочная кислота) вытесняют угольную кислоту из бикарбонатов. Повышенное количество двуокиси углерода из венозной крови выводится из организма за счет увеличения минутного объема крови и вентиляции легких.
Дыхание при пониженном атмосферном давлении
Человек оказывается в условиях сниженного атмосферного давления при подъеме на высоту (альпинисты, пилоты при разгерметизации кабины, парашютисты).
Условия пониженного давления на высоте воспроизводятся в барокамерах, из которых откачивают необходимое количество воздуха. Близкие изменения создаются также при дыхании газовыми смесями с пониженным содержанием кислорода.
Основным следствием понижения атмосферного давления является гипоксия, развивающаяся вследствие низкого парциального давления кислорода во вдыхаемом воздухе.
Подъем на высоту до 1,5—2 км над уровнем моря не сопровождается значительным снижением снабжения организма кислородом и изменениями дыхания. На высоте 2,5—5 км наступает увеличение вентиляции легких, обусловливаемое стимуляцией каротидных хеморецепторов. Одновременно повышается артериальное давление и увеличивается частота сердечных сокращений. Эти реакции направлены на усиление снабжения тканей кислородом, они частично компенсируют сниженное парциальное давление кислорода.
Увеличение вентиляции легких на высоте может оказывать и отрицательное действие на дыхание, так как оно ведет к снижению парциального давления двуокиси углерода в альвеолярном воздухе и удалении ее из крови. В результате при пониженном атмосферном давлении гипоксия сочетается с гипокапнией. При гипокапнии ослабевает стимуляция хеморецепторов, особенно центральных, что ограничивает увеличение вентиляции легких.
При дальнейшем снижении атмосферного давления, на высоте 4—5 км, развивается высотная(горная) болезнь:слабость, цианоз, снижение частоты сердечных сокращений, артериального давления, головные боли, глубина дыхания уменьшается. На высоте свыше 7 км могут наступить потеря сознания и опасные для жизни нарушения дыхания и кровообращения.
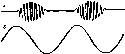
Рис, 164. Периодическое дыхание Чейна Стокса. а — запись дыхательных движений грудной клетки; б — напряжение двуокиси углерода в крови.
Особенно высокую опасность представляет собой быстрое развитие гипоксии. При этом у человека отсутствуют неприятные ощущения, связанные с гипоксией, нет чувства тревоги и опасности. Потеря сознания может наступить внезапно.
Дыхание чистым кислородом через загубник или маску позволяет человеку сохранить нормальную работоспособность на высоте даже 11 —12 км. При подъемах на большие высоты даже при дыхании чистым кислородом его парциальное давление в альвеолярном воздухе оказывается значительно ниже, чем в норме. Поэтому полеты в стратосферу возможны только в герметизированных кабинах или скафандрах, в которых поддерживается достаточно высокое атмосферное давление.
Устойчивость к гипоксии имеет большие индивидуальные различия. Так, у некоторых людей высотная болезнь развивается уже на высоте 2,5 км. Устойчивость к гипоксии может быть значительно повышена путем тренировки в барокамере, что позволяет сохранять работоспособность на высоте 7000 м.
Длительное пребывание в условиях низкого атмосферного давления, жизнь в горных местностях сопровождаются акклиматизацией к кислородному голоданию. Последняя обусловлена рядом факторов: 1) увеличением количества эритроцитов в крови вследствие усиления эритропоэза; 2) увеличением содержания гемоглобина в крови и, следовательно, повышением кислородной емкости крови; 3) увеличением вентиляции легких; 4) ускорением диссоциации оксигемоглобина в тканевых капиллярах вследствие сдвига кривой диссоциации оксигемоглобина вправо, вызванного увеличением содержания в эритроцитах 2,3-глицерофосфата; 5) повышением плотности кровеносных капилляров в тканях, увеличением их длины и извилистости; 6) повышением устойчивости клеток, особенно нервных, к гипоксии и др.
Периодическое дыхание.Для такого дыхания характерны периодические изменения частоты дыхания. Так может наблюдаться дыхание с периодическими увеличениями и уменьшениями глубины (волнообразное дыхание). При большей выраженности такого периодического дыхания группы дыхательных движений отделяются друг от друга паузами — периодами апноэ продолжительностью 5—20 с. После паузы возникают слабые дыхательные движения, они постепенно усиливаются до максимума, а затем ослабевают. Наступает новая пауза (рис. 164). Это дыхание называется дыханием Чейна — Стокса. Продолжительность цикла такого дыхания может составлять 20—60 с.
321
11 Физиология человека
Дыхание при повышенном атмосферном давлении
Под повышенным давлением воздуха человеку приходится находиться во время водолазных и кессонных работ. При погружении под воду через каждые 10 м давление воды на поверхность тела увеличивается на 1 атм. Это значит, что на глубине 90 м на человека действует давление около 10 атм.
При погружении под воду в водолазных костюмах без изоляции от действия гидростатического давления человек может дышать только воздухом под соответствующим погружению повышенным давлением. В этих условиях увеличивается количество газов, растворенных в крови, в том числе кислорода и азота. При высоких давлениях заметно возрастает плотность вдыхаемого воздуха, что увеличивает сопротивление воздухоносных путей. Возрастание парциального давления кислорода может привести к «кислородному отравлению», сопровождающемуся судорогами. Поэтому пребывание человека на глубинах может продолжаться лишь ограниченное время.
При погружении на большие глубины для дыхания применяются гелиево-кислородные смеси. Гелий почти нерастворим в крови, обладает меньшей плотностью, чем азот, при дыхании им снижается сопротивление дыханию. Кислород добавляют к гелию в такой концентрации, чтобы его парциальное давление на глубине, т. е. при повышенном давлении, было близким к тому, которое имеется в обычных условиях.
После подобных работ специального внимания требует переход человека от высокого давления к нормальному. При быстрой декомпрессии, например при быстром подъеме водолаза, физически растворенные в крови и тканях газы в большом объеме, чем обычно, не успевают выделиться из организма и образуют пузырьки. Кислород и двуокись углерода представляют меньшую опасность, так как быстро связываются кровью и тканями. Особенно опасно образование пузырьков азота, которые разносятся кровью и закупоривают мелкие сосуды (газовая эмболия). Состояние, возникающее при быстрой декомпрессии, называют кессонной болезнью.Это заболевание проявляется болями в мышцах, головокружением, рвотой, одышкой, потерей сознания, в тяжелых случаях возникают параличи. Для лечения кессонной болезни необходимо немедленно вновь подвергнуть пострадавшего действию высокого давления, чтобы вызвать растворение пузырьков азота, а затем снижать давление постепенно.
С целью повышения доставки кислорода к тканям при ряде заболеваний применяется метод лечения кислородом при повышенном давлении — гипербарическая оксиге- нация. Человека помещают на определенное время в специальную барокамеру, в которой давление кислорода повышают до 3—4 атм. При этом резко увеличивается количество кислорода, физически растворяющегося в крови и тканях. Так, при давлении кислорода 3 атм 100 мл крови содержит около 7 мл растворенного кислорода. В таких условиях кислород в достаточных количествах переносится кровью и без участия гемоглобина. Высокое напряжение кислорода в крови создает условия для быстрой диффузии его в клетки.
Искусственное дыхание
При отсутствии самостоятельного дыхания, обусловленном прекращением деятельности дыхательного центра, необходимо применять искусственное дыхание, обеспечивающее известную степень вентиляции легких. На искусственное дыхание обязательно переводят больного при операциях на органах грудной полости, а также при введении миоре- лаксантов (вещества, вызывающие паралич мускулатуры).
Существует три способа искусственного дыхания: 1) периодическое нагнетание воздуха в легкие через воздухоносные пути, 2) ритмическое расширение и сжатие грудной клетки, 3) периодическое раздражение диафрагмальных нервов.
Для осуществления первого способа обычно производят интубацию — вводят трубку через рот в трахею. Воздух поступает в легкие под нужным давлением из баллона. Специальное устройство регулирует поступление воздуха в легкие. Когда воздух в легкие
не подается, они пассивно спадаются — происходит выдох. В других случаях используются насосы, приводимые в действие электромотором или вручную. Имеются аппараты, производящие активно не только вдох, но и выдох. Эффективным способом искусственного дыхания, которое применяется в экстренных случаях, является дыхание методом рот в рот. При этом оказывающий первую помощь периодически вдувает свой выдыхаемый воздух в рот пострадавшего.
Второй способ искусственного дыхания применяется в форме периодического сжатия руками грудной клетки. При прекращении сдавления грудная клетка расширяется ив легкие поступает воздух. Для длительного искусственного дыхания применяют аппарат, который называют «железными легкими». Это камера (плетизмограф тела), в которой человек располагается лежа. В передней стенке камеры имеется отверстие для головы и шеи, а также специальный воротник, герметизирующий камеру. Голова человека находится вне камеры. Компрессором в камере создают чередующееся положительное и отрицательное давление. При снижении давления в камере происходит пассивный вдох, при повышении — выдох. С помощью такого метода удавалось осуществлять искусственную вентиляцию легких в течение многих месяцев и даже лет.
Третий способ искусственного дыхания — сокращение диафрагмы путем раздражения диафрагмальных нервов — пока используется относительно редко.
По существу искусственное дыхание проводится также при использовании аппаратов искусственного кровообращения (АИК). Так называются сложные устройства, включающие насос, нагнетающий кровь в одну из крупных артерий. Поступающая из вен пациента кровь направляется в оксигенатор, в котором она становится артериальной и после этого вновь поступает в систему кровообращения. АИК применяют во время операций, требующих временного выключения деятельности сердца оперируемого.
