
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.1 , 2003
.pdf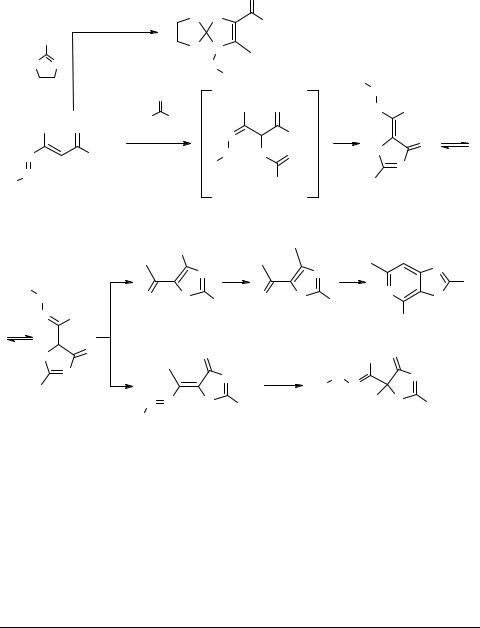
have been obtained by reaction of 1,2-diaza-1,3-butadienes 1a with 2-mercapto-2-thiazo- line or oxazolidine-2-thione 10, respectively [9] (see Scheme 2).
Scheme 2
|
|
|
|
|
|
|
H |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
OR |
2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
SH |
|
|
|
X |
N |
|
|
11 |
|
|
|
|
|
|
|
|
|
X N |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
X = O, S |
|
HN |
R |
|
|
|
|
R NH |
|
||||||||
|
|
10 |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
S |
|
|
|
R1 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
O |
|
HN R1 |
|
||||||
|
|
R |
1 |
O |
|
H N R3 |
|
|
|
|
|
|||||||
|
|
|
|
2 |
|
|
N |
|
|
OR2 |
|
|
|
|
|
|
||
|
|
|
2 |
2 |
|
|
|
|
|
|
|
S |
|
O |
||||
|
N |
|
|
OR |
|
|
|
NH S |
|
NH |
|
|
|
|
||||
|
|
|
|
|
R |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
N |
|
||||||
R |
N |
|
|
|
|
|
|
|
|
R3 |
|
R3 |
|
|||||
|
1a |
|
|
|
|
|
3 |
|
4a |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
HO |
|
|
R1 |
|
R4 |
|
R4 |
|
|
|||
|
|
|
|
|
|
R1 |
N |
|
|
N |
|
|
N |
|||||
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
N |
R3 |
|||
|
NH |
|
|
O |
S |
R |
3 |
O |
|
S |
R |
3 |
|
|
S |
|||
|
|
R1 |
|
|
|
|
|
|||||||||||
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
R1 |
|
|||
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
7 |
|||
|
|
S |
|
O |
|
R1 |
O |
|
|
|
|
H |
R1 |
O |
|
|||
|
|
|
|
N |
|
|
|
|
|
R4H |
|
|
N |
|||||
|
R3 |
|
|
|
|
|
|
N |
R3 |
|
R |
N N |
|
4 |
||||
|
|
|
4b |
|
|
N N |
|
S |
|
|
|
|
R |
|
S |
R3 |
||
|
|
|
|
|
|
R |
8 |
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
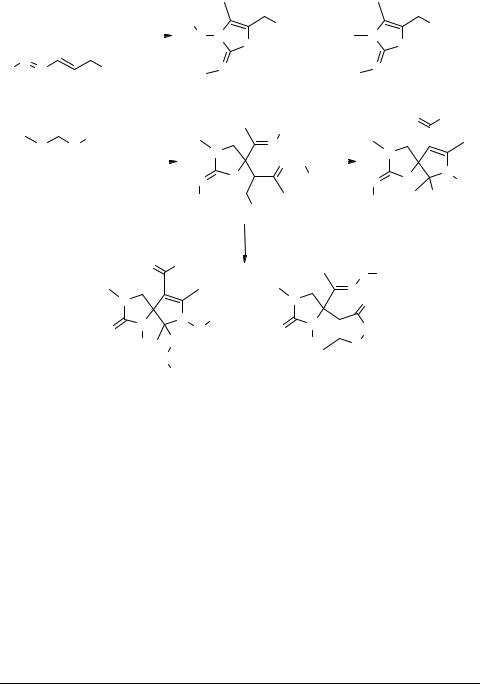
1,2-Diaza-1,3-butadienes 1b were found to react with diaryl- (12) or dialkylthioureas (13) [10]. Treatment of some 1,2-diaza-1,3-butadienes 1b with diarylthioureas 12 (taken in equimolar amounts) results in formation of two different iminothiazolines (14, 15). Reaction of two equivalents of 1,2-diaza-1,3-butadienes 1b with dialkylthioureas 13 yields complex iminothiazolidinones 16 that contain two different hydrazono side chains in position 5. Under basic conditions, these compounds give rise to spiroimidazolidine– pyrroline (17) and imidazolidine–pyrazoline (18) systems through complicated ring and side-chain rearrangments. Under acidic conditions, the same compounds lead to spiro- thiazolidine–pyrroline system 19 (see Scheme 3).
Генеральный спонсор и организатор – InterBioScreen Ltd. |
17 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 3 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
R2 = Ar |
R |
|
|
|
|
|
|
|
OR |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OR |
1 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
O |
|
12 |
|
|
N N |
|
|
|
|
|
|
+ |
|
|
R2 N |
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
S |
|
|
|
|
||||||||||||||||||||||||||
R N N |
|
|
OR1 |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 N |
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
1b |
|
|
|
|
|
R2 N |
14 |
|
|
|
|
|
|
|
|
|
|
|
|
|
15 |
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
OR1 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
S |
|
|
|
|
|
|
|
|
O |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
R |
2 |
|
|
N R |
2 |
|
R2 = Alk |
R2 |
|
|
|
N |
|
|
|
R |
|
|
|
|
|
|
|
|
R2 |
O |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
N |
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
H |
|
|
H |
|
|
13 |
|
|
N |
|
|
|
|
|
|
|
N N |
|
|
|
TFAA |
|
|
N |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
12, 13 |
|
|
|
|
|
|
|
|
|
N |
S |
|
|
|
|
|
|
|
R |
|
|
|
|
|
N S |
N NH |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
|
|
|
|
|
OH |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OR1 |
|
|
|
|
|
|
|
|
|
|
|
|
19 |
|
R |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NaH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
O |
OR1 |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
R2 |
|
O |
|
|
|
|
|
|
|
|
|
R2 |
|
|
|
|
|
|
|
|
N R |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
N |
|
|
|
N N R |
|
|
|
|
+ |
|
N |
|
|
|
|
|
|
|
N O |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
R |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
R2 |
NH H |
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
HN |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
17 |
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
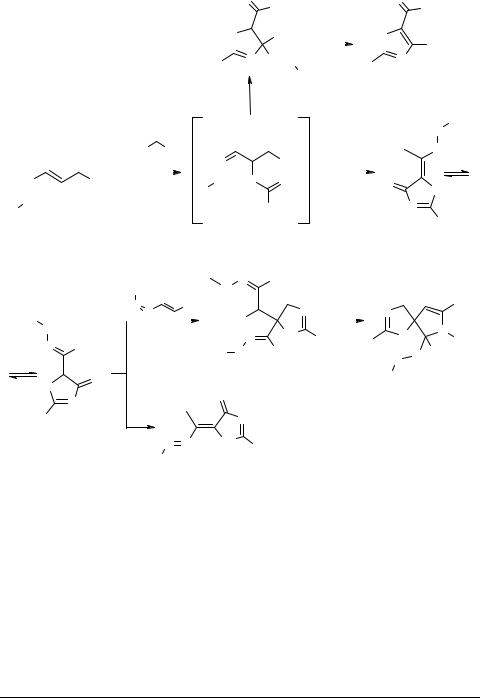
1,2-Diaza-1,3-butadienes 1a react with selenoureas 20 or selenoamides 21 in another way compared to their sulfur analogs [11, 12]. After formation of usual intermediate 1,4-adduct 22, selenoureas 20 tend to form hydrazino-hydrazono selenazolinones 23 upon intramolecular attack of the imino nitrogen at the ester group on the terminal carbon of the heterodiene system followed by the loss of an alcohol molecule and 3+2 cyclization similar to that of thioureas. In turn, hydrazino-hydrazono selenazolinones can be converted into selenazolinone azoalkenes by bromination and dehydrobromination of 24. Selenazolinones 23 can added to another molecule of 1,2-diaza-1,3-butadiene 1a, thus affording corresponding 1,4-adduct 25 and then spiro selenazoline–pyrroline systems 26 by cyclization under basic conditions. Selenoamides 21 tend to form hydrazinoselenazolines 27 upon intramolecular attack of the imino nitrogen at the hydrazone carbon and 3+2 cyclization different from that of selenazolinones and thiazolinones. Hydrazinoselenazolines 27 give rise to selenazoles 28 upon oxidative loss of a hydrazine residue (see Scheme 4).
18 |
Пленарные доклады |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 4 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
OR2 |
|
|
|
|
|
|
|
|
|
O |
OR2 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Se |
|
|
|
R H |
|
|
|
|
|
|
|
|
Se |
N |
|
R1 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ph |
|
N |
|
N |
|
|
|
|
|
|
Ph |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28 |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R3 = Ph |
27 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Se |
|
|
|
|
R1 |
O |
|
|
R3 = NH2, |
|
|
|
|
HN R |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
R3 |
|
|
|
|
R1 |
|
|||||||||||||||||||||||||
|
|
R |
1 |
O |
|
|
H2N |
|
|
|
|
N |
|
|
|
|
OR2 |
|
|
|
NMe2 |
|
|
|
NH |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
20, 21 |
|
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
OR2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
N |
|
|
|
|
|
|
|
|
|
|
R |
NH Se |
|
|
|
|
|
|
|
|
|
|
O |
|
|
Se |
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
R N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R3 |
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R3 |
|
|
|
|||||||||||||
|
|
|
|
|
1a |
|
|
|
|
|
|
|
|
|
|
|
|
22 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
23a |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
4 |
|
|
N |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
R4 |
|
R5 |
|
|
|
N |
|
|
R O |
|
|
|
|
|
|
|
|
|
O R6 |
5 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
N N |
|
|
|
R |
6 |
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
N |
|
|
|
|
|
R |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
NaH |
|
|
|
|
|
|
|
|
||||||||
|
R NH |
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
Se |
|
|
|
|
|
|
|
|
Se |
|
|
N |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
3 |
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
NH |
|||||||||||||||
|
|
N |
R1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
R |
|
|
R |
|
H |
|
|
1 |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R N |
|
|
R |
|
|
|
|
|
|
|
|
|
N R |
R |
4 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
H |
|
|
|||||
|
|
Se |
|
|
|
O |
|
|
|
|
|
|
O |
|
25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
26 |
|
|
|
|
|
|||||||||
|
|
|
|
|
N |
|
|
|
|
|
|
R1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
R |
|
23b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
N |
|
Se |
R3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
R24
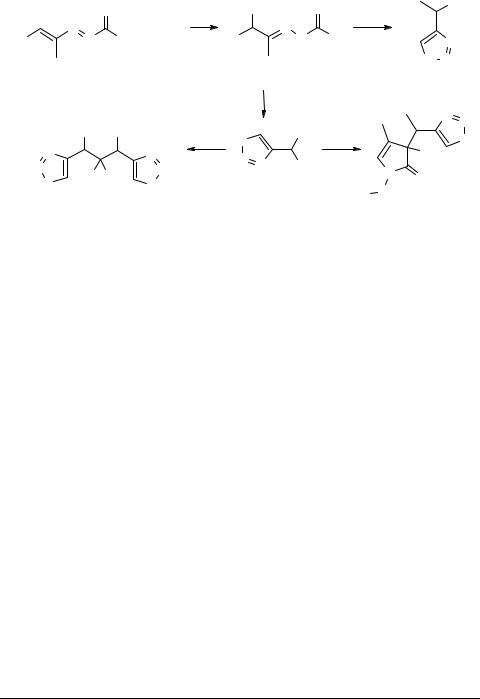
1.Synthesis of 1,2,3-thiazole and 1,2,3-selenadiazole derivatives
α-Substituted hydrazones 30 (easily obtainable by 1,4-addition of various nuocleophilic reagents 29 to the azo–ene system of 1,2-diaza-1,3-butadienes 1c) readily produce 4-substituted 1,2,3-thiadiazoles 31 via the Hurd–Mori reaction. Thiadiazole–thiadiazole systems 32 are obtained upon addition of another 1,2-diaza-1,3-butadiene molecule 1c followed by a new Hurd–Mori reaction. Thiadiazole–pyrrole systems 33 are prepared by addition of another 1,2-diaza-1,3-butadiene molecule 1c followed by basic treatment. α-Substituted hydrazones 30 lead to 1,2,3-selenadiazoles 34 through a modified Hurd– Mori reaction (see Scheme 5) [13, 14].
Генеральный спонсор и организатор – InterBioScreen Ltd. |
19 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 5 |
|
|
|
|
|
|
O |
|
|
|
R |
2 |
|
|
|
|
O |
SeOCl2 |
R2 R1 |
|||
|
|
|
|
|
+ R2H |
|
|
|
|
N |
|
|
or SeO2 |
|
|
|||||
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
R |
1 |
|
N |
OR |
|
R |
1 |
|
|
N |
|
OR AcOH |
|
N |
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
Se N |
||
|
|
|
|
|
|
|
|
|
|
|
|
30 |
|
|
|
|
|
|
||
|
|
|
1c |
|
|
29 |
|
|
|
|
|
|
|
|
|
|
|
34 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SOCl2 |
|
|
|
|
1 R1 |
|
N N |
|
|
|
|
|
R |
R |
|
|
|
|
|
|
|
R2 |
|
|
R |
|
|||
|
|
|
|
|
1c |
|
S |
|
|
|
|
1c |
|
R2 |
S |
|||||
|
|
N |
|
|
|
N |
|
|
|
|
|
|
|
|
|
|||||
|
N |
|
|
|
SOCl2 |
|
N |
N |
|
R |
1 |
|
NaH |
|
|
|
||||
|
|
|
R1 |
R1 |
N |
|
|
|
|
N |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
||||||||
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
R |
N |
|
|
||
|
|
|
|
32 |
|
|
|
|
|
31 |
|
|
|
33 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
||||||
References
1.Attanasi O.A., De Crescentini L., Foresti E., Galarini R., Santeusanio S., Serra-Zanetti F., Synthesis 1995 1397.
2.Attanasi O.A., De Crescentini L., Filippone P., Mantellini F., Tietze L.F., Tetrahedron 2001 57 5855.
3.Attanasi O.A., Filippone P., Giorgi G., Salvini L., Santeusanio S., J. Mass Spectrom.
2002 37 709.
4.Arcadi A., Attanasi O.A., De Crescentini L., Guidi B., Rossi E., Santeusanio S.,
Gazz. Chim. Ital. 1997 127 609.
5.Attanasi O.A., Giorgi G., Guidi B., Salvini L., Santeusanio S., J. Mass Spectrom.
2002 37 169.
6.Arcadi A., Attanasi O.A., Guidi B., Rossi E., Santeusanio S., Chem. Lett. 1999 59.
7.Arcadi A., Attanasi O.A., Guidi B., Rossi E., Santeusanio S., Eur. J. Org. Chem. 1999 3117.
8.Attanasi O.A., Filippone P., Guidi B., Perrulli F.R., Santeusanio S., Heterocycles 1999 51 2423.
9.Arcadi A., Attanasi O.A., Guidi B., Rossi E., Santeusanio S., Synlett 2000 1464.
10.Attanasi O.A., Filippone P., Foresti E., Guidi B., Santeusanio S., Tetrahedron 1999 55 13423.
11.Attanasi O.A., Filippone P., Guidi B., Perrulli F.R., Santeusanio S., Synlett 2001 144.
12.Attanasi O.A., Filippone P., Perrulli F.R., Santeusanio S., Eur. J. Org. Chem. 2002 2323.
13.Attanasi O.A., De Crescentini L., Filippone P., Mantellini F., Synlett 2001 557.
14.Attanasi O.A., De Crescentini L., Favi G., Filippone P., Giorgi G., Mantellini F., Santeusanio S., J. Org. Chem. 2002 67 0000.
20 |
Пленарные доклады |

Некоторые аспекты препаративной химии стабильных 2Н-тиофениевых ионов
Беленький Л.И.
Институт органической химии им. Н.Д. Зелинского РАН 119991, Москва, Ленинский пр., 47
Доклад обобщает результаты, полученные автором с сотрудниками, а также литературные данные по использованию стабильных 2Н-тиофениевых ионов (σ-комп- лексов) в препаративной практике. Некоторые типовые методики предполагается включить в выходящий одновременно сборник препаративных методов.
Разработаны оригинальные методы генерации 2Н-тиофениевых ионов:
1)действие HCl−AlCl3 на тиофеновые соединения в инертном растворителе и
2)алкилирование тиофена алкилгалогенидами в присутствии эквимолярного коли-
чества AlCl3. Последняя методика позволяет ограничить алкилирование монозамещением и получить после депротонирования с препаративными выходами смесь 2- и 3-алкилтиофенов без примеси продуктов дизамещения. Во многих случаях образовавшиеся 2Н-тиофениевые ионы стабильны в растворах при комнатной температуре в течение длительного времени (от нескольких часов до нескольких месяцев) и могут быть эффективно изучены с помощью спектроскопии ПМР.
Стабильность 2Н-тиофениевых ионов зависит от природы и положения заместителей. Наиболее устойчивы σ-комплексы, генерируемые при протонировании тиофенов с электронодонорными заместителями в положениях 2 и 4. Стабильность 2,5-дизамещенных 2Н-тиофениевых ионов существенно зависит от природы заместителя. Так, тиофен, 2-алкил-, 2,5-диалкил- и 2-алкил-5-(алкилтио)тиофены образуют стабильные катионы. Однако, 2Н-тиофениевые ионы, генерируемые из
2,5-ди(алкилтио)- и 2,5-дигалогентиофенов, при температурах выше −30 ÷ −40°С подвергаются диспропорционированию, которое было использовано для препаративного синтеза труднодоступных 2,4-ди(алкилтио)- и 2,4-дихлортиофенов. 2,5-Ди- алкил-2Н-тиофениевые ионы достаточно стабильны при комнатной температуре. Их диспропорционирование, требующее более жестких условий, позволило разработать препаративные синтезы 2-трет-бутилтиофена, 2,4-диэтил- и 2,4-ди-трет- бутилтиофена из доступных смесей изомерных алкилтиофенов.
Доклад сделан по материалам обзора, полный текст которого опубликован: в кн. "Избранные методы синтеза и модификации гетероциклов", под ред.
Карцева В.Г., М.: IBS PRESS, 2003, т. 2, с. 25.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
21 |

1-Галоген-2-органилэтан-2-тионы и 1-галоген- 2-органилэтан-2,2-дитиолы – прекурсоры гетероциклических систем
Воронков М.Г., Шагун Л.Г., Ермолюк Л.П.
Иркутский институт химии им. А.Е. Фаворского СО РАН 664033, Иркутск, ул. Фаворского, 1
Серусодержащие гетероциклы занимают видное место в органической химии. Эти соединения нашли широкое применение в органическом синтезе, различных областях промышленности, медицины, сельского хозяйства.
В течение последних лет мы проводим систематические исследования 1-гало- ген-2-органилэтан-2-тионов и 1-галоген-2-органилэтан-2,2-дитиолов, ранее практически неизвестных [1, 2].
1-Галоген-2-органилэтан-2-тионы 1 и 1-галоген-2-органилэтан-2,2-дитиолы 2 впервые синтезированы нами низкотемпературным катализируемым хлористым водородом тионированием и тиогидратацией соответствующих кетонов (схема 1).
Схема 1
|
|
|
|
|
|
HCl |
|
S |
||||
|
|
|
|
|
|
R |
|
|
|
X |
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
1a−d |
||||
|
O |
|
|
|
|
|||||||
|
|
|
|
|
|
|
H2S |
|||||
|
|
|
+ |
H2S |
|
|
|
|
|
|||
R |
|
|
|
|
|
|
|
HCl |
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
X |
|
MeCN, Et2O |
|
|
SH |
||||
|
|
|
|
|
|
R |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SH X |
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
2a−d |
|||
R = Me, t-Bu, Ph, 4-MeC6H4, 1-C10H7, 2-(5-ClC4H2S);
X = F (a), Cl (b), Br (c), I (d)
Многие химические превращения этих соединений приводят к образованию серусодержащих гетероциклов. Так, например, реакция хлорацетона 1b (R = Me) с диазометаном приводит к производным тиирана (схема 2). Ее интермедиатом является 2-метил-(2-хлорметил)-1,3,4-тиадиазолин, который мгновенно элиминирует азот, превращаясь в 2-метил-(2-хлорметил)тииран 3 [3].
22 |
Пленарные доклады |
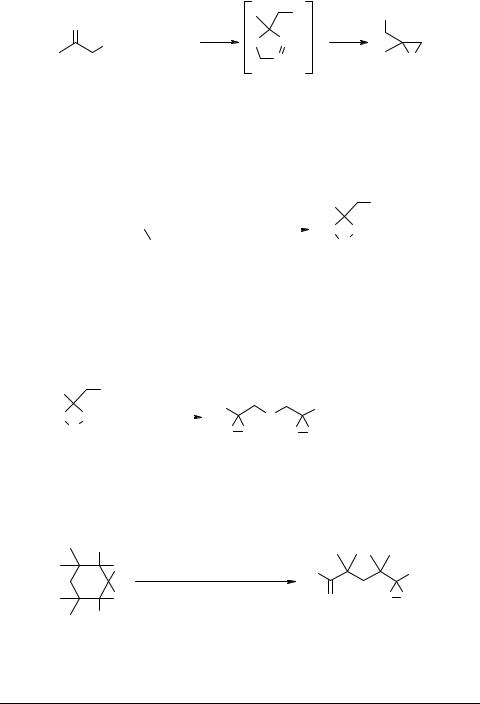
Схема 2
S |
Cl |
|
Cl |
|
|
|
|
Cl + CH2N2 |
S N |
−N2 |
S |
|
N |
||
|
|
||
1b |
|
|
3 |
При взаимодействии дитиола 2b с метанольным раствором ацетата свинца образуется 2-фенил-(2-хлорметил)-1,3-дитиа-4-плюмбоциклобутан 4 [4] (схема 3).
Схема 3
|
SH |
|
|
Ph |
Cl |
|
|
+ (AcO)2Pb |
|
|
|
||
Ph |
|
|
|
S |
S |
|
|
|
|
||||
|
|
|
Cl |
−2AcOH |
Pb |
|
|
SH |
|||||
|
|
|
||||
|
2b |
|
|
|
4 |
|
Последний легко реагирует с серой в ДМФА с образованием бис-(2-фенил- 2-эпидитиоэтил)сульфида 5 (схема 4), в молекуле которого содержится два дитиирановых цикла [5].
Схема 4
Ph |
|
Cl |
|
Ph |
|
Ph + 2PbS + [SCl2] |
2 S |
S |
+ 1/2 S8 |
|
S |
||
|
S |
|||||
|
Pb |
|
|
S |
S S |
|
|
4 |
|
|
|
5 |
|
Первое стабильное производное дитиирана было получено японскими исследователями в 1995 г. окислением бициклических дитиетанов пероксомоносульфатом калия [6].
Ph |
|
|
S 2KHSO5, KHSO4, K2SO4 Ph |
|
Ph |
S |
O |
S S |
Ph |
|
|
Также в Японии в 1999 г. было синтезировано второе стабильное производное дитиирана взаимодействием S-оксидов диалкилтиокетонов с реактивом Лавессона [7].
Генеральный спонсор и организатор – InterBioScreen Ltd. |
23 |

R R |
|
R R |
R' |
реактив Лавессона |
R' |
R' |
R' |
|
SO |
|
S S |
Попытка Сеннингом А. получить дитиираны каталитическим флеш-термоли- зом гем-дитиолов оказалась безуспешной [8].
Тионы 1 и дитиолы 2 использованы нами для синтеза пятичленных гетероциклов, содержащих гетероатомы серы и азота. Так, легко протекающая реакция бромтиоацетона 1с (R = Me) с диазометаном при –50°С приводит к устойчивому 2-метил-2-бромметил-1,3,4-тиадиазолину 6 с выходом 82% [3] (схема 5).
Схема 5
Br
S
|
|
Br + CH2N2 |
S N |
||
|
|
||||
|
|
|
|
|
N |
|
|
|
|
|
|
1c (R = Me) |
6 |
||||
Реакция гидразина с дитиолом 2b в среде безводного эфира приводит к гидразону 2,2-димеркапто-2-фенилэтаналя 7, который далее циклизуется в 5-фенил- 1,2,3-тиадиазолин 8 [9] (схема 6).
Схема 6
|
SH |
|
|
|
SH |
|
Ph |
|||||||
|
+ 3 NH2NH2 |
|
|
|
S |
|||||||||
Ph |
|
|
|
Ph |
|
|
|
|
NH2 |
|
||||
|
|
|
|
SH N |
|
|
||||||||
|
|
SH |
Cl |
|
|
|
|
|
N |
|
N |
|||
|
|
|
|
|
|
|
||||||||
|
2b |
|
|
|
7 |
|
|
|
|
H |
||||
|
|
|
|
|
|
|
8 |
|
||||||
Промежуточное образование гидразона 7 зафиксировано методом ИК спектроскопии при проведении реакции в кювете спектрометра. При этом в ИК спектре сначала появляются полосы, отвечающие колебаниям C=N (1670 см–1) ациклического интермедиата 7, находящегося в динамическом равновесии с образующимся конечным продуктом 8. В дальнейшем полоса 1670 см–1 исчезает, а интенсивность полосы 1630 см–1 (C=N циклического продукта 8) значительно возрастает.
Взаимодействие гем-дитиола 2b с глицином в мольном отношении 1 : 1 во влажном эфире в течение трех суток при 25°С неожиданно привело к 5-меркапто- 5-фенилтиолан-2-ону 9 с выходом 78% [10] (схема 7).
24 |
Пленарные доклады |

Схема 7
SH |
|
O |
HS Ph |
+ H2N |
|
||
Ph |
|
S |
|
SH |
Cl |
|
OH |
|
O |
||
|
|
|
|
2b |
|
|
9 |
Тионы 1 и дитиолы 2 использованы нами как прекурсоры шестичленных гетероциклов, содержащих один, два, три и даже четыре эндоциклических атома серы (схемы 8–13).
Взаимодействие дитиола 2b с β-аланином аналогично реакции с глицином привело к 6-меркапто-6-фенилтетрагидротиапиран-2-ону 10 с выходом 68% [10].
Схема 8
SH |
|
|
|
|
HS Ph |
+ |
|
O |
|
S |
|
Ph |
|
|
|
||
H N |
|
OH |
O |
||
SH |
Cl |
2 |
|
|
|
|
|
|
|
|
|
2b |
|
|
|
|
10 |
Таким образом, реакция гем-дитиолов с аминокислотами оказалась новым путем формирования тиолактонов.
Галогентионы 1 являются новыми перспективными синтонами для получения производных 1,4-дитиана. Так, в присутствии HСl при 20°С галогентиоацетоны 1b, c быстро реагируют с метанолом, образуя транс-2,5-диметокси-2,5-диметил-1,4-ди- тиан 11 [11] (схема 9).
Схема 9
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OMe |
|
|
|
|
||||
S |
H+ |
|
|
|
|
|
OMe |
|
|
|
|
|
HS |
|
|
|
S |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
+ MeOH |
2 |
|
|
|
|
|
|
|
OMe |
||||||||||||||||
|
|
|
20°C |
|
|
|
|
|
X |
|
|
|
−HX |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
SH |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
1b, c |
|
|
|
|
|
|
MeO |
|
S |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
−HX |
|
|
|
|
|
|
|
|
|
|
S OMe |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
11 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
X = Cl, Br |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Генеральный спонсор и организатор – InterBioScreen Ltd. |
25 |
|||||||||||||||||||||||||||
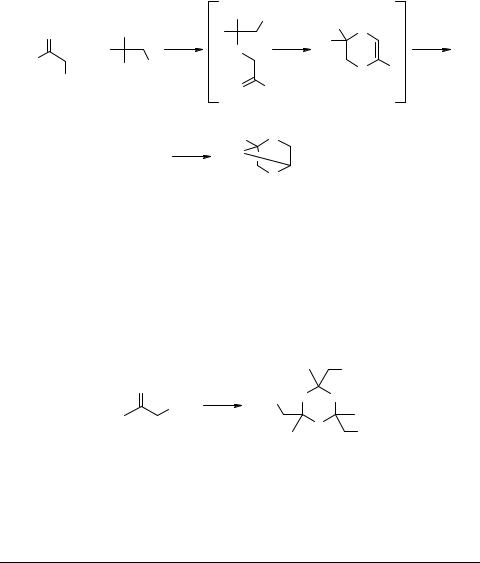
Реакция начинается с присоединения метанола к тиокарбонильной группе и завершается межмолекулярной конденсацией с выделением галогеноводорода. Строение образующегося дитиана 11 установлено методом РСА.
В отличие от метанола, высшие спирты (этанол, изопропанол и бутанол) реагируют с 1-галоген-2-органилэтан-2-тионами крайне медленно, тогда как последние легко реагируют с изоструктурными дитиолами 2, образуя в конечном итоге 2,5-диалкил-2,5,7-тритианорборнаны 12 [1, 11] (схема 10).
Схема 10
|
|
SH |
|
|
SH |
X |
|
R |
S |
|
S |
|
|
R |
|
HS |
|||
|
|
|
|
|
|||||
|
+ |
R |
|
|
S |
|
|
|
|
R |
X |
−HX |
−HX |
|
|
|
|||
|
SH |
|
|
|
S R |
||||
|
X |
|
|
|
|
|
|||
|
2 |
|
|
S |
R |
|
|
|
|
|
1 |
|
|
|
|
|
|||
|
|
|
|
|
R |
S |
|
|
|
|
|
|
|
|
S |
|
|
|
|
S  R
R
12
R= Me, t-Bu; X = F, Cl
Вконтакте с водой хлортиоацетон 1b тримеризуется [12] с образованием 2,4,6-триметил-2,4,6-трис(хлорметил)-1,3,5-тритиана 13 с количественным выходом
(схема 11).
Схема 11
|
S |
|
|
|
Cl |
|
H2O |
Cl S |
|
S |
|
3 |
|
|
|||
|
Cl |
|
S |
|
|
|
|
|
|
Cl |
|
|
|
1b |
|
13 |
|
|
|
|
|
Дитиолы 2 являются также синтонами для получения тетратианов. Так, окисление дитиолов 2 бромом, иодом, элементной серой, а также при УФ облучении приводит к бис-гем-замещенным-2,3,5,6-тетратианам 14 с выходом 50–90% [13] (схема 12).
26 |
Пленарные доклады |
