
Физическая и коллоидная химия
.pdf■ 2000 Дж
18. Химическая реакция, у которой стандартное изменение энергии Гиббса равно стандартному изменению энергии Гельмгольца( Т=298К):
□ CH4(Г) + CО2(Г) = 2 CО(Г) +2 H2(Г)
■ FeO (T) + CО(Г) = CО2(Г) +Fe(T)
□CaCO3(T) = CО2(Г) +CaO(T)
□CО2(Г) + 4H2(Г) = CH4(Г) +2 H2O(Г)
19. Функция, характеризующая приращение соответствующего
термодинамического потенциала при изменении количества данного
вещества при фиксированных естественных переменных и неизменных
количествах остальных веществ:
□изобарно-изотермический потенциал
□изохорно-изотермический потенциал
□парциальная мольная величина
■ химический потенциал
20. Для некоторой условной реакции при Т=300К изменение энтальпии равно
115кДж/моль, изменение энтропии равно 50 Дж/(моль К). Значение энергии Гиббса:
□ 100 Дж/моль

■ 100 кДж/моль
□-114885 Дж/моль
□130кДж/моль
21. Для химической реакции CО2(Г) + 4H2(Г) = CH4(Г) +2 H2O(Г) константа равновесия Кр
имеет вид:
■ K p
□K p
□K p
□K p
p(CH 4 ) p2 (H2O)
p(CO2 ) p4 (H2 )
p(CH 4 ) p(H2O)
p(CO2 ) p(H2 )
p(CO2 ) p(H2 )
p(CH 4 ) p(H2O)
p(CO2 ) p4 (H2 )
p(CH 4 ) p2 (H2O)
22.Химическая переменная (ζ) это:
□изменение массы вещества в ходе реакции
□приращение стехиометрических коэффициентов
■ отношение изменения количества вещества к стехиометрическому коэффициенту
□ отношение изменения энергии Гиббса к изменению массы вещества
23. Частная производная энергии Гельмгольца по температуре при постоянном объеме |
F |
: |
|
|
|||
T |
|||
|
V |

□-V
□V
□S
■ –S
24. Для химической реакции CH4(Г) + CО2(Г) = 2 CО(Г) +2 H2(Г) константа равновесия Кр
имеет вид:
□ KP |
p CH 4 p CO2 |
|
p CO p H2 |
||
|
□ KP |
p CH 4 |
|
p CO2 |
|
2 |
2 |
|
|
p CO |
|
p H2 |
■ K P |
p 2 CO p 2 H |
2 |
||
|
|
|||
p CH 4 |
p CO2 |
|||
|
||||
□ KP |
p CO p H2 |
||
p CH 4 |
p CO2 |
||
|
|||
25. Изобара химической реакции( изобара Вант-Гоффа):
■ ln |
K2 |
|
H |
1 |
1 |
||
K1 |
|
R |
|
T1 |
|
T2 |
|

□ |
lnKC |
V = |
U |
T |
RT 2 |
□ lnKP =- |
rG |
|
|
RT |
□ ∆S=-nF
E
T P
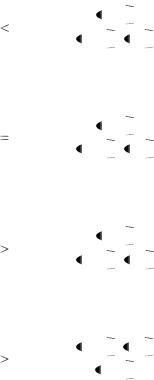
26.Изохора химической реакции( изохора Вант-Гоффа):
|
lnK |
|
|
|
|
|
|
□ |
|
p = |
|
T |
RT 2 |
■ ln |
K2,C |
|
U |
1 |
1 |
||
K1,C |
|
R |
|
T1 |
|
T2 |
|
□ lnKP =- |
G |
RT |
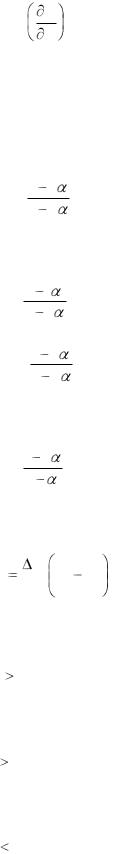
□ ∆S=-nF
E
T P
27. Реакционная смесь, состоящая из 1 моль N2 и 1 моль Н2 реагирует по уравнению
N2(Г) + 3H2(Г) =2NH3(Г). Равновесная мольная доля водорода, выраженная через степень
диссоциации:
33
□х (Н2)= 2 2
11
□х(Н2)= 2 2
13
■ х (Н2)= 2 2
13
□х(Н2)= 1
28. Условие, при котором можно использовать следующий вид изобары Вант-Гоффа
ln |
K2 |
|
H |
1 |
1 |
: |
||
K1 |
|
R |
|
T1 |
|
T2 |
||
□ K2 K1
□ T2 T1
□ T2 T1
■ если тепловой эффект можно считать постоянным в интервале температур от Т1 до Т2 .
29. При увеличении общего давления равновесие реакции CО(Г) + H2О(Г) = CО2(Г) +H2(Г) :
□сдвигается в сторону продуктов
□сдвигается в сторону исходных веществ
■ не изменяется
□ сдвигается в строну продуктов значительно
30.Для химической реакции, протекающей в идеальной газовой фазе O2(Г) + 2SO2(Г) =2SO3(Г)
критерием самопроизвольности прямой реакции при р,Т=const и при заданных парциальных давлениях реагентов рi служит выражение:
□ RT ln K p |
RT ln |
p 2 |
SO |
3 |
|
||
|
|
|
|
||||
P 2 SO |
2 |
P O |
2 |
||||
|
|
||||||
|
|
|
|
|
|||
□ RT ln K p |
RT ln |
p 2 |
SO |
3 |
|
||
|
|
|
|
||||
P 2 SO |
2 |
P O |
2 |
||||
|
|
||||||
|
|
|
|
|
|||
■ RT ln K p |
RT ln |
p 2 |
SO |
3 |
|
||
|
|
|
|
||||
P 2 SO |
2 |
P O |
2 |
||||
|
|
||||||
|
|
|
|
|
|||
□ RT ln K p |
RT ln |
p 2 SO |
2 |
p O |
2 |
|
|
|
|
||||
P 2 |
SO |
2 |
|
|||
|
|
|
||||
|
|
|
|
|
|
|
31.Частная производная от любой экстенсивной переменной по количеству данного i-го
компонента( в молях) при постоянном давлении, температуре и числах молей
остальных компонентов называется:
■ парциальной мольной величиной
□химическим потенциалом
□химической переменной
□активностью
32.Увеличение энтропии при смешении двух разных газов( число молей каждого газа- N),
каждый из которых занимает объем V равно:
□∆Smix=2NRln1
■∆Smix=2NRln2
□∆Smix=NRln2
□∆Smix=2NRln4
33. Экстенсивной переменной является:
■ объем
□температура
□плотность
□давление
34. Интенсивной переменной является:
■ температура
□объем
□энтропия
□ теплоемкость
35Первый закон Гиббса-Коновалова:
□равновесные жидкость и пар всегда имеют одинаковую концентрацию компонентов
□пар по сравнению с жидкостью богаче нелетучим компонентом
■пар относительно богаче тем компонентом, прибавление которого к раствору
повышает общее давление пара или при данном давлении понижает температуру
кипения
□линии жидкости и пара имеют разрыв
36.Азеотропными смесями называют:
■смеси, состав которых при перегонке не меняется и они кипят при постоянной
температуре
□смеси, которые можно разделить на чистые компоненты путем перегонки
□концентрация летучего компонента в равновесном паре больше, чем в жидкости
□линии жидкости и пара имеют разрыв
37. Уравнение Вант-Гоффа, позволяющее рассчитать осмотическое давление растворов
электролитов:
□ |
|
RT |
|
ln a |
|
|
|
||
|
||||
|
1 |
|||
|
V1 |
|||

□ |
|
RT |
|
x |
|
|
|
||
|
2 |
|||
|
V1 |
|||
■  icRT
icRT
□  cRT
cRT
38. Метод определения молекулярных масс по понижению температуры замерзания раствора:
■ криоскопия
□эбулиоскопия
□калориметрия
□осмометрия
39. Метод определения молекулярных масс по повышению температуры кипения растворов:
□ криоскопия
■ эбулиоскопия
□калориметрия
□осмометрия
40.Температура, выше которой имеет место неограниченная взаимная растворимость компонентов это:
□температура кипения
□температура замерзания
■ критическая температура

□ температура растворения
41. При Т= 288К водный раствор янтарной кислоты( 1,2 г в 100 см3 ) находится в равновесии с эфирным раствором янтарной кислоты ( 0,2 г в 100 см3 ).
Константа распределения равна:
□0,24
□7,2
■ 6
□ 12
42.Метод экспериментального определения теплот химических реакций, теплот фазовых превращений, теплот растворения:
□криоскопия
□эбулиоскопия
■ калориметрия
□ осмометрия
43. Зависимость давления от температуры при равновесии двух фаз описывается уравнением Клайперона:
□ |
dp |
|
Hф.п. |
dT |
|
RT 2 |
|
|
|
