
Физическая и коллоидная химия
.pdf
517.Установлено, что при 20 °С связь между характеристической вязкостью раствора полиизобутилена и его молярной массой M описывается формулой [ ] (л/г) = 3.60 10–4 М0.64. Определить молярную массу фракции полиизобутилена в растворе, характеристическая вязкость которого равна 1.80 м3/кг.
518.Измерения характеристической вязкости растворов нескольких фракций полиизобутилена с известными молярными массами в диизобутилене привели к следующим результатам:
М, кг/моль |
6.2 |
10.4 |
124 |
856 |
|
|
|
|
|
[ ], м3/кг |
0.00963 |
0.0134 |
0.0655 |
0.225 |
Вычислить коэффициенты уравнения Марка-Хаувинка.
519. Рассчитайте молярную массу полистирола по характеристической вязкости его раствора 0.105 л/г. Растворитель – толуол; константы уравнения Марка– Хаувинка для данных условий: KMH = 1.7 ×10–5 л/г, = 0.69.
520. Вычислить молярную массу поливинилацетата в бензоле, если характеристическая вязкость его раствора равна 0.225 л/г, константы уравнения Марка–Хаувинка KMH = 5.7 ×10–5 л/г и = 0.70.
522. Определить молярную массу поливинилацетата в хлороформе, используя следующие данные: [ ] = 0.340 л/г, константы уравнения Марка–Хаувинка KMH = 6.5 ×10–5 л/г и = 0.71.
521. В таблице ниже приведены результаты измерений вязкости смесей сливок со снятым (обезжиренным) молоком и
дистиллированной водой как функция концентрации жира при 64 °С |
|
|
|
||||
|
с, вес % |
20.0 |
16.0 |
12.0 |
8.0 |
4.0 |
0 |
|
|
|
|
|
|
|
|
|
*, г/см3 |
1.021 |
1.029 |
1.037 |
1.045 |
1.053 |
1.061 |
|
|
|
|
|
|
|
|
|
, сПз |
2.506 |
2.047 |
1.739 |
1.490 |
1.270 |
1.134 |
* - плотность эмульсии, плотность жира сливок 0.8887 г/см3)
Постройте по этим данным график зависимости приведѐнной вязкости от объѐмной доли жира и определить
характеристическую вязкость [ (η η0)/η0 при |
0]. Равна ли она теоретическому коэффициенту уравнения Эйнштейна для |
суспензий ? |
|
523. |
Определить молярную массу нитроцеллюлозы, если характеристическая вязкость еѐ раствора в ацетоне составляет |
||||||
0.204 м3/кг, константы уравнения Марка–Хаувинка KMH = 0.89 ×10–5 л/г и |
= 0.9. |
|
|
||||
524. |
Для растворов нескольких образцов полипропиолактона в бутилхлориде получена следующая зависимость |
||||||
характеристической вязкости от молярной массы при 13 °С: |
|
|
|
|
|||
|
|
М, кг/моль |
150 |
107 |
49.1 |
19.6 |
|
|
|
|
|
|
|
|
|
|
|
[ ], см3/г |
38.6 |
32.8 |
22.1 |
14.2 |
|
Вычислить коэффициенты уравнения Марка-Хаувинка.
525. Определить молярную массу этилцеллюлозы в толуоле, используя данные вискозиметрического метода (константы:
KMH = 11.8 ×10–5 л/г, = 0.666):
Концентрация полимера, г/л |
2.0 |
4.0 |
6.0 |
8.0 |
10.0 |
|
|
|
|
|
|
Приведенная вязкость, л/г |
0.163 |
0.192 |
0.210 |
0.240 |
0.263 |
526. При 25 °С была определена характеристическая вязкость растворов в тетрагидрофуране нескольких фракций полистирола с известными молярными массами:

М ×10–6, г/моль |
0.0204 |
0.0972 |
0.39 |
0.86 |
2.42 |
4.59 |
9.60 |
35.0 |
|
|
|
|
|
|
|
|
|
[ ], л/г |
17.3 |
48.7 |
134 |
244 |
498 |
800 |
1350 |
3220 |
Вычислить коэффициенты уравнения Марка-Хаувинка.
4. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПРОВЕДЕНИЮ АКТИВНЫХ ФОРМ ОБУЧЕНИЯ
С целью повышения эффективности обучения применяются формы индивидуально-группового обучения, что позволяет активизировать работу студентов на занятии, а также способствует формированию специальных умений и актуализации теоретических знаний
На лабораторно-практических занятиях используется метод анализа проблемных ситуаций на основе реальных или модельных ситуаций.
Для контроля знаний используются защита рефератов. Студенты готовят текст реферата и делают по нему презентацию, которую представляют в группе. Обсуждение доклада происходит с участием всех студентов группы – дискуссии по теме доклада.
Доклады и обсуждения презентаций студенческих работ проводят в рамках аудиторного и внеаудиторного времени (конференций, круглых столов).
Образовательные технологии, применяемые в процессе обучения по дисциплине
|
Учебно-образовательный |
|
|
№ |
|
Темы и применяемые |
|
модуль. |
|
||
|
|
||
п/п |
|
активные формы обучения и другие |
|
Цели применения активных форм |
образовательные технологии |
||
|
|||
|
|
||
|
обучения |
|
|
|
|
|
|
1 |
Модуль 1 |
1.презентация лекций |
|
|
Цели: изучить методы определения |
2.работа в малых группах на |
|
|
тепловых эффектов и констант |
лабораторных работах |
|
|
равновесия химических реакций |
|
|
|
|
|
|
2 |
Модуль 2 |
1.презентация лекций |
|
|
Цели: изучить свойства растворов и |
2.работа в малых группах на |
|
|
фазовые равновесия. |
лабораторных работах |
|
3 |
Модуль 3 |
1.презентация лекций |
|
|
Цели: изучение электропроводимости |
2.работа в малых группах на |
|
|
растворов электролитов. |
лабораторных работах |
|
|
Термодинамические свойства |
|
|
|
гальванического элемента. |
|
|
|
|
|
|
4 |
Модуль 4. |
1.презентация лекций |
|
|
Цель: изучить кинетику химических |
2.работа в малых группах на |
|
|
реакций. |
лабораторных работах |
|
5 |
Модуль 5. |
1.презентация лекций |
|
|
Цель: изучить природу и термодинамику |
2.работа в малых группах на |
|
|
поверхностных явлений( адгезия, |
лабораторных работах |
|
|
смачивание, адсорбция). |
|
|
6. |
Модуль 6. |
1.презентация лекций |
|
|
Цель: изучить оптические свойства и |
2.работа в малых группах на |
|
|
устойчивость дисперсных систем |
лабораторных работах |
7. |
Модуль 7. |
1.презентация лекций |
|
Цель: изучить свойства лиофобных |
2.работа в малых группах на |
|
дисперсных систем |
лабораторных работах |
8. |
Модуль 8. |
1.презентация лекций |
|
Цель: изучить свойства лиофильных |
2.работа в малых группах на |
|
дисперсных систем |
лабораторных работах |
Основная литература.
1.Зимон А.Д. Физическая химия. М: Высшая Школа 2006-320с.
2.Зимон А.Д. Коллоидная химия. М: ВЛАДМО, 2007-318с.
3.Стромберг А.Г., Семченко Д.П. Физическая химия. М: Высшая школа
2009527с.
4.Сумм Б.Д. Основы коллоидной химии М.: Аcademia, 2009240с.
5.Фролов Ю.Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. М: Альянс, 2009464 с.
Дополнительная литература.
1.Зимон А.Д. Занимательная физическая химия. М: ВЛАДМО, 2005-176с.
2.Зимон А.Д. Занимательная коллоидная химия. М: РАДЭКОН, 2000-192с.
3.Краткий справочник физико-химических величин. Под.ред. А.А. Равделя, А.М. Пономаревой. Л.: Химия, 1983,231с.
4.Щукин Е.Д., Прецов А.В. , Амелина Е.А. Коллоидная химия. М.: Высшая школа, 2007.
5.Физическая химия. Под/ ред. К.С. Краснова/ М.: Высшая шкрла, 2001, ч.1 512с., ч.2 320с.
5. ТЕСТЫ ПО ДИСЦИПЛИНЕ
Химическая термодинамика
1.Математическое выражение первого закона термодинамики для бесконечно малого
изменения величин:
□ ∆U=Q-A
■ dU=δQδAмех +δA'
□δQ= dUδAмех
□dU=δQ+δAмех
2.Бесконечно малое изменение энтальпии является полным дифференциалом и равно:
□δH=δU+δ(pV)
□∆H=∆U+pV
■ dH=dU+d(pV)
□ ∆H=∆U-p∆V
3.Энтальпия полиморфного превращения 1 моль алмаза в графит при стандартных условиях,
если известны теплоты сгорания графита( ∆сH°C гр=-393,5кДж/моль) и алмаза( ∆сH°C ал=-
395,4кДж/моль):
□-788,9кДж
□1,9 кДж
■ -1,9 кДж
□ 788,9 кДж
4.Энтальпия индивидуального вещества следующим образом зависит от

температуры:
H
□ T V CV
□
H
T
■
H
T
CV
P
CP
P
□dH=d(pV)
5.Химическая реакция, у которой тепловой эффект в изобарных условиях равен тепловому эффекту в изохорных условиях( Т=298К):
□CH4(Г) + CО2(Г) = 2 CО(Г) +2 H2(Г)
■ FeO (T) + CО(Г) = CО2(Г) +Fe(T)
□CaCO3(T) = CО2(Г) +CaO(T)
□CО2(Г) + 4H4(Г) = CH4(Г) +2 H2O(Г)
6.Работа изохорного обратимого нагревания 5 моль азота, принятого за идеальный газ, в
интервале температур от 300К до 400К:
□500кДж
■ 0 Дж
□20 кДж
□20 кДж

7.Изменение внутренней энергии в круговом процессе:
□ 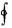 dU 0
dU 0
□  dU 0
dU 0
■ 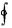 dU 0
dU 0
□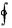 dU 0
dU 0
8.Внутренняя энергия гомогенной системы является функцией независимых переменных системы:
■ Т,V
□T,P
□V,P
□T
9.Закон Кирхгофа применительно к процессам, протекающим при постоянном давлении:
|
H 0 |
|
0 |
■ |
|
|
i CPi |
T |
|
||
|
P |
i |
|
|
|
|

|
U 0 |
|
0 |
□ |
|
|
i CPi |
T |
|
||
|
V |
i |
|
|
|
|
□ |
U 0 |
C |
0 |
|
|
||
|
T |
V |
|
|
V |
|
|
|
|
|
|
H 0 |
0 |
|
□ |
|
CP |
|
T |
|||
|
V |
||
|
|
10.Работа, совершаемая 2 моль идеального газа в изобарном процессе ( р=100 Па) при изменении объема на 10 м3.
□ 500 Дж
■ 1000 Дж
□1500 Дж
□2000 Дж
11.Выражение, характеризующее изменение энтропии в равновесных процессах:
Q
□ dS> T
Q
■ dS= T
Q
□ dS≥ T
Q
□ dS≤ T
12.Формула расчета энтропии при нагревании или охлаждении системы в
изобарных условиях:
□ ∆S= T2 CV dT
T1 T
□ ∆S= CV ln T2
T1
■ ∆S= T2 CP dT
T1 T
H
□ ∆S= T
13. Изменение энтропии рассчитывается как ∆S= |
H |
в случае: |
|
T |
|||
|
|
||
□ нагревания при постоянном объеме |
|
|
|
□ при смешении идеальных газов |
|
|
|
□ расчета абсолютного значения энтропии |
|
|
|
■ фазового перехода |
|
|
14.При абсолютном нуле(Т=0 К) все идеальные кристаллы имеют
одинаковую энтропию, равную нулю. Это постулат:
□ Кельвина

□Нернста
□Джоуля
■ Планка
15. Для закрытых систем, в которых совершается только работа расширения,
объединенное уравнение термодинамики:
■ dU=TdS-pdV
□dH=dU+pdV
□dU=TdS-pdV+ ∑μidni
□dU=TdS+ δAмех
16. Частная производная энергии Гиббса по температуре при постоянном
давлении |
G |
равна: |
|
|
|||
T |
|||
|
p |
||
|
|
□V
□V
□S
■ –S
17. Работа, совершаемая 5 моль идеального газа в изобарном процессе ( р=200 Па) при изменении объема на 10 м3.
□500 Дж
□1000 Дж
□1500 Дж
