
Физическая и коллоидная химия
.pdf
|
t, час |
2 |
4 |
10 |
20 |
40 |
80 |
|
|
|
|
|
|
|
|
|
|
|
С, моль/л |
0.186 |
0.176 |
0.151 |
0.122 |
0.089 |
0.0570 |
|
426. Константа скорости реакции второго порядка 2О3 |
3О2 |
равна 0.450 л моль–1 |
с–1 при 383 К. Вычислить время |
|||||
превращения О3 на 50%, 70%, 80% и 90 % и постройте по этим результатам кинетические кривые (зависимость концентрации от времени реакции) для О3 и О2 при начальной концентрации озона 2.00 ммоль/л и кислорода 0 моль/л.
427. Константа скорости реакции пиридина с метил иодидом C5H5N + CH3I |
C5H5NCH3I (в тетрахлорэтане) определена |
|||||
для четырѐх температур: |
|
|
|
|
|
|
|
, °С |
19.9 |
29.9 |
39.9 |
50.0 |
|
|
|
|
|
|
|
|
|
k ×10–2, л моль–1 мин–1 |
0.713 |
1.50 |
3.05 |
5.89 |
|
Определить коэффициенты уравнения Аррениуса.
428. Для реакции в водном растворе (CH3)3CBr + H2O (CH3)3COH + H+ + Br– получены следующие данные при 298 К:
t, час |
1.389 |
5.56 |
11.11 |
16.67 |
27.78 |
41.67 |
|
|
|
|
|
|
|
[(CH3)3CBr], моль/л |
0.0380 |
0.0308 |
0.0233 |
0.0176 |
0.0100 |
0.00502 |
Определить по этим данным 1) порядок реакции по (CH3)3CBr, 2) константу скорости, 3) начальную концентрацию
(CH3)3CBr.
429. Константа скорости реакции первого порядка разложения ацетондикарбоновой кислоты OC(CH2COOH)2 в водном растворе зависит от температуры следующим образом:
|
|
|
, °С |
|
|
0 |
20 |
|
40 |
60 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k ×105, с–1 |
|
|
2.46 |
47.5 |
|
576 |
5480 |
|
|
|
|
|
Вычислить коэффициенты уравнения Аррениуса. |
|
|
|
|
|
|
|
|
|
|
|
||||
430. Гипохлорит-ион в щелочном водном растворе разлагается по стехиометрическому уравнению 3ClO |
ClO3 2Cl . |
||||||||||||||
Определить порядок реакции по гипохлорит-иону по следующим данным, полученным при начальной концентрации ClO– |
|||||||||||||||
0.0127 моль/дм3 и избытке щелочи (0.26 моль/дм3 ОН–): |
|
|
|
|
|
|
|
|
|
|
|||||
|
t, час |
0.278 |
0.833 |
2.778 |
5.556 |
11.111 |
27.778 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
[ClO–], моль/ дм3 |
0.0122 |
0.0113 |
0.0089 |
0.0069 |
0.0047 |
0.0024 |
|
|
||||||
431. В следующей таблице приводится текущая концентрация гексафенил этана [(C6H5)3C]2 при его разложении в смеси |
|||||||||||||||
95% толуола + 5% анилина при 0 °С: |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
t, мин |
0.50 |
2.20 |
|
5.50 |
7.85 |
|
9.45 |
14.75 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|||||||
|
|
С, моль/л |
0.0934 0.0733 |
0.0465 0.0334 |
0.0265 0.0134 |
|
|
|
|||||||
Определить кинетический порядок, константу скорости и начальную концентрацию реагента.
432. Следующие ниже данные показывают долю остающейся (не прореагировавшей) сахарозы от начальной концентрации как функцию времени реакции при еѐ гидролизе в водном растворе 0.099 моль/л HCl (катализатор) при 35 °С:
t, мин |
9.82 |
59.60 |
93.18 |
142.9 |
294.8 |
589.4 |
|
|
|
|
|
|
|
С/С0 |
0.965 |
0.803 |
0.710 |
0.591 |
0.328 |
0.111 |
Чему равен кинетический порядок по сахарозе и константа скорости?
433. |
Определить константу Михиэлиса и число обращения фермента -химотрипсина в реакции гидролиза метилового |
|||||
эфира N-ацетил-L-валина по следующим данным, полученным при начальной концентрации фермента 38 мкмоль/л при 25 °С в |
||||||
растворе |
0.1 моль/л KCl ([S]0 - начальная концентрация субстрата, v0 - начальная скорость гидролиза): |
|||||
|
[S]0, моль/л |
0.200 |
0.124 |
0.091 |
0.071 |
0.060 |

v0×106, моль/(л·с) |
4.57 |
3.83 |
3.31 |
2.93 |
2.67 |
434. Для гидролиза метилового эфира N-бензоил-L-аминомасляной кислоты под действием фермента -химотрипсина с начальной концентрацией 2.16 мкмоль/л при 25 °С в растворе 0.1 моль/л KCl получены следующие результаты:
[S]0, ммоль/л |
2.24 |
1.49 |
1.12 |
0.90 |
0.75 |
|
|
|
|
|
|
v0×106, моль/(л·с) |
0.425 |
0.360 |
0.312 |
0.271 |
0.245 |
где [S]0 - начальная концентрация субстрата, v0 - начальная скорость гидролиза. Определить коэффициенты уравнения Михаэлиса-Ментена.
435. В следующей таблице приведена зависимость скорости ферментативной реакции от концентрации субстрата [S] :
[S], ммоль/дм3 |
0.40 |
0.60 |
1.00 |
1.50 |
2.00 |
3.00 |
4.00 |
5.00 |
10.0 |
|
|
|
|
|
|
|
|
|
|
v, у.е.* |
2.41 |
3.33 |
4.78 |
6.17 |
7.41 |
8.70 |
9.52 |
10.5 |
12.5 |
*условные единицы измерения
Определить константу Михаэлиса графическим методом.
436. Следующие ниже данные получены для гидролиза аденозинтрифосфорной кислоты (АТФ) под действием фермента миозина при 25 °С и рН 7.0
[АТФ] ×103, моль дм–3 |
0.075 |
0.125 |
0.20 |
0.325 |
0.625 |
1.55 |
3.20 |
|
|
|
|
|
|
|
|
v ×106, моль дм–3 с–1 |
0.067 |
0.095 |
0.119 |
0.149 |
0.185 |
0.191 |
0.195 |
Определить константу Михаэлиса и предельную скорость катализа графически.
Тема : строение вещества и спектроскопия
501. Вычислить дипольный момент молекулы диэтилового эфира по следующим данным о зависимости относительной
диэлектрической проницаемости |
r и плотности |
от температуры Т: |
|
|
|
|
Т , К |
283 |
288 |
293 |
298 |
|
|
|
|
|
|
|
, г/см3 |
0.725 |
0.720 |
0.714 |
0.705 |
|
|
|
|
|
|
|
r |
4.60 |
4.45 |
4.35 |
4.18 |
502. Вычислить дипольный момент молекулы хлористого этила по следующим данным о зависимости относительной
диэлектрической проницаемости |
r и плотности |
от температуры Т: |
|
|
|
|
Т , К |
283 |
288 |
293 |
298 |
|
|
|
|
|
|
|
, г/см3 |
0.904 |
0.898 |
0.890 |
0.883 |
|
|
|
|
|
|
|
r |
7.64 |
6.94 |
6.34 |
5.70 |
503. Вычислить дипольный момент и деформационную поляризуемость молекулы бромбензола по следующим данным о
зависимости относительной диэлектрической проницаемости |
r и плотности |
от температуры Т: |
|||
|
Т , К |
283 |
288 |
293 |
298 |
|
|
|
|
|
|
|
, г/см3 |
1.507 |
1.501 |
1.493 |
1.483 |
|
|
|
|
|
|
|
r |
5.88 |
5.62 |
5.42 |
5.22 |
504. Вычислить дипольный момент молекулы пропанола-1 по следующим данным о зависимости относительной
диэлектрической проницаемости |
r и плотности |
от температуры Т: |
|
|
|
|
Т , К |
283 |
288 |
293 |
298 |
|
|
|
|
|
|
|
, г/см3 |
0.810 |
0.806 |
0.804 |
0.798 |
|
|
|
|
|
|
|
r |
40.8 |
29.6 |
23.2 |
18.3 |
505. Вычислить дипольный момент молекулы пентанола-1 по следующим данным о зависимости относительной
диэлектрической проницаемости |
r и плотности |
от температуры Т: |
|
|
|
|
Т , К |
283 |
288 |
293 |
298 |
|
|
|
|
|
|
|
, г/см3 |
0.824 |
0.820 |
0.817 |
0.815 |
|
|
|
|
|
|
|
r |
21.1 |
18.1 |
16.1 |
14.2 |
506-510. Известно, что молярная рефракция жидкости приблизительно равна еѐ молярному объѐму. На основании этого вычислить радиус молекулы вещества (растворителя), исходя из плотности  и показателя преломления света n, указанных ниже для соответствующего номера задачи и приняв, что молекула имеет сферическую форму.
и показателя преломления света n, указанных ниже для соответствующего номера задачи и приняв, что молекула имеет сферическую форму.
задача |
растворитель |
, г/см3 |
n |
|
|
|
|
506 |
н-гексан, С6Н14 |
0.725 |
1.3802 |
507 |
этилацетат С4Н8О2 |
0.913 |
1.3798 |
508 |
н-бутанол С4Н10О |
0.816 |
1.4029 |
509 |
ацетон С3Н6О |
0.797 |
1.3616 |
510 |
н-пропанол С3Н8О |
0.810 |
1.3886 |
511-516. Вычислить момент инерции, вращательную постоянную (в Дж), приведенную массу, межъядерное расстояние, и энергию вращения на квантовом уровне с j = 5 для двухатомной молекулы, зная разность волновых чисел  соседних линий поглощения микроволнового спектра, как указано в таблице ниже для соответствующего номера задачи.
соседних линий поглощения микроволнового спектра, как указано в таблице ниже для соответствующего номера задачи.
задача |
511 |
512 |
513 |
514 |
515 |
516 |
молекула |
2Н35Сl |
3Н35Сl |
1Н37Сl |
2Н37Сl |
3Н37Сl |
1Н39Br |
, м–1 |
1097 |
751 |
2132 |
1094 |
748 |
1706 |
517-521. В таблице ниже, для соответствующего номера задачи, указаны волновые числа основного тона  1 и первого обертона
1 и первого обертона  2 колебательного спектра двухатомного газа. Определить по ним волновое число собственных колебаний, коэффициент ангармоничности, максимальное квантовое число и энергию диссоциации D одного моля данного вещества.
2 колебательного спектра двухатомного газа. Определить по ним волновое число собственных колебаний, коэффициент ангармоничности, максимальное квантовое число и энергию диссоциации D одного моля данного вещества.
задача |
молекула |
1 , см–1 |
2 , см–1 |
|
|
|
|
517 |
2Н35Cl |
2091 |
4116 |
518 |
3Н35Cl |
1719 |
3401 |
519 |
1Н37Cl |
2883 |
5660 |
520 |
2Н37Cl |
2087 |
4121 |
521 |
3Н79Br |
1519 |
3008 |
З а д а ч и
Тема: Общие вопросы
1. Угол смачивания виноградным соком нержавеющей стали составляет 50°, а полиэтилена 100°. Во сколько раз равновесная работа адгезии сока к стали больше, чем к полиэтилену ?

2. Красные кровяные шарики человека имеют форму диска диаметром 7.5 мкм и толщиной 1.6 мкм. Вычислить удельную площадь поверхности и радиус эквивалентной сферы, имеющей: 1) тот же объѐм, 2) ту же площадь поверхности. Принять плотность вещества кровяных шариков 1.00 г/см3.
3. Бочка наполнена оливковым маслом (вязкость 84.0 мПа с, плотность 0.918 г/см3) на высоту 1 м. Под собственной тяжестью масло вытекает через трубку в дне бочки. Внутренний диаметр трубки 10 мм, длина 20 см. Какое время требуется чтобы набрать литр масла через трубку ?
4. Кристаллы сахара и сахарной пудры имеют кубическую форму с длиной ребра (м): 2 10–3; 1 10–4; 6 10–5; 3 10–6; 5 10–7; 4 10–8; 7 10–9. Вычислить их удельную поверхность (м2/г) и количество частиц в 1 кг. Плотность сахара равна 1.60 г/cм3.
5. Вычислить удельную поверхность катализатора, если для образования мономолекулярного слоя на нем должно адсорбироваться 100 см3/г азота (объем приведен к нормальным условиям). Площадь молекулы азота в слое равна 1.62 10–19 м2.
6. Суспензия каолина (плотность 2.50 г/см3) состоит из приблизительно одинаковых частиц, имеющих форму правильной шестиугольной призмы с высотой 0.066 мкм и стороной основания 0.71 мкм (шестигранные таблички). Вычислить удельную площадь поверхности, а так же радиус эквивалентной сферы, имеющей 1) тот же объѐм, 2) ту же площадь поверхности.
7. Число капель воды, вытекающей из сталагмометра, равно 54.8; 54.6; 54.7. Среднее число капель исследуемого раствора равно 88.2. Поверхностное натяжение воды при температуре опыта составляет 72.4 мДж/м2. Относительная плотность раствора
/ 0 = 1.1306, где 0 – плотность воды. Вычислить поверхностное натяжение раствора.
8. Во сколько раз поверхностное натяжение глицерина выше поверхностного натяжения оливкового масла, если в капилляре с внутренним радиусом 0.400 мм столбик первого поднялся на высоту h1 = 26.8 мм, а второго – на h2 = 18.8 мм? Плотность глицерина равна 1.26 г/см3, оливкового масла – 0.94 г/см3. (Для угла смачивания обоими жидкостями принять cos = 1, плотностью воздуха пренебречь)
9.Вертикально установленная трубка с внутренним диаметром 300 мкм одним концом погружена в жидкость на глубину
3.00см, а вторым соединена с воздухом в сосуде, который позволяет создавать избыточное давление по сравнению с давлением над поверхностью жидкости вокруг трубки. Определить при каком избыточном давлении в сосуде будет происходить отрыв
пузырька воздуха от нижнего, погруженного в жидкость, конца капилляра. Поверхностное натяжение и плотность жидкости равны 72.0 мН/м и 997 кг/м3 соответственно. Плотностью воздуха пренебречь.
10.Из раствора додецилсульфата натрия с поверхностным натяжением 38 мН/м "выдут" мыльный пузырек воздуха радиусом 1 см. Чему равно избыточное давление воздуха внутри пузырька ? (ответ дайте в единицах физической атмосферы)
11.Оценить вязкость крови исходя из факта, что она проходит через аорту здорового взрослого человека (находящегося в покое) с объѐмной скоростью приблизительно 84 см3/с при перепаде давления на единицу длины ( р/ ) около 0.98 мм рт.ст./м. Радиус аорты принять 9.0 мм.
12. Предположим, 1 см3 воды распылѐн до капель с радиусом 0.1 мкм. Поверхностное натяжение воды 72.75 мН/м. Вычислить прирост энергии Гиббса в этом процессе.
13. Сколько-нибудь устойчивую эмульсию толуола в воде приготовить простым диспергированием жидкостей невозможно. Однако, если диспергировать в воде раствор спирта в толуоле, то спирт переходит из толуола в воду, оставляя за собой устойчивые капли толуола.
Если 10 г раствора, содержащего 15 вес % спирта и 85 вес % толуола, смешать с 10 г воды, эмульсия образуется самопроизвольно. Диаметр капель толуола 1.0 мкм, его плотность 0.87 г/см3, а межфазное натяжение толуол/дисперсионная среда 36 мН/м. Вычислить прирост энергии Гиббса, связанный с образованием капель, и общую энергию Гиббса этого процесса с учѐтом энергии перехода этилового спирта из толуола в воду (-315 Дж).
14. В тензометре ДюНуи (разновидность прибора для измерения поверхностного натяжение) измеряется сила, требуемая для отрыва кольца из легкой проволоки от поверхности жидкости. Если диаметр кольца 1.00 см и измеренная сила 6.77 мН, чему равно поверхностное натяжение жидкости ? (Обратите внимание, что в этом методе жидкость смачивает две поверхности кольца – внутреннюю и внешнюю)
15. При 25 °С плотность ртути равна 13.53 г/см3, поверхностное натяжение 484 мН/м. Чему равна высота подъѐма ртути в узкой стеклянной трубке относительно плоской поверхности ртути, если внутренний диаметр трубки равен 1.00 мм, а угол смачивания стенок трубки равен 180°. Плотностью воздуха пренебречь.
16. В стеклянной трубке, погруженной одним концом в воду, вода поднимается на 2.0 см при 20 °С относительно плоской поверхности (за пределами трубки). Вычислить внутренний диаметр трубки. Плотность воды равна 0.9982 г/см3, поверхностное натяжение 72.75 мН/м, угол смачивания стекла 0°. Плотностью воздуха пренебречь.
17. Если бы 30-метровое дерево снабжалось соком от корней посредством капиллярного поднятия жидкости, какой требовался бы радиус капилляров в стволе ? Принять плотность сока 1.0 г/см3, угол смачивания стенок 0° и поверхностное натяжение 73 мН/м. Плотностью воздуха пренебречь. (Примечание: в действительности сок поднимается главным образом благодаря осмосу)
18. Предположим, полидисперсный образец полимера содержит 5 молей с молярной массой 1 кг/моль, 5 молей с молярной массой 2 кг/моль, 5 молей с молярной массой 3 кг/моль и 5 молей с молярной массой 4 кг/моль. Вычислить среднечисловую, средневесовую и z-среднюю молярные массы.

19. Капиллярная трубка с радиусом 0.0500 см соприкасается с поверхностью жидкости с поверхностным натяжением 72.0 мН/м. Какое минимальное избыточное давление требуется чтобы выдуть из капилляра пузырѐк воздуха с радиусом, равным радиусу капилляра ? Принять глубину погружения капилляра в жидкость пренебрежимо малой.
20. Чтобы на конце капиллярной трубки диаметром 0.300 мм, погруженной в ацетон, образовался полусферический пузырѐк воздуха, необходимо избыточное давление в трубке 364 Па. Вычислить поверхностное натяжение ацетона в пренебрежении глубиной погружения трубки.
21. Вычислить растворимость кристалликов BaSO4, имеющих размеры 1 мкм, 0.1 мкм и 0.01 мкм при 20 °С. Принять, что кристаллики имеют шарообразную форму с диаметрами, равными указанным размерам. Плотность BaSO4 4.50 г/см3, межфазное натяжение BaSO4/Н2О 500 мДж/м2, растворимость грубодисперсного BaSO4 1.22 10–5 моль/л.
22. Вычислить среднечисловой, среднеповерхностный и среднеобъѐмный диаметры для следующего распределения сферических частиц дисперсии по диаметрам
Ni |
1 |
12 |
31 |
23 |
12 |
|
|
|
|
|
|
di, мкм |
0.426 |
0.376 |
0.326 |
0.276 |
0.226 |
23. При 20.0 °С плотность четырѐххлористого углерода равна 1.59 г/см3, поверхностное натяжение 26.95 мН/м, давление насыщенных паров (над плоской поверхностью) 11.50 кПа. Вычислить давление насыщенных паров над каплями с радиусами
0.1, 0.01, и 0.001 мкм.
24. Для препарата тонкодисперсного хлорида натрия определена удельная площадь поверхности 42.5 м2/г и измерена растворимость в этиловом спирте при 25 °С. Оказалось, что раствор пересыщен на 6.71 % по сравнению с растворимостью грубодисперсного NaCl. Вычислить межфазное натяжение NaCl/ C2H5OH, приняв, что препарат представляет собой монодисперсную систему сферических частиц.
25.Горизонтальная стеклянная трубка длиной 10 см соединена одним концом с содержимым широкой ѐмкости через еѐ стенку. Ёмкость наполнена водой (плотность 1.00 г/см3, вязкость 1.00 мПа с) на высоту 25 см выше трубки. Чтобы набрать 200 см3 воды через трубку требуется 60 с. Чему равен диаметр трубки ? Принять, что уровень воды в ѐмкости при вытекании этого объѐма практически не меняется.
26.В следующей ниже таблице приведены результаты определения концентрации насыщения (растворимости)
молекулярно-дисперсной кремниевой кислоты (в расчѐте на формулу SiO2) в монодисперсных золях кремнезѐма в зависимости
от их удельной поверхности. Вычислить по этим данным межфазное натяжение кремнезѐм/вода. Принять плотность кремнезѐма 2.2 г/см3. Температура 25 °С, частицы золя сферические.
S, м2/г |
300 |
344 |
427 |
511 |
537 |
|
|
|
|
|
|
c ×102, вес.% |
1.31 |
1.36 |
1.47 |
1.63 |
1.68 |
27. Сульфат стронция SrSO4 (плотность 3.96 г/см3) приготавливали в таких условиях, которые позволяли получать препараты с разными размерами частиц. Средний размер частиц в нескольких препаратах (d, в таблице ниже) измеряли с помощью электронной микроскопии и затем определяли их растворимость в воде при 25 С. В таблице ниже приведены степени пересыщения C/CS, в долях единицы, по отношению к растворимости CS грубодисперсного сульфата стронция.
d, Å |
96 |
130 |
155 |
168 |
252 |
378 |
500 |
|
|
|
|
|
|
|
|
C/CS |
1.55 |
1.41 |
1.32 |
1.33 |
1.18 |
1.11 |
1.08 |
Найдите по этим данным межфазное натяжение на границе фаз SrSO4/H2O в предположении сферической формы частиц.
28. Вычислить средневесовую и среднечисловую массу (по аналогии со средневесовой и среднечисловой молярными массами) для следующего распределения числа частиц золя по массе
Ni |
4 |
2 |
27 |
37 |
32 |
26 |
20 |
8 |
3 |
3 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
mi ×1012, г |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
29. Нефть течѐт из танкера через трубу длиной 15 м с внутренним диаметром 1.3 см. Перепад давления между концами трубы равен 4 атм. Чему равна объѐмная скорость течения, если вязкость нефти равна 0.40 Па с.

30. Вычислить среднечисловую и средневесовую молярную массу для следующего распределения полимера по молярным массам:
ni, моль |
3.0 |
8.0 |
11.0 |
17.0 |
9.0 |
1.0 |
|
|
|
|
|
|
|
Мi, кг/моль |
10.0 |
12.0 |
14.0 |
16.0 |
18.0 |
20.0 |
31. Плотности ацетона и воды при 20 °С равны 0.792 и 0.9982 г/см3 соответственно. Вязкость воды 1.002 мПа с. Если между двумя метками одного и того же капиллярного вискозиметра вода протекает за 120.5 с, а ацетон за 49.5 с, то чему равна вязкость ацетона ?
32. Вычислить среднечисловую, средневесовую и z-среднюю молярную массу для следующего распределения полимера по молярным массам
mi, г |
1.15 |
0.73 |
0.415 |
0.35 |
0.51 |
0.34 |
1.78 |
|
|
|
|
|
|
|
|
Мi, кг/моль |
12.5 |
20.5 |
24.0 |
32.0 |
39.0 |
45.0 |
63.5 |
33. В U-образной трубке, одно колено которой имеет внутренний радиус 1.00 мм, а другое 1.00 см, находится жидкость с плотностью 0.95 г/см3, ограниченно смачивающая стенки сосуда (cos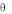 0). В более узком колене уровень мениска жидкости на 1.90 см выше, чем в более широком. Вычислить поверхностное натяжение жидкости, приняв радиус кривизны мениска равным радиусу трубки в каждом колене.
0). В более узком колене уровень мениска жидкости на 1.90 см выше, чем в более широком. Вычислить поверхностное натяжение жидкости, приняв радиус кривизны мениска равным радиусу трубки в каждом колене.
Тема 2: Адсорбция
101. По результатам измерений поверхностного натяжения растворов н-бутилового спирта в воде при 12.0 °С в зависимости от концентрации (таблица внизу, концентрация С в ммоль/л, поверхностное натяжение 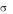 в мН/м) найдите предельную адсорбцию спирта
в мН/м) найдите предельную адсорбцию спирта 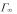 графическим методом, и вычислить площадь, занимаемую 1 молекулой спирта в насыщенном адсорбционном слое в предположении мономолекулярной адсорбции.
графическим методом, и вычислить площадь, занимаемую 1 молекулой спирта в насыщенном адсорбционном слое в предположении мономолекулярной адсорбции.
С |
0 |
3.2 |
4.8 |
6.4 |
8.5 |
13.0 |
16.9 |
26.0 |
33.8 |
51.0 |
67.5 |
102 |
135 |
203 |
74.2 73.0 73.1 72.0 71.3 71.3 70.1 68.0 65.8 63.1 60.7 56.9 53.8 48.9
102. При 25 °С поверхностное натяжение водных растворов пропионовой кислоты зависит от еѐ моляльности следующим образом:
с, моль/кг Н2О |
0.263 |
0.837 |
1.466 |
3.741 |
|
|
|
|
|
, мН/м |
60.0 |
49.0 |
44.0 |
36.0 |
Постройте график зависимости от lnc и определить из него избыточную поверхностную концентрацию . Найдите площадь, приходящуюся на одну молекулу кислоты.
103. Зная коэффициенты уравнения Шишковского (А = 4.65 10–2 моль/л, B = 0.167), постройте график изотермы поверхностного натяжения водных растворов масляной кислоты при 273 К в диапазоне концентраций от 0 до 0.1 моль/л.
Поверхностное натяжение воды при 273 К равно 75.5 10–3 Н/м. |
|
|
|
|
|
|||
104. Пользуясь графическим методом, определить поверхностную активность (-d |
/dC) при C |
0 масляной кислоты на |
||||||
границе ее водного раствора с воздухом при 293 К по следующим экспериментальным данным: |
|
|||||||
|
С, моль/л |
0 |
0.021 |
0.050 |
0.104 |
0.246 |
|
|
|
|
|
|
|
|
|
|
|
|
×103, Н/м |
72.5 |
68.1 |
63.7 |
58.2 |
49.8 |
|
|
105. Вычислить адсорбцию масляной кислоты на поверхности раздела водный раствор–воздух при 283 К и концентрации 0.104 моль/л, используя следующие экспериментальные данные:
С, моль/л |
0 |
0.021 |
0.050 |
0.104 |
0.246 |
0.489 |
|
|
|
|
|
|
|
×103, Н/м |
74.0 |
69.5 |
64.3 |
59.9 |
51.1 |
44.0 |
106.Смесь из 250 мл водного раствора метилового оранжевого с концентрацией 0.070 вес. % и 0.209 мл минерального масла встряхивали до образования эмульсии со средним диаметром капель масла 4.35 10–7 м. В результате адсорбции на
поверхности капель концентрация метилового оранжевого в растворе уменьшилась до 0.038 вес. %. Вычислить адсорбцию  красителя. Плотность раствора 0.9982 г/см3, формула метилоранжа: HO3S–С6Н4–N=N–C6H4–N(СН3)2.
красителя. Плотность раствора 0.9982 г/см3, формула метилоранжа: HO3S–С6Н4–N=N–C6H4–N(СН3)2.
107.Раствор пальмитиновой кислоты C16H32O2 в бензоле содержит 4.24 г/л кислоты. После нанесения раствора на
поверхность воды бензол испаряется и остающаяся пальмитиновая кислота образует мономолекулярную пленку. Какой объем раствора кислоты требуется, чтобы покрыть мономолекулярным слоем поверхность площадью 500 см2. Площадь молекулы пальмитиновой кислоты в монослое равна 0.205 нм2.
108.Вычислить площадь поверхности, приходящуюся на 1 молекулу стеариновой кислоты, и толщину мономолекулярной
пленки, покрывающей поверхность воды, если известно, что 1 мг стеариновой кислоты покрывает поверхность воды, равную 0.419 м2. Молярная масса кислоты равна 284.48, плотность 0.847 г/см3.
109.Коэффициенты уравнения Шишковского для водного раствора валериановой кислоты при 273 К составляют: А =
9.6210–2 моль/л, B = 0.195. При какой концентрации поверхностное натяжение раствора составляет 52.1 мН/м, если поверхностное натяжение воды при данной температуре равно 75.5 мН/м?
110.По результатам измерений поверхностного натяжения растворов н-амилового спирта в воде при 39.0 °С в зависимости
от концентрации (таблица внизу) найдите предельную адсорбцию спирта  графическим методом, и вычислить площадь, занимаемую 1 молекулой спирта в насыщенном адсорбционном слое в предположении мономолекулярной адсорбции.
графическим методом, и вычислить площадь, занимаемую 1 молекулой спирта в насыщенном адсорбционном слое в предположении мономолекулярной адсорбции.
С, ммоль/л |
0 |
1.25 |
2.50 |
3.70 |
4.90 |
7.40 |
9.8 |
14.7 |
19.6 |
29.4 |
|
|
|
|
|
|
|
|
|
|
|
, мН/м |
72.1 |
69.5 |
66.6 |
63.4 |
61.2 |
57.1 |
52.9 |
47.8 |
44.5 |
39.6 |
111. Стеариновая кислота, С17Н35СООН (не растворима в воде), имеет плотность 0.85 г/см3. Известно, что еѐ молекула имеет площадь поперечного сечения 0.205 нм2 в насыщенном мономолекулярном слое. Вычислить длину молекулы.
112. По результатам измерений поверхностного натяжения растворов н-гексилового спирта в воде при 12.0 °С в зависимости от концентрации (таблица внизу) найдите предельную адсорбцию спирта  графическим методом, и вычислить площадь, занимаемую 1 молекулой спирта в насыщенном адсорбционном слое.
графическим методом, и вычислить площадь, занимаемую 1 молекулой спирта в насыщенном адсорбционном слое.
С, ммоль/л |
0 |
0.62 |
0.81 |
1.25 |
1.72 |
2.50 |
3.43 |
4.90 |
6.86 |
9.80 |
|
|
|
|
|
|
|
|
|
|
|
, мН/м |
74.2 |
71.9 |
71.7 |
70.3 |
68.5 |
66.3 |
64.8 |
60.8 |
57.9 |
54.8 |
113.Из 5.19 ×10–5 г пальмитиновой кислоты (С15Н31СООН, не растворима в воде) приготовили разбавленный раствор в
бензоле и нанесли на поверхность воды. После испарения бензола оставшуюся плѐнку оказалось возможным сжать до площади 265 см2. Вычислить площадь, занимаемую одной молекулой в такой плѐнке.
114.По результатам измерений поверхностного натяжения растворов н-октилового спирта в воде при 39.0 °С в
зависимости от концентрации (таблица внизу) найдите предельную адсорбцию спирта  графическим методом, и вычислить площадь, занимаемую 1 молекулой спирта в насыщенном адсорбционном слое в предположении мономолекулярной адсорбции.
графическим методом, и вычислить площадь, занимаемую 1 молекулой спирта в насыщенном адсорбционном слое в предположении мономолекулярной адсорбции.
С, ммоль/л |
0 |
0.14 |
0.29 |
0.38 |
0.58 |
0.77 |
1.16 |
1.54 |
2.31 |
|
|
|
|
|
|
|
|
|
|
, мН/м |
70.1 |
68.9 |
65.9 |
62.8 |
61.0 |
55.8 |
51.1 |
45.9 |
40.5 |
115. При встряхивании смеси 0.175 см3 минерального масла с 250 см3 водного раствора конго с концентрацией 0.100 вес. % получена эмульсия с радиусом капель масла 4.35 10–7 м. Содержание конго в растворе уменьшилось на 0.045 г. Молярная масса конго равна 690 г/моль. Вычислить адсорбцию .

116. Следующая ниже таблица показывает зависимость поверхностного натяжения растворов н-гексилового спирта в воде от концентрации при 39.0 °С.
С, ммоль/л |
0 |
1.85 |
2.50 |
3.70 |
4.90 |
7.40 |
9.80 |
14.7 |
19.6 |
29.4 |
|
|
|
|
|
|
|
|
|
|
|
, мН/м |
70.1 |
66.8 |
65.1 |
62.5 |
60.4 |
56.8 |
53.3 |
49.3 |
45.4 |
38.7 |
Найдите предельную адсорбцию спирта  графическим методом, и вычислить площадь, занимаемую 1 молекулой спирта в насыщенном адсорбционном слое в предположении мономолекулярной адсорбции.
графическим методом, и вычислить площадь, занимаемую 1 молекулой спирта в насыщенном адсорбционном слое в предположении мономолекулярной адсорбции.
117. Гексадеканол, С16Н33ОН (не растворим в воде), иногда используется для покрытия поверхности резервуаров чтобы предотвратить испарение воды. Если площадь молекулы гексадеканола в насыщенном монослое составляет 0.20 нм2, то сколько грамм этого вещества потребуется чтобы покрыть мономолекулярной плѐнкой озеро площадью 10 акров (40000 м2) ?
118. По результатам измерений поверхностного натяжения растворов н-гептилового спирта в воде при 39.0 °С в зависимости от концентрации (таблица внизу) найдите предельную адсорбцию спирта  графическим методом, и вычислить площадь, занимаемую 1 молекулой спирта в насыщенном адсорбционном слое в предположении мономолекулярной адсорбции.
графическим методом, и вычислить площадь, занимаемую 1 молекулой спирта в насыщенном адсорбционном слое в предположении мономолекулярной адсорбции.
С, ммоль/л |
0 |
0.22 |
0.44 |
0.87 |
1.29 |
1.73 |
2.58 |
3.45 |
5.16 |
6.90 |
|
|
|
|
|
|
|
|
|
|
|
, мН/м |
70.1 |
69.5 |
68.1 |
65.3 |
62.0 |
60.0 |
55.9 |
52.1 |
46.4 |
41.5 |
119. При 273 К и соответствующем давлении 1 г активированного угля адсорбирует следующее количество азота:
р, кПа |
0.524 |
7.495 |
|
|
|
m×103, г |
1.234 |
12.89 |
Определить константы уравнения Лэнгмюра, а также степень заполнения поверхности угля при р = 3.0 кПа.
120. Определить константы уравнения Фрейндлиха при адсорбции СО коксовым углем по следующей зависимости адсорбции от парциального давления СО:
р, кПа |
1.34 |
2.50 |
4.25 |
5.71 |
7.18 |
8.90 |
|
|
|
|
|
|
|
n ×106, моль/г |
0.38 |
0.58 |
1.016 |
1.17 |
1.33 |
1.46 |
121. Определить графическим методом константы уравнения Фрѐйндлиха по следующей изотерме адсорбции азота на активированном угле:
р, Па |
2.90 |
5.0 |
11.0 |
14.0 |
20.0 |
|
|
|
|
|
|
n, моль/кг |
2.16 |
2.39 |
2.86 |
3.02 |
3.33 |
122. Методом БЭТ вычислить удельную поверхность адсорбента по изотерме адсорбции бензола на его поверхности. Площадь, занимаемая молекулой бензола, равна 49 10–20 м2.
р/рS |
0.024 |
0.08 |
0.14 |
0.2 |
0.27 |
0.35 |
0.46 |
|
|
|
|
|
|
|
|
n×103, моль/кг |
14.9 |
34.8 |
47.2 |
56.8 |
66.3 |
79.3 |
101 |

123.Используя уравнение Лэнгмюра, вычислить адсорбцию азота на цеолите при давлении р = 280 Па при ѐмкости мономолекулярного слоя nm = 1.39 10–3 моль/г и константе адсорбции KL = 1.56 10–3 Па–1.
124.По экспериментальным данным (таблица ниже) постройте изотерму адсорбции углекислого газа цеолитом при 293 К
иопределить константы уравнения Лэнгмюра графически. (р – давление; m – масса СО2 адсорбированного 1 г цеолита)
р×10–2, Па |
10.0 |
30.0 |
75.0 |
100.0 |
200.0 |
|
|
|
|
|
|
m×103, г |
112.0 |
152.0 |
174.0 |
178.0 |
188.0 |
125. По экспериментальным данным об адсорбции СO2 на активированном угле (см. таблицу ниже) определить константы уравнения Лэнгмюра, а также постройте график изотермы адсорбции. (В таблице: p – давление, m – масса СО2,
адсорбированного единицей массы угля) |
|
|
|
|
|
|
|
|
p×10–2, Па |
9.90 |
49.7 |
99.8 |
200.0 |
297.0 |
398.5 |
|
|
|
|
|
|
|
|
|
m×103, г/г |
32.0 |
70.0 |
91.0 |
102.0 |
107.3 |
108.0 |
126. В таблице ниже приведены экспериментальные данные по адсорбции криптона на силикагеле при температуре жидкого азота 77.8 К. Вычислить удельную площадь поверхности образца по методу БЭТ, приняв посадочную площадку криптона 21.5 Å2.
р/рS |
0.00058 |
0.0109 |
0.089 |
0.208 |
0.249 |
0.335 |
|
|
|
|
|
|
|
n, мкмоль/г |
66 |
182 |
357 |
482 |
515 |
573 |
127. Изучена адсорбция полистирола с молярной массой 300 кг/моль из толуола на активированном угле с удельной площадью поверхности 120 м2/г. Найдено, что адсорбция следует уравнению Лэнгмюра с адсорбционной ѐмкостью 33 мг полимера на грамм адсорбента. При концентрации 0.1 г/л адсорбция составляла 28 мг/г. Вычислить константу адсорбции Лэнгмюра и число адсорбированных молекул полимера, приходящееся на 1 м2 поверхности угля, при насыщенной адсорбционной ѐмкости.
128. Адсорбция красителей из растворов часто применяется для приблизительного определения удельной поверхности порошков. Предположим, в порции по 100 см3 раствора метиленового голубого с начальной концентрацией 1.00×10–4 моль/л вносят разные навески костного угля и определяют остающуюся концентрацию в растворе после достижения равновесия. При внесении навески 1 г конечная концентрация оказалась 6.0×10–5 моль/л, а при внесении 2 г – 4.0×10–5 моль/л. Известно, что площадь молекулы метиленового голубого в мономолекулярном слое равна 65 Å2. Вычислить удельную поверхность угля, предполагая справедливым уравнение Лэнгмюра.
129. Данные в следующей таблице описывают адсорбцию уксусной кислоты из еѐ раствора на древесном угле при 25 °С
С, моль/дм3 |
0.05 |
0.10 |
0.50 |
1.00 |
1.50 |
|
|
|
|
|
|
m*, г |
0.045 |
0.061 |
0.110 |
0.148 |
0.178 |
*m – масса кислоты, адсорбированной 1 граммом угля
Определить, какое уравнение – Лэнгмюра или Фрѐйндлиха – описывает эти данные лучше и найдите коэффициенты этого уравнения.
130. Следующие результаты получены при исследовании адсорбции диоксида углерода на 1 грамме древесного угля при 0 °С и разных давлениях СО2:
р, мм рт. ст. |
25.1 |
137.4 |
416.4 |
858.6 |
|
|
|
|
|
m, мг СО2 |
0.77 |
1.78 |
2.26 |
2.42 |
Предполагая, что изотерма Лэнгмюра применима в данном случае, определить максимальное количество СО2, адсорбируемое в мономолекулярном слое. Определить удельную площадь поверхность угля, приняв молекулу СО2 сферической с диаметром
0.35 нм.

131.При адсорбции азота на образце слюды при 90 К и давлениях газа 5.60 ×10–4 и 5.45 ×10–3 мм рт.ст. объѐмы адсорбированного газа (приведѐнные к нормальным условиям) составляли 1.082 ×10–6 и 1.769 ×10–6 м3 соответственно.
Предполагая, что в данном случае применима изотерма Лэнгмюра, вычислить (а) объѐм адсорбата при давлении 0.01 мм рт.ст. (б) площадь поверхности образца слюды, если посадочная площадь молекулы N2 составляет 15 Å2.
132.После перемешивания 1.000 г порошка костяного угля с 100 см3 раствора метиленового голубого с концентрацией 100 мкмоль/л равновесная концентрация последнего равна 60 мкмоль/л. Если навеску угля удвоить (2 г), равновесная концентрация
раствора становится равной 40 мкмоль/л. Вычислить удельную площадь поверхности угля, предполагая, что адсорбция следует уравнению Лэнгмюра. Принять площадь молекулы метиленового голубого в монослое равной 65 10–20 м2.
Тема: Седиментация
201. В цельном коровьем молоке среднеобъѐмный диаметр капель жира составляет от 2.9 до 4.4 мкм в зависимости от индивидуальных условий. Другие характеристики более постоянны : при 20 °С плотность жира 0.920 г/см3, плотность дисперсионной среды (снятого молока) 1.034 г/см3, вязкость 1.60 мПа с.
Предположим, цельное молоко с диаметром капель жира 4 мкм находится при 20 °С в прямоугольном картонном "пакете" высотой 15 см. В начальный момент времени капли распределены во высоте однородно. За какое время на поверхность молока всплывѐт 50 % жира, если все капли имеют одинаковый диаметр ? (Заметьте, в этих условиях время всплытия 50 % жира равно времени всплытия одной капли с половины высоты пакета)
202. Решите задачу 201 для молока с диаметром капель жира 3 мкм.
203. В гомогенизированном молоке диаметр капель жира составляет от 0.3 до 0.8 мкм в зависимости от давления гомогенизации и других условий. Предположим, речь идѐт о молоке с диаметром капель 0.4 мкм. Решите задачу 201 для этого диаметра, при прочих условиях тех же, что в 201.
204. В воде при 20 °С белок гамма-глобулин имеет константу седиментации 7.75 ×10–13 с, коэффициент диффузии 4.80 ×10–11 м2/с и удельный парциальный объѐм 0.739 см3/г. Вычислить молярную массу гамма-глобулина и радиус молекулы, предполагая сферическую форму. (Плотность воды 0.998 г/см3, вязкость 1.002 мПа с)
205. При наблюдении Броуновского движения частиц гуммигута в воде с интервалами времени наблюдения 60 секунд установлен средний квадратичный сдвиг 10.65 мкм. Частицы имеют шарообразную форму с радиусом 0.212 мкм, температура опыта 17 °С, вязкость воды 1.09 10–3 Па с. Вычислить по этим данным постоянную Авогадро NA, зная газовую постоянную R.
206. Из исследований фермента лизоцима в буферном водном растворе при 20 °С найден коэффициент седиментации 1.87 ×10–13 с, коэффициент диффузии 10.4 ×10–7 см2/с, и удельный парциальный объѐм 0.688 см3/г при плотности среды 1.00289 г/см3. Определить по этим данным молярную массу фермента.
207. Граница седиментации (граница между мутной и прозрачной частями раствора) сывороточного глобулина в фосфатном буферном растворе при 26 °С измерена как функция времени при числе оборотов центрифуги 44000 мин–1:
t, мин |
30 |
50 |
70 |
90 |
110 |
130 |
150 |
170 |
|
|
|
|
|
|
|
|
|
х*, см |
4.72 |
4.79 |
4.86 |
4.93 |
4.99 |
5.06 |
5.13 |
5.21 |
* х – расстояние от оси вращения
Определить по этим данным коэффициент седиментации, а также молярную массу белка, зная, что коэффициент диффузии равен 5.27 ×10–7 см2/с, удельный парциальный объѐм белка 0.745 см3/г, плотность буферного раствора 1.013 г/см3.
208. Фосфатидилхолины с малым молекулярным весом (встречаются, например, в яичном желтке) образуют в воде мицеллы сферической формы со средней молярной массой 97.0 кг/моль. Плотность сухого вещества 1.018 г/см3. Предполагая, что эта плотность применима к мицеллам в растворе, вычислить радиус и коэффициент диффузии мицелл при 20 °С в воде (вязкость 1.00 мПа с)
209.С какой скоростью осаждается в поле тяжести Земли аэрозоль хлорида аммония (плотность 1.527 103 кг/м3) с радиусом частиц 0.45 мкм? Вязкость воздуха принять равной 1.76 ×10–5 Па с, плотностью воздуха пренебречь.
210.Рассчитайте коэффициент диффузии шарообразных частиц дыма с радиусом 2.00 мкм при вязкости воздуха 1.7 ×10–5 Па с и температуре 283 К.
211. Вычислить средний радиус частиц глины, если скорость их оседания в воде равна 4 ×10–5 м/с, плотность глины 2 ×103 кг/м3, вязкость воды 1 ×10–3 Па с, плотность воды 1 ×103 кг/м3.
212. Граница седиментации (граница между мутной и прозрачной частями раствора) фермента в водном растворе при 20.6 °С наблюдалась как функция времени при числе оборотов центрифуги 56050 мин–1:
