
Физическая и коллоидная химия
.pdf101.Как перевести порошок в аэрозольное состояние? Что такое псевдоожижение и где оно осуществляется?
102.Как классифицируются эмульсии в зависимости от концентрации дисперсной фазы. Как определяется концентрация дисперсной фазы эмульсии?
103.Что такое прямые и обратные эмульсии? Как осуществляется обращение фаз эмульсии? Как определить тип эмульсии экспериментально ?
104.Связь устойчивости эмульсий с величиной межфазного натяжения.
105.Использование эмульсий в пищевой и парфюмерной промышленности.
106.ГЛБ и его применение при выборе ПАВ для стабилизации прямых и обратных эмульсий.
107.Какие факторы агрегативной устойчивости характерны для эмульсии? Что называется коалесценцией и гомогенизацией ?
108.В чем заключается принцип подбора и механизм действия порошков для стабилизации эмульсий ?
109.Классификация дифильных (амфифильных) ПАВ. Примеры синтетических и природных ПАВ.
110.Какие вещества и при каких условиях способны образовывать мицеллы в водном растворе ?
111.Гидрофобные взаимодействия и мицеллообразование.
112.Критическая концентрация мицеллообразования и факторы, влияющие на неѐ. Методы экспериментального определения ККМ.
113.Опишите образование мицелл как разделение фаз в пересыщенном растворе. Как объясняется существование ККМ в этой теории.
114.Опишите образование мицелл как равновесие ассоциации молекул в истинном растворе. Как объясняется существование ККМ в этой теории.
115.Механизм солюбилизации.
116.Моющие средства и моющее действие. Объяснение моющего действия мыла.
117.Роль коллоидных ПАВ в пищевой технологии.
118.Строение мицелл. Влияние мицеллообразования на пенообразующие и суспендирующие свойства коллоидных растворов ПАВ.
119.Изобразите схемы строения различных мицелл. От чего зависит их размер и форма.
120.Микроэмульсии. Роль энтропийного фактора в их образовании.
121.Высокомолекулярные соединения (ВМС) и их классификация. Примеры разных ВМС.
122.Химическая природа и строение макромолекул.
123.Конформации полимеров. Гибкость и жесткость полимерных цепей. Нативные конформации белков, денатурация.
124.Особенности растворов ВМС как лиофильных систем. По каким признакам растворы ВМС относятся к коллоидным системам?
125.Броуновское движение и диффузия полимеров в растворе.
126.Способы выражения молярной массы полидисперсных полимеров. Экспериментальные методы определения средних молярных масс.
127.Определение молярной массы ВМС методом измерения осмотического давления.
128.Применение рассеяния света для определения молярной массы полимеров в растворе.
129.Зависимость вязкости суспензии сферических частиц от концентрации.
130.Зависимость вязкости растворов полимеров от концентрации и конформации макромолекул.
131.Относительная, удельная, приведенная и характеристическая вязкость. Определение молярной массы полимера в растворе методом вискозиметрии.
132.Набухание полимеров в растворителях. Ограниченное и неограниченное набухание.
133.Кинетика набухания полимеров.
134.Термодинамика набухания полимеров.

135.Что называется контракцией и синерезисом ? Приведите примеры использования синерезиса в пищевой технологии.
136.Охарактеризуйте свойства белков как полиэлектролитов.
137.Почему и как может изменяться конформация белка и вязкость растворов белка при изменении рН среды?
138.Зависимость строения двойного электрического слоя полиэлектролитов от рН раствора. Электрофорез белков.
139.Изоэлектрическая и изоионная точки белка в растворе.
140.Высаливание полиэлектролитов. Зависимость от рН.
141.Мембранное равновесие Доннана.
З а д а ч и
Тема : основные законы термодинамики
1-5. Для вещества, указанного ниже при соответствующем номере задачи, вычислить стандартную энтальпию образования при 298 К ( fН°298), зная его стандартную энтальпию сгорания ( CН°), а так же вычислить стандартную энтальпию образования при 398 К, используя полученную величину f Н°298 и изобарные теплоѐмкости СР (смотри CН° в таблице 6.3 и СР в таблицах 6.3 и 6.4 приложения 6). Продукты сгорания CO2 (г), H2O (ж), N2 (г).
1. анилин С6Н7N (ж); 2. мочевина CH4ON2 (т); 3. ацетилен C2H2 (г); 4. нафталин C10H8 (т); 5. метан СН4 (г)
6-9. С помощью стандартных энтальпий образования и изобарных теплоѐмкостей в табл. 6.4 (приложение 6) вычислить стандартную энтальпию при 298 К и 398 К реакции, указанной в таблице ниже. Определить так же, насколько отличается стандартная внутренняя энергия U° этой реакции от Н°.
Задача Реакция
62Н2 (г) + СО (г) = CН3ОН (г)
72СO2 (г) = 2СO (г) + O2 (г)
8С2Н6 (г) = С2Н4 (г) + Н2 (г)
9C(т) + H2O (г) = CO (г) + H2 (г)
10.С помощью стандартных теплот сгорания (табл. 6.3 приложение 6) вычислить тепловой эффект при 298 К реакции разложения глюкозы C6H12O6 (т) = 2C2H5OH (ж) + 2CO2 (г) при постоянном давлении ( H) и постоянном объѐме ( U).
11. Не прибегая к справочным данным, вычислить разницу между энтальпией H и внутренней энергией U реакции гидрогенизации СН3СНО (т) + Н2 (г) = С2Н5OН (ж) при 298 К. Сделайте аналогичное вычисление для реакции СН3СНО (т) + Н2
(г) = С2Н5OН (г) при 400 К.
12. Определить энтальпию реакции CH4 (г) + Cl2 (г) = CH3Cl (г) + HCl (г), зная энтальпии следующих реакций :
CH3Cl (г) + 3/2O2 (г) = CO2 (г) + H2O(ж) + HCl (г) H° = – 687.0 кДж/моль
H2 (г) + 1/2O2 (г) = H2O (ж) |
H° = – 286 кДж/моль |
|||
1/2H2 (г) + 1/2Cl2 (г) = HCl (г) |
H° = – 92.5 кДж/моль |
|||
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(ж) |
H° = 890.8 кДж/моль |
|||
13. Определить энтальпию реакции Fe (т) + Cl2 (г) = FeCl2 (т), зная энтальпии следующих реакций : |
||||
Fe (т) + 2HCl (aq) = FeCl2(aq) + H2 (г) |
H° = – 88.0 кДж/моль |
|||
FeCl2 (т) = FeCl2 (aq) |
|
|
H° = – 81.7 кДж/моль |
|
HCl (г) = HCl (aq) |
|
|
H° = – 73.3 кДж/моль |
|
H2 (г) + Cl2 (г) = 2HCl (г) |
|
H° = – 184.4 кДж/моль |
||
14. Стандартная энтальпия образования NH3 (г) при 298 К равна 45.94 кДж/моль. Вычислить стандартную энтальпию |
||||
образования NH3 (г) при 598 К, зная следующие данные о теплоѐмкостях (Дж моль–1 К–1): |
||||
NH3 (г): |
CP = |
26.14 |
+ 33.0·10–3T |
– 3.043·10–6T2 |
N2 (г): |
CP = |
26.98 |
+ 5.91·10–3T |
– 0.338·10–6T2 |
H2 (г): |
CP = 29.07 – 0.836·10–3T + 2.011·10–6T2 |
|||
15.На основании средних энтальпий связей (таблица 6.5 приложения 6) оцените энтальпию изомеризации этилового спирта в диметиловый эфир СН3СН2OН (г) = СН3ОСН3 (г).
16.Вычислить энтальпию реакции С2Н4 (г) + Н2O (г) = С2Н5ОН (г) двумя способами : 1) с помощью энтальпий связей (табл. 6.5 приложение 6) и 2) стандартных энтальпий образования (табл. 6.4 приложение 6). На сколько результаты вычислений различаются ?

17-24. С помощью стандартных энтальпий образования и стандартных энтропий при 25 °С (табл. 6.4, приложение 6) вычислить стандартные величины энтальпии, внутренней энергии, энергии Гиббса и энергии Гельмгольца реакции, указанной в таблице ниже, при той же температуре. Определить, в каком направлении пойдѐт реакция, в прямом или обратном.
Задача |
Реакция |
Задача |
Реакция |
17 |
2Н2 (г) + СО (г) = СН3ОН (г) |
21 |
4НСl (г) + O2 (г) = 2Н2О (ж) + 2Сl2 (г) |
18 |
SO2 (г) + Cl2 (г) = SO2Cl2 (г) |
22 |
CO2 (г) + 4H2 (г) = CH4 (г) + 2H2O (г) |
19 |
C2H6 (г) = С2Н4 (г) + Н2 (г) |
23 |
CH4 (г) + CO2 (г) = 2CO (г) + 2H2 (г) |
20 |
2SO2 (г) + O2 (г) = 2SO3 (г) |
24 |
CO (г) + 3H2 (г) = CH4 (г) + H2O (г) |
25-28. Зная стандартные энергии Гиббса образования веществ при 25 °С (табл. 6.6, приложение 6) вычислить энергию Гиббса и энергию Гельмгольца реакции, указанной в следующей таблице. Определить, в каком направлении пойдѐт реакция, в прямом или обратном.
Задача Реакция
252НСl(г) = Н2 (г) + Сl2 (г)
262СO2 (г) = 2СО (г) + O2 (г)
27MgCO3 (т) = MgO (т) + CO2 (г)
28Fе3O4 (т) + 4Н2(г) = ЗFе(т) + 4Н2O (г)
29.Вычислить энтропию смешения при постоянной температуре 1 моля газа О2 и 2 молей газа N2 , находящихся в отдельных сосудах, первоначально разделѐнных перегородкой. Объѐм сосуда с О2 1 л, объѐм сосуда с N2 2 л.
30.Вычислить изменение энтропии при нагревании 5.29 г азота N2 от 0 до 120 °С при постоянном объѐме, рассматривая азот как идеальный газ с теплоѐмкостью СV = 7R/2.
31.Вычислить энтропию испарения 0.811 молей муравьиной кислоты, если еѐ температура кипения 100.7 °С, а теплота испарения 46.1 кДж/моль.
32.Определить изменение энтальпии, внутренней энергии и энтропии при переходе 1.00 кг жидкой воды, взятой при p1 = 1.0133 105 Па и T1 = 298 К, в пар при p2 = 0.3123 105 Па и нормальной температуре кипения 373 К, зная среднюю изобарную теплоѐмкость жидкой воды 75.4 Дж/(моль К) и теплоту испарения 40.67 кДж/моль при 373 К. Примите, что пар имеет свойства идеального газа.
33.20.6 кг азота N2 и 32.0 кг кислорода О2 в газообразном состоянии находятся первоначально в двух отдельных сосудах с равными объѐмами. Найти энтропию изотермического смешения этих газов при соединении сосудов.
Тема : химические и фазовые равновесия
101-104. Константа равновесия KC реакции Н2 (г) + I2 (г) = 2НI (г) при 693 К равна 50. Будет ли происходить прямая реакция (образование иодида водорода) или обратная (разложение иодида водорода), если исходные концентрации партнеров реакции равны величинам, указанным в следующей таблице ?
Задача № |
[H2], моль/л |
[I2], моль/л |
[HI], моль/л |
|
|
|
|
101 |
2 |
5 |
10 |
102 |
3/2 |
¼ |
5 |
103 |
1 |
2 |
10 |
104 |
½ |
3/2 |
5 |
105.Стандартная энергия Гиббса реакции СО (г) + Н2О (г) = СО2 (г) + Н2 (г) равна –25.5 кДж/моль при 373 К. Вычислить константу равновесия этой реакции, а так же обратной реакции СО2 (г) + Н2 (г) = СО (г) + Н2О (г).
106.Вычислить энергию Гиббса реакции 2Fe (т) + O2 (г) = 2FeO (т) при 1000 К и начальном давлении кислорода 0.200 атм, если известна константа равновесия этой реакции 2.45×1020 атм–1 при этой температуре.
107-110. Определить константы равновесия КР и КС при 300 К для реакции, указанной в таблице ниже, зная равновесное общее давление газообразных партнеров А, В, и Z 8.0×104 Па и равновесное количество продукта Z, указанное в таблице (nZ). Начальные количества молей реагентов А и В равны соответствующим стехиометрическим коэффициентам, начальное количество продукта Z равно 0.

Задача № |
Реакция |
nZ, моль |
|
|
|
107 |
2A+1/2B = 2Z |
0.50 |
108 |
А + В = 1/2Z |
0.45 |
109 |
3A + 1/2B = Z |
0.20 |
110 |
2А + 3В = 2Z |
0.10 |
|
|
|
111.Зависимость константы равновесия N2O4 (г) 2NO2 (г) от температуры выражается уравнением lgK = a/T + blgT + cT + d с коэффициентами а = –2692 К, b = 1.750, c = –4.83×10–3 K–1, d = 1.943. Вычислить константу равновесия и энтальпию этой реакции при 400 К.
112.Степень диссоциации SO2Cl2(г) SO2(г) + Cl2(г) равна 0.2342 при 30 °С и давлении партнеров реакции 0.50 атм. Вычислить константу равновесия КР.
113. |
Вычислить стандартную энергию Гиббса реакции N2O3 (г) NO2 (г) + NO (г) при 25 °С, если известно, что при этой |
|||
температуре и общем давлении партнеров реакции 1 атм равновесная степень диссоциации равна 0.30. |
||||
114. |
Константа равновесия Н2 (г) + I2 (г) |
2HI (г) равна 50.0 при 448 °С и 66.9 при 350 °С. Вычислить энтальпию этой |
||
реакции. |
|
|
|
|
115. |
Для равновесия FeO (т) + CO (г) |
Fe (т) + CO2 (г) известна константа КР 0.900 при 600 °С и 0.396 при 1000 °С. |
||
Вычислить |
G° , |
Н° и S° при 600 °С, а так же мольную долю СО2 в газовой фазе при 600 °С. |
||
116. |
Вычислить константу КС равновесия 2А (г) 2Z (г) + Y (г) если известно, что при введении в реактор объѐмом 5 дм3 |
|||
вещества А в количестве 4 моля остаѐтся 1 моль А в равновесии с Z и Y. |
||||
117. |
Ионное произведение воды KW = [H+][OH–] равно 1.00×10–14 моль2 дм–6 при 25.0 °С и 1.45×10–14 моль2 дм–6 при 30.0 °С. |
|||
Вычислить |
Н° и |
S° диссоциации Н2О = Н+ + ОН–, а так же KW при физиологической температуре 37 °С. |
||
118. Стандартная энергия Гиббса образования озона при 400 К равна 163.2 кДж моль–1. Вычислить константу равновесия 2О3 (г) 3О2 (г) при этой температуре.
119. Определить теплоту испарения жидкого хлороформа СHCl3 графическим методом по зависимости давления его пара
от температуры : |
|
|
|
|
|
|
|
, °С |
20 |
30 |
40 |
50 |
60 |
|
|
|
|
|
|
|
|
р, Па |
21465 |
33065 |
49198 |
71309 |
100663 |
120.При нормальном давлении висмут Bi плавится при 271.4 °С. Плотность твѐрдого висмута равна 9.80 г/см3, а жидкого
10.27г/см3. Вычислить температуру (°С) плавления висмута при давлении 21.72×105 Па, зная теплоту плавления 11.0 кДж/моль.
121.На сколько изменится температура плавления бензола С6Н6 при увеличении давления до 11.44×105 Па, если при нормальном давлении она равна 5.53 °С, теплота плавления 126.0 кДж/кг, разность удельных объѐмов жидкого и твѐрдого бензола 1.301×10–2 см3/г ?
122.Превращение ромбической формы NH4NО3 в ромбоэдрическую при 32.2 °С сопровождается поглощением 21.2 кДж/кг. Плотность при этом уменьшается от 1.725 до 1.66 г/см3. Вычислить производную dТ/dp (в К/Па) для этого превращения.
123.Как известно, температура кипения воды при нормальном давлении равна 100 °С. Вычислить температуру (°С) кипения воды при давлении, в 2 раза большем нормального, приняв постоянную теплоту испарения 40.4 кДж/моль.
124.Температура плавления I2 равна 113.5 °C. Увеличение давления пара при увеличении температуры на 1 К равно 580 Па. Рассчитайте теплоту сублимации йода при температуре плавления, если давление насыщенного пара I2 при этой температуре равно 11.85 кПа.
125.Давление пара метилового спирта при 20 °С равно 11.8 кПа, а при 40 °С 32.5 кПа. Определить молярную теплоту испарения.
126.Твѐрдый СО2 (сухой лѐд) имеет равновесное давление пара 1.0 атм при –72.2 °С и 2.0 атм при –69.1 °С. Вычислить теплоту сублимации.

127.При 9.3 °С давление насыщенного пара над жидким бромом равно 100 мм рт. ст. Теплота испарения 30910 Дж/моль. Вычислить температуру кипения при нормальном давлении (760 мм рт. ст).
128.В Денвере (высокогорный город в штате Колорадо) обычное (среднее) барометрическое давление составляет 82.7 кПа,
вотличие от нормального давления 101.325 кПа. Вычислить температуру, при которой вода кипит в этом городе, зная теплоту испарения 40.67 кДж/моль при 100 °С .
129.Дана следующая температурная зависимость давления пара в равновесии с жидким аммиаком:
, °С |
4.7 |
25.7 |
50.1 |
78.9 |
|
|
|
|
|
р, атм |
5 |
10 |
20 |
40 |
Определить теплоту испарения и температуру кипения графическим методом.
130.Вычислить температуру и давление пара а тройной точке йода I2 по следующим данным : температура кипения при нормальном давлении 183.0 °С, давление пара жидкого I2 13.33 кПа при 116.5 °С, теплота плавления 15.65 кДж/моль, давление пара над твѐрдым I2 0.1333 кПа при 38.7 °С.
131.При нормальном давлении лѐд Н2О плавится при 273.15 К, плотность льда 0.92 г/см3, плотность жидкости 1.00 г/см3, теплота плавления 6.009 кДж/моль. Какова температура плавления льда при давлении в 50 раз большем нормального (то есть
50 атм) ?
132.Давление пара над твѐрдым бензолом С6Н6 равно 299 Па при –30.0 °С и 3270 Па при 0 °С. Давление пара над жидким С6Н6 равно 6170 Па при 10.0 °С и 15800 Па при 30.0 °С. Вычислить теплоту сублимации, теплоту испарения, теплоту плавления
итемпературу тройной точки бензола.
133.Пропиловый спирт показывает следующую зависимость давления насыщенного пара от температуры:
, °С |
40 |
60 |
80 |
100 |
|
|
|
|
|
р, кПа |
6.69 |
19.6 |
50.1 |
112.3 |
Определить теплоту испарения и температуру кипения графическим методом.
134.Давление насыщенного пара фторида урана UF6 описывается уравнением lnp = 29.411 – 5893.5/Т над твѐрдой фазой и lnp = 22.254 – 3479.9/Т над жидкой фазой (р в паскалях, Т в кельвинах). Вычислить температуру и давление в тройной точке.
135.Теплоты испарения и плавления воды при 0 °С равны 2490 Дж/г и 333.5 Дж/г, соответственно. Давление пара при той же температуре равно 611 Па. Вычислить давление пара при –15 °С, предполагая что указанные теплоты остаются неизменными при –15 °С.
Те м а : ра с т в о р ы н е э л е к т ро л и т ов
201.При 35 °С давление пара чистого ацетона C3H6O равно 45.9 кПа, давление пара чистого хлороформа СHCl3 39.08 кПа. Парциальное давление паров этих компонентов над раствором C3H6O–СHCl3 с мольной долей СHCl3 0.36 равно соответственно
26.77и 9.64 кПа. Вычислить коэффициенты активностей компонентов в растворе.
202.Давление пара чистой воды при 40 °С равно 7.3759 кПа. Вычислить давление пара Н2О в равновесии с раствором, содержащем 110 г глицерина С3H8O3 и 401 г H2O, в предположении идеальности раствора.
203. Каким должно быть содержание глицерина С3Н8О3 в водном растворе, чтобы давление пара Н2О было на 2 % ниже давления пара чистой воды при той же температуре ?
204.Вычислить давление пара Н2О при 100 °С в равновесии с водным раствором, содержащем 5.00 вес % сахарозы C12H22О11. Вычислить так же содержание глицерина С3Н8О3 в растворе С3Н8О3-Н2О, имеющем то же давление пара Н2О при той же температуре.
205.Раствор, приготовленный из 0.524 г сахарозы C12H22О11 и 75 г воды, замерзает при температуре, которая на 0.038 К ниже температуры замерзания воды. Определить криоскопическую постоянную воды.
206.Сколько грамм олова требуется растворить в 50.0 г ртути, чтобы давление паров Hg снизилось от 94637 до 93275 Па?
207.Равновесное давление пара Н2О над раствором, содержащим 13.0 г нелетучего вещества и 100 г воды, равно 3.65 кПа. Рассчитайте молярную массу растворѐнного вещества, полагая раствор идеальным. Давление насыщенного пара чистой воды при данной температуре равно 3.74 кПа.

208.В 1000 г воды растворено 68.4 г сахарозы C12H22О11. Плотность раствора при 20 °С равна 1.024 г/см3. Давление насыщенного пара чистой воды равно 2.31 кПа при 20 °С. Определить: а) давление насыщенного пара Н2О над раствором; б) осмотическое давление раствора.
209.Рассчитайте эбулиоскопическую константу воды (температура кипения 100 °С), если удельная теплота испарения равна 2258.10 кДж/кг.
210-213. В следующей таблице приведены величины давления насыщенного пара воды (pw) и органических веществ (p) при нормальном общем давлении и температуре 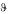 °С, указанной в таблице. Эти органические вещества практически не смешиваются с водой в жидкой фазе. Вычислить для своего номера задачи массу органического вещества, которая перегоняется с 1 кг водяного пара при указанной температуре.
°С, указанной в таблице. Эти органические вещества практически не смешиваются с водой в жидкой фазе. Вычислить для своего номера задачи массу органического вещества, которая перегоняется с 1 кг водяного пара при указанной температуре.
задача |
°С |
pw , кПа |
вещество |
p , кПа |
|
|
|
|
|
210 |
99.0 |
97.33 |
нитробензол C6H5NO2 |
3.59 |
211 |
95.25 |
85.197 |
бромбензол C6H5Br |
16.132 |
212 |
95.0 |
84.50 |
нафталин C10H8 |
2.06 |
213 |
99.0 |
97.73 |
камфара C10H16O |
3.6 |
214.При 25 °С давление насыщенного пара тетрахлорида углерода ССl4 равно 19.066 кПа, а хлороформа СНСl3 26.53 кПа. Жидкие смеси этих веществ имеют свойства, близкие к идеальным. Вычислить общее давление паров ССl4 и СНСl3 и мольную долю ССl4 в газовой фазе над раствором, содержащим 1 моль ССl4 и 3 моля СНСl3.
215.Этанол и метанол образуют почти идеальные растворы. При 20 °С давление пара чистого этанола равно 5.933 кПа, а чистого метанола 11.826 кПа. Рассчитайте: а) мольные доли метанола и этанола в растворе, содержащем по 100 г каждого компонента; б) парциальные давления компонентов и общее давление пара над этим раствором; в) мольную долю метанола в газовой фазе.
216.Температура плавления фенола равна 40.8 °С. Раствор, содержащий 0.172 г ацетанилида C8H9ON и 12.54 г фенола, замерзает при 39.8 °С. Вычислить молярную теплоту плавления фенола.
217.При температуре 27 °С осмотическое давление раствора сахара в воде равно 1.064 105 Па. Определить осмотическое давление этого раствора при 0 °С. (Пренебрегите влиянием температуры на плотность раствора)
218.При 25 °С давление пара воды равно 3.1672 кПа. Чему равно давление пара воды над раствором, содержащем 10.0 г мочевины (NH2)2CO и 200 г H2O.
219.Водный раствор этилового спирта, содержащий 8.74 г спирта на 1000 г H2O, замерзает при –0.354 °С. Определить молярную массу спирта в этом растворе, приняв его идеальным. Криоскопическая постоянная воды равна 1.86 К кг моль–1.
220.Раствор, содержащий 1.632 г трихлоруксусной кислоты СCl3COOH и 100 г бензола С6Н6, отвердевает при температуре, которая на 0.350 K ниже температуры замерзания чистого С6Н6. Определить молярную массу растворѐнного
вещества и сравните еѐ с молярной массой СCl3COOH. Сделайте вывод, имеет ли место диссоциация или ассоциация СCl3COOH в бензоле? Криоскопическая постоянная С6Н6 равна 5.12 К кг моль–1.
221.Сколько грамм сахарозы C12H22О11 должно быть растворено в 90 г воды, чтобы получился раствор, относительная равновесная влажность воздуха над которым составляет 95 % ? Примите свойства раствора идеальными.
222.Два грамма бензойной кислоты С6Н5СООН, растворѐнных в 25.0 г бензола, приводят к понижению температуры замерзания на 1.62 К. Зная криоскопическую постоянную бензола 4.90 К кг/моль, вычислить молярную массу бензойной кислоты в растворе. Сравните еѐ с молярной массой, вычисленной из формулы С6Н5СООН.
223.Двухатомный спирт этиленгликоль, С2Н4(ОН)2, в смеси с водой используется повсеместно как автомобильный антифриз. Вычислить температуру замерзания (°С) растворов, содержащих 10, 20, 30, 40, 50 и 60 вес. % С2Н4(ОН)2, исходя из теплоты плавления Н2О (льда) 6009.5 Дж/моль и в предположении идеальности растворов. По результатам вычислений начертите график зависимости температуры замерзания от содержания С2Н4(ОН)2. (Примечание: коммерческие антифризы на основе С2Н4(ОН)2 содержат дополнительные добавки, из-за чего их температура замерзания несколько ниже, чем в чистых смесях С2Н4(ОН)2-Н2О)
224.При растворении 3.00 г некоторого вещества в 100 г тетрахлорида углерода CCl4 температура кипения повышается на
0.60К. Вычислить понижение температуры замерзания, молярную массу растворѐнного вещества, относительное снижение
давления насыщенного пара CCl4 (ро – р)/ро и осмотическое давление раствора при 25 °С, если для растворителя известна
криоскопическая постоянная 31.8 К·кг/моль и эбулиоскопическая постоянная 5.03 К·кг/моль. Примите раствор идеальным и его плотность при 25 °С равной плотности чистого CCl4 1.59 г/см3.
225.Вычислить осмотическое давление водного раствора, содержащего 6.02 г мочевины (NH2)2CO в 1.00 л, при 27 °С.
226.В стеклянной цилиндрической трубке с площадью поперечного сечения 1.00 см2 один конец закрыт полупроницаемой мембраной. В трубку поместили навеску 1.14 г глюкозы С6Н12О6 (мол. масса 180.16 г/моль) и погрузили еѐ вертикально в воду

при 25 °С закрытым концом так, что вода имеет возможность проникать через мембрану и растворять глюкозу, но глюкоза не может переходить за пределы трубки. Чему равна высота столба раствора в трубке после достижения равновесия ? (Примите глубину погружения трубки в воду пренебрежимо малой и плотность раствора в трубке равной 1.00 г/см3). Чему равно осмотическое давление раствора и его концентрация в единицах г/л ?
Тема : растворы электролитов и гальванические элементы
301.Молярная электрическая проводимость водного раствора уксусной кислоты при 25 °С равна 4.815×10–3 См м2/моль при концентрации 1.02 ммоль/л и 39.06×10–3 См м2/моль при бесконечном разбавлении. Вычислить константу кислотной диссоциации и степень диссоциации уксусной кислоты при этой концентрации.
302.Вычислить молярную электрическую проводимость раствора 4.41×10–2 моль/л СН3СООН ион 25 °С, если известно, что его проводимость при бесконечном разбавлении равна 3.91×10–2 См м2/моль, константа кислотной диссоциации СН3СООН равна 1.8×10–5. Коэффициенты активности примите равными 1.
303.Вычислить ионную силу раствора, содержащего 1 ммоль H2SO4 и 2 ммоль MgSO4 на 1000 г воды.
304.Вычислить средние ионные коэффициенты активности хлорида натрия в растворах 0.01 и 0.001 моль/л NaCl при 25 °С
исравните их с опытными : ± (0.01 моль/л NaCl) = 0.909; ± (0.001 моль/л NaCl) = 0.967. Примите произведение Bå в уравнении Дебая Хюккеля равным 1 (л/моль)1/2.
305.При бесконечном разбавлении молярная электрическая проводимость пикрата калия (тринитрофенолят калия; 1-1 электролит) при 25 °С равна 10.397 10–3 См м2 моль–1, проводимость К+ 7.358 10–3 См м2 моль–1. Вычислить молярную проводимость пикрат-иона, его подвижность и число переноса.
306.Водный раствор LiX (где Х – анион) с концентрацией 0.100 моль/л имеет удельную электрическую проводимость 0.895 См м–1. Молярная электрическая проводимость Li+ равна 3.95 10–3 См м2 моль–1. Вычислить молярную проводимость раствора и молярную электрическую проводимость иона X–.
307.Вычислить степень диссоциации уксусной кислоты в растворе 6.71 10–4 моль/л СН3СООН, а так же рН раствора. Константа кислотной диссоциации СН3СООН равна 1.75 10–5.
308.В растворе NH4Cl число переноса хлорид иона равно 0.491. Определить подвижность и предельную проводимость катиона, если предельная проводимость хлорида аммония равна 14.9 10–3 См м2 моль–1.
309. Вычислить произведение растворимости Аg2СrО4, если |
его растворимость в воде равна 1.04 10–4 моль/л при 25 °С. |
Равновесие растворимости хромата серебра: Ag2CrO4 (т) 2Ag+ (aq) + |
СrО42– (aq). |
310.Раствор KCl имеет удельную электрическую проводимость 0.14088 См/м. Электрическое сопротивление кондуктометрической ячейки, наполненной этим раствором, равно 4.2156 Ом. Чему равна константа ячейки ? Чему равна удельная проводимость раствора НСl, имеющего сопротивление 1.0326 Ом в этой ячейке ?
311.Электрическая подвижность иона NH4+ равна 7.623×10–8 м2/(В·с). Вычислить 1) молярную проводимость иона, 2) скорость движения иона в кондуктометрической ячейке с разностью потенциалов электродов 15.0 В и расстоянием между ними
25.0см, 3) число переноса иона аммония в растворе ацетата аммония NH4C2H3O2, если подвижность ацетат иона равна
4.239×10–8 м2/(В·с).
312.Вычислить подвижность и скорость движения катиона лития в растворе LiCl, если известно, что его число переноса
равно 0.336, разность потенциалов электродов 6.0 В и расстояние между ними 4.00 см. Предельная молярная проводимость
LiCl равна 1.1503×10–2 См м2 моль–1.
313.При 18 °С молярная проводимость KNO3 в водном растворе зависит от концентрации следующим образом:
С, ммоль/л |
0.20 |
0.50 |
1.00 |
2.00 |
5.00 |
|
|
|
|
|
|
×104, См м2 моль–1 |
125.2 |
124.5 |
123.7 |
122.6 |
120.5 |
Определить предельную молярную проводимость KNO3 графическим методом.
314. Определить предельную молярную проводимость HCl по следующим данным о зависимости проводимости растворов HCl от концентрации:
С, ммоль/л |
2.8408 |
8.1181 |
17.743 |
31.863 |
|
|
|
|
|
×104, См м2 моль–1 |
425.13 |
424.67 |
424.07 |
423.55 |

315. При 25 °С электролиты C6H5COONa (бензоат натрия), HCl и NaCl имеют следующие предельные молярные проводимости (См м2 моль–1): 0.008248, 0.042616 и 0.012645, соответственно. Вычислить на этом основании предельную молярную проводимость бензойной кислоты (C6H5COOН).
316. Удельная электрическая проводимость насыщенного раствора BaSO4 равна 3.48×10–4 См/м, а растворителя (воды) 0.50×10–4 См/м. Вычислить произведение растворимости этой соли, приняв молярную проводимость BaSO4 в насыщенном растворе равной предельной проводимости (предельные проводимости ионов Ba2+ и SO42– равны 0.012726 и 0.016004 См м2 моль–1, соответственно).
317. С применением уравнения Дебая-Хюккеля вычислить степень диссоциации 0.247 моляльной уксусной кислоты при 25 °С (К = 1.75×10–5) в 1.00 ×10–2 моляльном растворе Ca(NO3)2. Примите произведение Вå в этом уравнении равным 1 (л/моль)1/2.
318. При 25 °С произведение растворимости хлорида серебра AgCl равно 1.56×10–10. Вычислить его растворимость в чистой воде и в 0.0500 моляльном растворе KNO3. Примите произведение Вå в уравнении Дебая-Хюккеля равным 1 (л/моль)1/2.
319. С применением уравнения Дебая-Хюккеля рассчитайте произведение растворимости оксалата магния MgC2O4 в воде, зная его растворимость при 298 К 0.075 г/дм3. Примите Вå в уравнении Дебая-Хюккеля равным 1 (л/моль)1/2.
320. При 298 К растворимость йодата лантана La(IO3)3 в воде равна 1.7 г/дм3. Чему равно произведение растворимости этой соли ? Примите Вå в уравнении Дебая-Хюккеля равным 1 (л/моль)1/2.
321. Реакция Zn(т) + 2AgCl(т) = ZnCl2(aq) + 2Ag(т) характеризуется величиной ЭДС 1.015 В и температурным коэффициентом d /dT = –4.012 10–4 В/К при 0 °С. Вычислить изменение термодинамических функций G, H, S.
322.Вычислить изменение термодинамических функций G, H, S для реакции в водной среде Ag(т) + 1/2Hg2Cl2(т) = AgCl(т) + Hg(ж) при 25 °С, если известна еѐ ЭДС 0.0455 В и температурный коэффициент d /dT = 0.68 мВ/К.
323.Стандартная ЭДС элемента
PtI(т) |
Zn(т) |
ZnSO4 (aq) |
|
CuSO4 (aq) |
Сu(т) |
PtII(т) |
|
|
|
|
|
|
|
равна 1.100 В. Вычислить ЭДС аналогичной цепи при 25 °С, в которой концентрация CuSO4 равна 2.50×10–4 моль/л, a ZnSO4 – 2.50×10–2 моль/л. (Для раствора CuSO4 коэффициент активности принять равным 1; эффективный радиус Zn2+ равен 6 Å)
324. Вычислить максимальную работу следующего гальванического элемента со стандартной ЭДС 1.100 В.
Сu(т) |
Zn(т) |
ZnSO4 (aq) |
|
CuSO4 (aq) |
Сu(т) |
|
|
|
|
|
|
|
|
1.000 моль/л |
|
1.000 моль/л |
|
325. ЭДС следующей ячейки равна 0.082 В. Определить рН желудочного сока.
PtI(т) |
Н2(f = 1) |
H+ (желудочный сок) |
|
H+ (aq, a = 1) |
Н2(f = 1) |
PtII(т) |
|
|
|
|
|
|
|
326. Определить растворимость хлорида серебра в воде при 50 °С, если при этой температуре ЭДС гальванического элемента
Ag(т) |
AgCl(т) |
AgCl (aq) |
|
AgNO3 (aq, 0.05 моль/л) |
Ag(т) |
|
|
|
|
|
|
равна 0.199 В. При 50 °С параметры уравнения Дебая-Хюккеля: А = 0.5373 л1/2 моль–1/2, В = 0.3346 л1/2 моль–1/2 Å–1, å(Ag+) =
2.5Å.
327. Вычислить ЭДС следующего элемента при 25 °С, зная, что произведение растворимости AgCl = 1.77×10–10, a AgBr =
5.35×10–13:
Ag(т) |
AgBr(т) |
AgBr (aq) |
|
AgCl (aq) |
AgCl(т) |
Ag(т) |
|
|
|
|
|
|
|
328. Для электрохимической ячейки
Pt (т) |Zn(т) | Zn2+ (aq, a = 1) || Cu2+ (aq, a = 1) | Сu(т) | Pt (т)

со стандартным ЭДС 1.100 В при 25 °С написать уравнение протекающей в ней реакции и вычислить константу равновесия. 329. Определить ЭДС элемента при 25°С
СКЭ |
|
СН3СООН(aq, 0.445 моль/л) |
хингидрон (т) |
Pt(т) |
|
|
|
|
|
где СКЭ – стандартный каломельный электрод, потенциал которого равен 0.268 В. Стандартный потенциал хингидронного электрода равен 0.699 В, константа диссоциации уксусной кислоты K = 1.75×10–5. (Эффективный радиус H+ равен 9 Å, ацетат иона 4.5 Å)
330. Зная стандартный потенциал хингидронного электрода 0.699 В, определить ЭДС элемента:
PtI(т) Н2(f = 2.00) H+ (aq, а = 1.31×10–5) 
 H+ (aq, a = 1.132) хингидрон (т) PtII(т)
H+ (aq, a = 1.132) хингидрон (т) PtII(т)
331. Вычислить константу равновесия реакции Zn(т) + |
CdSО4(aq) Cd(т) + ZnSО4(aq) при 298 К, зная электродные |
потенциалы °(Zn2+/Zn) = – 0.763 В и ° (Cd2+/Cd) = – 0.403 В. |
|
332. Вычислить энергию Гиббса и константу равновесия реакции в водном растворе 2Fe3+ + Sn2+ 2Fe2+ + Sn4+ при 25 °С,
зная стандартные потенциалы ° (Fe3+/Fe2+) = 0.771 В и |
° (Sn4+/Sn2+) = 0.15 В |
|
333. Для реакции комплексообразования в водном растворе Cd2+ + 4NH3 |
Cd(NH3)42+ вычислить константу равновесия и |
|
энергию Гиббса на основании следующих стандартных потенциалов: |
|
|
Cd2+ + 2e– Cd |
|
° = –0.40 В |
Cd(NH3)42+ + 2e– |
Cd + 4NH3 |
° = –0.61 В |
334. Чему равны энергия Гиббса и константа равновесия Fe + 2Fe3+  3Fe2+ в водном растворе, если известны стандартные электродные потенциалы ° (Fe3+/Fe2+) = 0.771 В и ° (Fe2+/Fe) = -0.440 В.
3Fe2+ в водном растворе, если известны стандартные электродные потенциалы ° (Fe3+/Fe2+) = 0.771 В и ° (Fe2+/Fe) = -0.440 В.
Тема : химическая кинетика
401.Разложение N2О5 является реакцией первого порядка, константа скорости которой равна 2.7×10–3 мин–1 при 300 К. Определить, сколько N2O5 разложится за 120 минут при этой температуре (в % от начальной концентрации).
402.При 552.3 К константа скорости разложения SO2Cl2 равна 6.09×10–5 мин–1. Вычислить предэкспоненциальный множитель и константу скорости при 600 К, если известна энергия активации 210 кДж/моль.
403.В некоторой мономолекулярной реакции концентрация реагента уменьшается на половину за 1084 с. Сколько времени (в часах) необходимо для превращения 9/10 частей первоначального количества ?
404.Образец молока скисает в 40 раз быстрее при 25 °С, чем при 4 °С. Определить энергию активации процесса скисания.
405.Энергия активации реакции H + CH4 H2 + CH3 равна 49.8 кДж/моль. Вычислить энергию активации обратной реакции, зная стандартные энтальпии образования (кДж/моль) 218.0 водорода Н, –74.8 метана СН4, и 139.5 радикала СН3.
406.При равных начальных концентрациях щелочи и сложного эфира 0.010 моль/л, 20 % имеющегося эфира омыляется за 10 минут. Чему равна концентрация образующегося спирта через 30 минут после начала реакции, если известно, что реакция имеет первый порядок по каждому из реагентов ?
407.Константа скорости реакции в газовой фазе 2NO2 2NO + O2 равна 1.54 л/(моль·с) при 600 К и 6.31 л/(моль·с) при 640 К. Вычислить константу скорости этой реакции при 620 К и определить, сколько диоксида азота прореагирует через 60 секунд, если его начальная концентрация равна 2.00 моль/л.
408.При некоторой температуре сахароза гидролизуется в растворе на 33.0 % в течение 29.8 мин. Через сколько времени (от начала реакции) реакция пройдѐт на 80.0 %, если известно, что она первого порядка ?
409.Для газофазной реакция окисления N + О2 NO + O найдены следующие значения константы скорости [см3 моль–1 с– 1] : 1.63×1010 при 586 К и 1.77×1011 при 910 К. Определить энергию активации и предэкспоненциальный коэффициент.
410.Для некоторой реакции установлено, что при изменении начальной концентрации реагента от 0.502 до 1.007 моль/л и сохранении других условий постоянными время полупревращения уменьшается от 51 до 26 с. Чему равен кинетический порядок (по данному реагенту) и чему равна константа скорости ?
411.Во сколько раз возрастет скорость реакции при повышении температуры от 25 до 100 °С, если энергия активации равна 126 кДж/моль?

412. В водном растворе при 13 °С реакция NH4NCO CO(NH2)2 проходит на 50% за 22.58 часа при начальной концентрации 0.101 моль/л и за 45.17 часа при начальной концентрации 0.05005 моль/л. Вычислить кинетический порядок по цианату аммония NH4NCO и константу скорости (в расчете на секунду времени).
413.Для реакции 2NOBr 2NO + Br2 известны константы скорости 0.321 и 1.117 л моль–1 с–1 при 273 и 287 К, соответственно. Вычислить коэффициенты уравнения Аррениуса.
414.Для реакции 2О3 3О2 известны константы скорости второго порядка 0.450 и 51.2 л моль–1 с–1 при 383 и 439 К,
соответственно. Вычислить 1) коэффициенты уравнения Аррениуса, 2) время (в часах), за которое прореагирует 90.0 % озона при температуре 350 К и начальной концентрации 9.19×10–3 моль/л.
415.При исследовании газофазной реакции 2О3 3О2 в некоторый момент времени найдена скорость изменения концентрации озона –d[O3]/dt = 1.5×10–2 моль л–1 с–1. Чему равна скорость реакции v в этот момент? Чему равна скорость изменения концентрации кислорода d[O2]/dt в этот момент ?
416. Константа скорости (л2 моль–2 с–1) газофазной реакции третьего порядка 2NO + Br2 |
2NOBr равна 2.12×103 при 265.2 |
|
К и 2.68×103 при 288.0 К. Вычислить по этим данным коэффициенты уравнения Аррениуса и константу скорости при 273 К. |
||
417. Скорость изменения концентрации аммиака d[NH3]/dt в реакции N2 + 3H2 |
2NH3 |
в некоторый момент равна 0.10 |
моль/(л·с). Чему равна 1) скорость изменения концентрации азота –d[N2]/dt, 2) скорость изменения концентрации водорода – d[Н2]/dt, 3) скорость реакции v ?
418. При 25 °С константа скорости реакции второго порядка в растворе между анионом с зарядом Z = –1 и ионом с неизвестным зарядом имеет следующие значения при двух ионным силах : 1.763×10–3 дм3/(моль·с) при I = 0.01 моль/дм3 и 1.40×10–3 дм3/(моль·с) при I = 0.0025 моль/дм3. Определить заряд второго иона и константу скорости при нулевой ионной силе. (Заряд следует округлить до целого числа).
419. Простая реакция в растворе вида (А+ + В2– продукты) имеет константу скорости 2.8 ×10–4 дм3/(моль·с) при 25 °С и ионной силе 0.001 моль/дм3. С помощью уравнения Брѐнстеда определить константу скорости при нулевой ионной силе.
420. Реакция окисления бромид иона пероксидом водорода в водной среде является сложной. Она следует стехиометрическому уравнению 2Br– + H2O2 + 2H+ Br2 + 2H2O и кинетическому уравнению v = k[H2O2][Br–][H+]. 1) Если в некоторый момент времени скорость уменьшения концентрации Br– равна 7.2×10–3 моль/(дм3с), чему равна скорость уменьшения концентрации Н2О2? 2) Во сколько раз уменьшится скорость этой реакции, если реакционную смесь разбавить растворителем в 2 раза?
421.Газофазная реакция 2NO + Cl2 2NOCl имеет второй порядок по NO и первый по Cl2. Когда в реактор ѐмкостью 2 дм3 внесли 5 молей NO и 2 моля Cl2, начальная скорость реакции оказалась 2.22×10–3 моль дм–3 с–1. Какой будет скорость, когда прореагирует половина внесѐнного хлора ?
422.Газофазная реакция N2O5 2NO2 + ½O2 изучена со следующими результатами:
T, К |
273.1 |
293.1 |
308.1 |
318.1 |
328.1 |
338.1 |
|
|
|
|
|
|
|
k, с–1 |
7.87×10–7 |
1.76×10–5 |
1.35×10–4 |
4.98×10–4 |
1.50×10–3 |
4.87×10–3 |
Определить коэффициенты уравнения Аррениуса.
423. Реакцию омыления этилацетата избытком гидроксида натрия в водной среде изучали при постоянной температуре. Для определения текущей концентрации щелочи, из реакционной смеси отбирали пробы объѐмом 100 см3 и титровали их раствором 0.0430 моль/л НСl. В таблице ниже приведена зависимость объѐма раствора кислоты, V, пошедшего на титрование пробы, от времени реакции. Определить по этим данным константу скорости, зная, что реакция имеет второй порядок: первый по этилацетату и первый по ОН– ионам.
t, мин |
0 |
4.89 |
10.37 |
28.18 |
|
|
|
|
|
|
|
V, см3 |
62.0 |
50.6 |
42.4 |
29.4 |
14.9 |
424. По следующим ниже данным определить коэффициенты уравнения Аррениуса для реакции второго порядка 2HI H2 + I2 графическим методом. Вычислить константу скорости при 374 °С и концентрацию иодида водорода через 68 минут после
начала реакции при этой температуре (начальная концентрация иодида водорода равна 2.58 моль/л) |
|
|
|||||||
|
T, К |
556 |
629 |
666 |
700 |
716 |
781 |
|
|
|
|
|
|
|
|
|
|
|
|
|
k, л моль–1 с–1 |
3.52×10–7 |
3.02×10–5 |
2.19×10–4 |
1.16×10–3 |
2.50×10–3 |
3.95×10–2 |
||
425. В результате растворения в воде, цианат аммония превращается в мочевину, NH4NCO |
CO(NH2)2. Определить |
||||||||
кинетический порядок, константу скорости и начальную концентрацию NH4NCO по следующим данным (С – текущая концентрация NH4NCO; t – время после приготовления раствора):
