
Физическая и коллоидная химия
.pdf
|
p |
|
Hф.п. |
1 |
1 |
||
□ ln |
2 |
|
|
|
|
|
|
p1 |
|
R |
|
T1 |
|
T2 |
|
■ |
dp |
|
H |
ф.п. |
|
dT Tф.п. |
Vф.п. |
||||
|
|||||
□ |
исп.S |
исп.H |
|
Tкип. |
|||
|
|
44. Уравнение Клаузиуса-Клайперона ( |
d ln p |
|
H |
), описывающее фазовое равновесие, |
|
|
|
||
dT |
|
RT 2 |
||
используется при переходах: |
|
|
|
|
□ плавление |
|
|
|
|
□ затвердевание |
|
|
|
|
□ переход между модификациями |
|
|
|
|
■ испарение и возгонка |
|
|
|
|
45. Взаимные превращения кристаллических фаз, которые могут протекать самопроизвольно лишь в одном направлении:
■ монотропные
□энантиотропные
□метастабильные
□обратимые
46.Взаимные превращения двух кристаллических модификаций, которые могут протекать самопроизвольно и в прямом и в обратном направлении в зависимости от условий:
□ монотропные
■ энантиотропные
□метастабильные
□необратимые
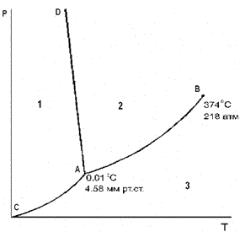
47.На диаграмме состояния воды при невысоких давлениях точка, в которой число степеней свободы равно нулю:
□C
□D
□B
■ A
48. Кривая, отвечающая равновесным системам, состоящим из пара и льда на диаграмме состояния воды при невысоких давлениях:
□DA
□BA
■ CA
□ CAB
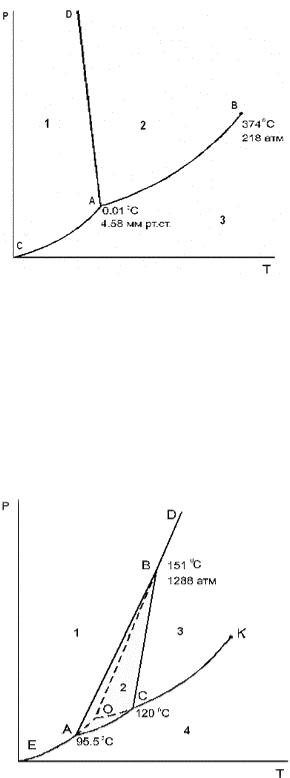
49.Число степеней свободы в области DBCK на диаграмме состояния серы:
□0
□1
■ 2

□ 3
50. На диаграмме состояний двухкомпонентной системы( вещества А, В) область, в которой находится расплав и кристаллы вещества В:
□TA EC
□TB E TA
■ TB ED
□ ACDB
51.На приведенной диаграмме состояний двухкомпонентной системы линия ликвидуса:
■ TB E TA
□CED
□TB ED
□TA EC
52. Пользуясь приведенной диаграммой плавкости двухкомпонентной системы, укажите число степеней свободы в области TA EC:
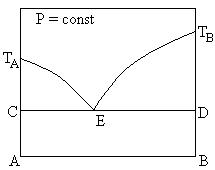
□ 0
■ 1
□ 2 □ 3
53. Число степеней свободы f для системы, состоящей из К компонентов и Ф фаз, на которую из внешних факторов влияют температура и давление:
■ f=К-Ф+2
□f=К+Ф+2
□f=К-Ф+1
□f=К-2+Ф
54. В изолированной системе протекает реакция сгорания водорода с образованием жидкой воды. Внутренняя энергия системы:
□увеличится
□уменьшится
□увеличится значительно
■ не изменится
55.Теплота плавления льда при 0°С равна 6008Дж/моль. Изменение энтропии при замерзании 1
моль воды:
□ 22 Дж/К
■ -22 Дж/К
□6008 Дж/К
□-6008 Дж/К
56. Тепловой эффект реакции при температуре Т рассчитывается с помощью интегральной формы уравнения Кирхгофа:
dH
□dT CP
|
T |
■ HT H298 |
CPdT |
|
298 |
|
T |
□ HT H298 |
CPdT |
|
298 |
|
T |
□ HT H298 |
CV dT |
|
298 |
57. Фазовая диаграмма состояния двухкомпонентной системы с образованием химического соединения, плавящегося без разложения:

□
□
■
□
58. Уравнение ГиббсаГельмгольца:
□ GT |
RT ln |
p2 |
|
p1 |
|||
|
|

□ dG  SdT Vdp
SdT Vdp
□ |
G |
H |
T S |
|
|
|
■ |
G |
H |
T |
|
G |
|
|
|
|
||||
|
T |
P |
||||
|
|
|
|
|
||
|
|
|
|
|
|
|
59.Процесс, в котором работа может совершаться только за счет убыли внутренней энергии:
■ изотермический
□изохорный
□изобарный
□адиабатический
60.Для химической реакции SO2Сl2(Г) =SO2(Г) + Сl2(Г) выражение, связывающее константу равновесия
КР с равновесной степенью диссоциации α и общим равновесным давлением Р:
p 2
■K p 1 2
□ K p |
p |
2 |
|
|
|
|
|
(1 |
) |
2 |
|
|
|
□ K p |
|
p |
|
|
|
|
|
(1 |
) |
2 |
|
|
|
□ K p |
|
p |
2 |
|
|
|
|
1 |
2 |
||
|
|
||
Химическая кинетика
61.Общий порядок кинетического уравнения реакции :
□равен произведению частных порядков,
■ равен сумме частных порядков.
□не зависит от частных порядков,
□является сложной функцией частных порядков.
62.Скорость химической реакции может иметь следующую единицу измерения:
□м3/(моль·с)
□м/с
■моль/(м3·с)
□моль/с
63.Константа скорости реакции может быть:
■положительной
□отрицательной
□равной нулю
□только целочисленный
64.Если реакция является элементарной, то частные порядки в кинетическом уравнении
реакции могут быть:
■ целыми
□дробными
□нулевыми
□комплексными
65.Если реакция является элементарной, то частные порядки в кинетическом уравнении
реакции могут быть:
■ положительными
□отрицательными
□нулевыми
□комплексными
66. Если скорость реакции тем больше, чем больше концентрация данного вещества, то
частный порядок по этому веществу в кинетическом уравнении реакции должен быть:
■ положительным
□отрицательным
□нулевым
□комплексным
67.Если скорость реакции тем больше, чем меньше концентрация данного вещества, то
частный порядок по этому веществу в кинетическом уравнении реакции должен быть:
□положительным
