
- •Биологическое значение реакций трансаминирования
- •Клиническое значение определения активности трансаминаз
- •Принцип метода
- •Контрольные вопросы
- •Литература
- •ХОД РАБОТЫ
- •Таблица 1
- •Таблица 2
- •Таблица 3
- •Оформление работы
- •К занятию:
- •Во время занятия:
- •Реакции аммиака
- •Цикл мочевины
- •Альтернативные реакции выведения избытка азота
- •Регуляция цикла мочевины
- •Наследственные дефекты ферментов цикла мочевины
- •Карбамоилфосфат-синтетаза
- •Орнитин-транскарбамоилаза
- •Аргининосукцинат-синтетаза
- •Аргининосукцинат-лиаза
- •Аргиназа
- •Принцип метода
- •Контрольные вопросы
- •Литература
- •ХОД РАБОТЫ
- •Во время занятия:
- •Глутатион и аномалии эритроцитов
- •Принцип метода
- •Контрольные вопросы
- •Литература
- •ХОД РАБОТЫ
- •Оформление работы
- •Во время занятия:
- •Регуляторная роль пируваткиназы
- •Гипоксические повреждения тканей
- •Утилизация молочной кислоты
- •Принципы методов
- •Контрольные вопросы
- •Литература
- •Субстратные циклы
- •Обмен фруктозы
- •Синтез глюкозы из других сахаров
- •Фруктоза
- •Манноза
- •Галактоза
- •Принципы методов
- •Контрольные вопросы
- •Литература
- •ХОД РАБОТЫ
- •Оформление работы
- •Во время занятия:
- •Образование ЛПОНП и ЛПНП
- •Б. Гиперлипопротеинемия
- •Принцип метода
- •Контрольные вопросы
- •Литература
- •ХОД РАБОТЫ
- •Оформление работы
- •Во время занятия:

Министерство образования Республики Беларусь
Международный государственный экологический университет
им. А. Д. Сахарова
Факультет экологической медицины Кафедра биохимии и биофизики
С.Б. Бокуть, Н.Н. Ячник
Практикум по патобиохимии
Минск
МГЭУ
2004
Авторы:
зав. кафедрой биохимии и биофизики, канд. биол. наук Бокуть С.Б., преподаватель кафедры биохимии и биофизики Ячник Н.Н.
Рецензент:
доцент кафедры экологической медицины, канд. биол. Наук В.Д. Свирид
Рекомендовано научно-методическим советом Международного государственного экологического университета им. А.Д. Сахарова, протокол №2 от
17.03.2004 г.
Бокуть С.Б., Ячник Н.Н.
Практикум по патобиохимии / С.Б. Бокуть, Н.Н. Ячник – Мн., 2004 – 82 с.
Практикум содержит учебно-методические материалы для проведения лабораторных работ по дисциплине специализации "Патобиохимия" со студентами 3-го курса. Для каждой лабораторной работы приводятся основы теории по конкретной теме, вопросы для подготовки к занятию, список рекомендуемой литературы, перечень заданий к занятию, описание используемых в лабораторной работе приборов, материалов и реактивов. Включены материалы, описывающие принципы методов количественного определения в биологических жидкостях низкомолекулярных соединений, имеющих принципиальное диагностическое значение. Соответствует учебной программе спецкурса «Патобиохимия» для студентов МГЭУ.
Все лабораторные занятия написаны авторами настоящего издания совместно.
©С.Б. Бокуть, Н.Н. Ячник, 2004
©Международный государственный экологический университет им. А.Д. Сахарова, 2004
2
СОДЕРЖАНИЕ |
|
ЛАБОРАТОРНАЯ РАБОТА №1 |
4 |
Определение активности трансаминаз аминокислот (аспар- |
|
тат-аминотрансферазы и аланин-аминотрансферазы) |
|
в сыворотке крови динитрофенилгидразиновым мето- |
|
дом |
|
ЛАБОРАТОРНАЯ РАБОТА №2 |
15 |
Определение мочевины в сыворотке крови по цветной реак- |
|
ции с диацетилмонооксимом |
|
ЛАБОРАТОРНАЯ РАБОТА №3 |
27 |
Определение перекисного гемолиза эритроцитов и уровня |
|
восстановленного глутатиона в эритроцитах |
крови че- |
ловека |
|
ЛАБОРАТОРНАЯ РАБОТА №4 |
41 |
Определение активности лактатдегидрогеназы |
|
ЛАБОРАТОРНАЯ РАБОТА №5 |
55 |
Определение шестиуглеродных моносахаридов |
|
ЛАБОРАТОРНАЯ РАБОТА №6 |
71 |
Определение содержания ЛПНП и ЛПОНП в сыворотке крови турбидиметрическим методом
3
Методические указания к лабораторному практикуму по курсу "Патобиохимия"
ЛАБОРАТОРНАЯ РАБОТА № 1
Тема:
Цель работы:
Определение активности трансаминаз аминокислот (ас- партат-аминотрансферазы и аланин-аминотрансферазы) в сыворотке крови динитрофенилгидразиновым методом
Количественное определение активности аспартатаминотрансферазы и аланин-аминотрансферазы в сыворотке крови с использованием тест-наборов, применяющихся в клинической практике
Оборудование и материалы:
•Спектрофотометр SOLAR
•Кюветы полистирольные
•Термостат
•Автоматические микропипетки
•Пробирки
•Штативы для пробирок
•Колбы на 100-250мл
•Цилиндры мерные на 50-100мл
•Палочка стеклянная
Реактивы:
•Субстраты для определения активности АСТ (буферный раствор, рН 7,4) L-аспарагиновая кислота, α-кетоглутаровая кислота
•Субстраты для определения АЛТ (буферный раствор, рН 7,4): L-аланин, α-кетоглутаровая кислота
•2,4-Динитрофенилгидразин (2,4-ДНФГ), раствор
•Пируват натрия, стандартный раствор
•Физиологический раствор (NaCl, 0,9% раствор)
•Вода дистиллированная
4
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Промежуточный обмен аминокислот
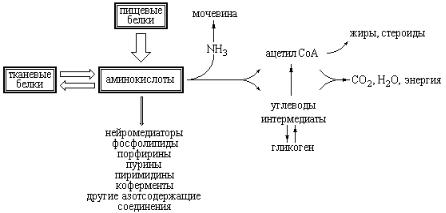
В результате комбинированного действия всего комплекса протеолитических ферментов желудочно-кишечного тракта осуществляется полный гидролиз пищевых белков до свободных аминокислот. Обычная диета включает большой избыток данных соединений. Это означает, что количество поступающих с пищей аминокислот значительно превышает потребности в них клеток для биосинтеза собственных специфических белков и многих важных интермедиатов. Поскольку сами аминокислоты, как и белки, не накапливаются и не запасаются в тканях, их избыточное количество либо окисляется до CO2 и H2O с образованием энергии, либо после отщепления аминогрупп запасается в виде гликогена и жиров (рис. 1.1).
Из кишечника аминокислоты всасываются в кровь и через портальную вену транспортируются в печень, а также разносятся кровью по всему организму. В печени аминокислоты используются для синтеза собственных белков гепатоцитов и белков плазмы крови, а также для синтеза биологически активных веществ (гормонов, биогенных аминов, пептидов) и специфических азотсодержащих соединений (гема, нуклеотидов, кофакторов, креатина и др.). Именно печень ответственна, главным образом, за регуляцию пула свободных аминокислот организма. Основные направления метаболических путей, связанных с превращениями аминокислот показаны на схеме, приведенной на рис. 1.1.
Рис. 1.1 Схема основных направлений метаболических путей, участвующих в формировании пула свободных протеиногенных аминокислот.
Аминокислоты, не используемые непосредственно для ресинтеза тканевых белков, подвергаются дальнейшим превращениям, совокупность которых описывается как промежуточный обмен аминокислот. Условно промежуточный обмен этих соединений подразделяют на общие пути обмена аминокис-
5
лот и специфические пути распада и синтеза индивидуальных аминокислот.
К общим путям обмена относят метаболические пути, включающие реакции
декарбоксилирования, переаминирования, окислительного дезаминирования,
а также реакции, приводящие к образованию конечных продуктов распада аминокислот в организме человека.
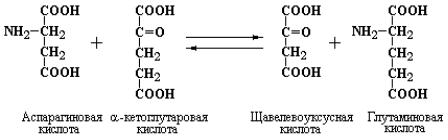
Реакции трансаминирования, катализируемые ферментами семейства трансаминаз, называемых также аминотрасферазами, являются общими реакциями, как для катаболических, так и анаболических путей промежуточного обмена аминокислот. Принцип реакций трансаминирования состоит в переносе аминогруппы от α-аминокислоты (без промежуточного образования свободного аммиака) на α-кетокислоту с образованием новой α-кето- и новой α-аминокислоты. В количественном отношении перенос аминогрупп на α- кетокислоты является наиболее важной реакцией метаболизма аминокислот. Трансаминирование обнаружено in vivo для всех основных аминокислот за исключением лизина, треонина и пролина. Большинство ферментов семейства трансаминаз специфичны к α-кетоглутаровой или глутаминовой кислотам в качестве одного из субстратов реагирующей пары. Специфичность различных трансаминаз к другому субстрату (т.е. другой аминоили кетокислоте) может быть строгой или широкой. Однако, в любом случае та или иная аминокислота и соответствующая ей кетокислота находятся в равновесии с α- кетоглутаратом и глутаминовой кислотой:
Константа равновесия для большинства реакций переаминирования близка к 1, поэтому фактическое равновесие реакции определяется реальными концентрациями пары субстратов, которые зависят от клеточных процессов продукции или расхода соответствующих амино- и кетокислот.
Активность любой трансаминазы зависит от присутствия в активном центре фермента кофактора, представленного пиридоксальфосфатом.
Кофермент связан с белком ионными взаимодействиями, вдобавок альдегидная группа пиридоксальфосфата образует Шиффово основание с ε- аминогруппой лизина белковой молекулы.
6
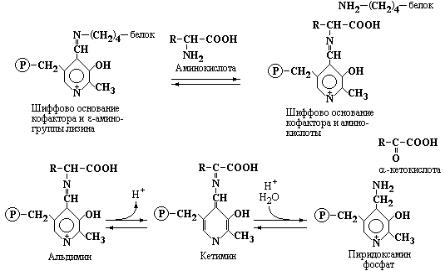
Рис.1.2 Механизм реакции трансаминирования, предложенный А. Браунштейном и Э. Снеллом.
Механизм реакции переаминирования отражает схема, приведенная на рис. 1.2. Данная схема показывает первую стадию реакции трансаминирования - образование интермедиата, представленного Шиффовым основанием кофактора и аминокислоты-субстрата. В результате внутримолекулярной перестройки интермедиата происходит освобождение кетокислоты и образование, связанного с ферментом пиридоксаминфосфата. При взаимодействии пиридоксаминфосфата с другой кетокислотой, за счет обращения реакции, образуется новая аминокислота. Таким образом, в процессе переаминирования кофермент выполняет функцию переносчика аминогруппы.
Биологическое значение реакций трансаминирования
Поскольку, как упоминалось выше, константа равновесия реакций переаминирования практически равна единице, данные реакции легко обратимы, что позволяет трансаминазам функционировать и в процессах катаболизма, и в процессах биосинтеза аминокислот. Следовательно, реакции трансаминирования оказываются чрезвычайно важными для синтеза заменимых аминокислот, для процессов распада аминокислот и обмена аминогрупп. Действительно, в результате функционирования трансаминаз происходит образование десяти заменимых аминокислот из соответствующих α- кетоаналогов.
Избыточные аминокислоты используются как метаболическое топливо, при этом их α-аминогруппы отщепляются от углеродного скелета. Большинство аминогрупп избыточных аминокислот расходуется на образование мочевины, тогда как их углеродные скелеты превращаются в ацетил-СоА или сукцинил-СоА.
7
Окислительное дезаминирование аминокислот
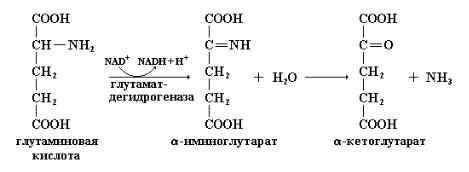
Основным ферментом, обеспечивающим в конечном итоге отщепление аминогрупп от большинства аминокислот, является глутамат-дегидрогеназа. Это происходит потому, что функционирование данного фермента теснейшим образом связано с активностью трансаминаз: аспартат-трансаминазы (АСТ) и аланин-трансаминазы (АЛТ). Как уже было сказано, ферменты семейства трансаминаз специфичны к α-кетоглутаровой или глутаминовой кислотам. Следовательно α-аминогруппы большинства аминокислот в ходе переаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты. Это очень важно, так как глутаминовая кислота является единственной аминокислотой в тканях млекопитающих, которая может с существенной скоростью подвергаться окислительному дезаминированию с высвобождением аммиака (NH4+). Брутто-выражение реакции, катализируемой глутамат-дегидрогеназой, приведено ниже.
Глутамат + NAD+(NADP+) + H2O ↔ α-кетоглутарат + NADH (NADPH) + NH4+ + H+
В действительности механизм реакции окислительного дезаминирования глутаминовой кислоты намного сложнее. В такой реакции аминогруппа окисляется вначале до иминогруппы с образованием α-иминокислоты, при этом восстановительные эквиваленты переносятся на NAD+ или NADP+. На второй стадии α-иминокислота неферментативно присоединяет воду и превращается в соответствующую α-кетокислоту с потерей α-аминного азота в виде NH4+:
Глутамат-дегидрогеназа является сложным белком, состоящим из шести идентичных субъединиц с молекулярной массой 56.000 дальтон, активность которого зависит от действия ряда аллостерических эффекторов. Активаторами фермента являются GDP и ADP, в то время как GTP, ATP и NADH ингибируют глутамат-дегидрогеназу. Известна менее активная форма фермента, проявляющая слабую аланин-дегидрогеназную активность. Указанные свойства глутамат-дегидрогеназы свидетельствуют о том, что в тех случаях, когда аминокислоты необходимы в качестве метаболического топлива, ак-
8
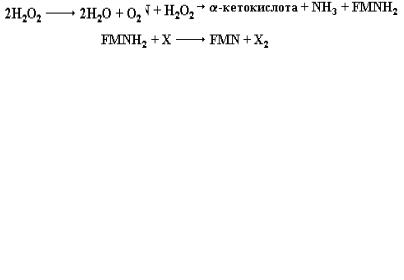
тивность фермента возрастает. С другой стороны, при увеличении энергетического заряда клетки активность фермента снижается.
Оксидазы D- и L-аминокислот
В митохондриях клеток печени и почек млекопитающих присутствуют, так называемые оксидазы L- и D-аминокислот, которые окисляют, соответственно, L- и D-аминокислоты до α-кетокислот и аммиака с использованием молекулярного кислорода в качестве акцептора электронов, при этом кислород восстанавливается до Н2О2. Оксидаза D-аминокислот, обладающая чрезвычайно высокой активностью, содержит в качестве кофактора FAD+. С другой стороны, оксидаза L-аминокислот, отличается намного меньшей активностью и зависит от FMN. В условиях in vitro данные флавопротеиды могут использовать в качестве акцептора электронов не только молекулярный кислород, но и другие окислители, например, краситель метиленовый голубой. В этом случае реакция окисления аминокислоты выглядит следующим образом:
В тех случаях, когда окислителем выступает О2, одним из продуктов реакции является высокотоксичное соединение – перекись водорода:
Данное агрессивное соединение эффективно расщепляется в печени и почках под действием чрезвычайно активного фермента каталазы:
У наземных животных и человека главный путь выведения азота – это образование мочевины, которая синтезируется в орнитиновом цикле в печени, затем мочевина поступает в кровь и экскретируется почками. Один из атомов азота мочевины происходит их аммиака (образующегося в ходе реакций переаминирования и окислительного дезаминирования), другой из аспарагиновой кислоты. В свою очередь, необходимое количество аспарагиновой кислоты может быть получено из щавелевоуксусной кислоты в ходе реакции трансаминирования. Углеродный атом мочевины происходит из СО2, а переносчиком этих атомов в цикле служит аминокислота орнитин.
Ключевым непосредственным предшественником глюкозы белкового происхождения является глюкогенная аминокислота аланин. Эта аминокис-
9
лота в больших количествах синтезируется в мышцах в результате переаминирования α-аминокислот с пируватом. Образующийся аланин с током крови поступает в печень, где скорость синтеза глюкозы из этой аминокислоты за счет обратного переаминирования в пируват намного выше скорости синтеза из остальных аминокислот. Таким образом, аминогруппы аминокислот доставляются из мышц в печень, способность которой к глюконеогенезу из аланина в «глюкозо-аланиновом цикле» поразительно велика: процесс не достигает насыщения даже при концентрации аланина, равной 9 mM, что в 20-30 раз выше его физиологического уровня.
Клиническое значение определения активности трансаминаз
Реакции трансаминирования наиболее эффективно протекают в цитозоле клеток печени, мышц, мозга и других тканей. Однако, отдельные трансаминазы содержатся в различных органах в неодинаковых количествах.
Для клинических целей наиболее важным является определение активностей аспартат-аминотрансферазы (АСТ) и аланин-аминотрансферазы (АЛТ). Особое значение для диагностики имеют ситуации, когда активность трансаминаз оказывается повышенной в плазме крови. Это свидетельствует об усиленных процессах цитолиза в том или ином органе. Трансаминазный тест используется не только для постановки диагноза заболевания, но и для прогноза и контроля эффективности лечения.
В сыворотке крови здоровых людей активность АСТ и АЛТ в тысячи раз ниже, чем в клетках паренхиматозных органов. В результате органических поражений клеток при острых и хронических заболеваниях происходит повреждение последних и, соответственно, обеспечивает выход трансаминаз в кровь из очага поражения. Наибольшая активность аспартатаминотрансферазы отмечена в кардиомиоцитах, в то время как аланинаминотрансфераза в наибольших количествах присутствует в гепатоцитах. На различиях в уровнях активностей разных ферментов семейства трансаминаз в различных органах и основаны физиологические тесты:
-при инфаркте миокарда уровень АСТ в сыворотке крови резко повышается (в 20-30 раз) уже через 3-4 часа после наступления инфаркта. Максимум активности приходится на конец 1-х суток, а через 2-3 дня при благоприятном исходе болезни уровень сывороточных трансаминаз возвращается к норме;
-при остром инфекционном гепатите активность АЛТ обычно повышена в большей степени, чем АСТ;
-при циррозе печени активность АСТ повышается больше, чем активность АЛТ;
-при метастазах в печени или первичной опухоли печени активность АСТ выше активности АЛТ;
10
