
Вірусологія
.pdf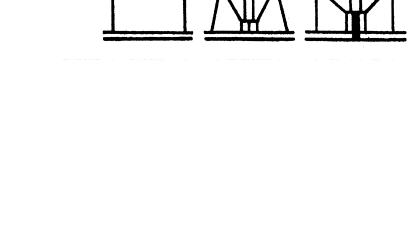
обвиваються навколо відростка таким чином, що їх середня частина підтримується корткими фібрилами, прикріпленими до того місця, де головка з’єднується з відростком. Можливо, при контакті кінців фібрил з рецепторами клітини нитки розправляються і випрямляються. Для цього необхідний L- триптофан як кофактор. Для наступного етапу взаємодії фагу з бактерією необхідне правильне просторове положення базальної пластинки, що забезпечується, очевидно, контактом усіх шести ниток з рецепторами клітини. Слід зауважити, що необернене прикріплення бактеріофагу до клітини і проникнення в неї ДНК відбувається лише на окремих ділянках оболонки (всього їх приблизно 300), де цитоплазма і зовнішні мембрани утворюють міцні контакти, стійкі до м’якого осмотичного шоку.
а |
б |
в |
г |
Рис. 3.3. Схема основних етапів адсорбції фагу Т4 на бактерії E.coli.
а – вільна фагова частинка; б – приєднання довгих фібрил до оболонки бактерії; в – фіксація зубців базальної пластинки; г – скорочення хвостового чохла та ін’єкція фагової ДНК в клітину.
Після адсорбції бактеріофагу на клітині відбувається скорочення чохла, яке стимулюється базальною пластинкою, що змінює свою конфігурацію. В процесі скорочення приймають учась всі 144 субодиниці чохла і їх суцільне переміщення призводить до зменшення довжини чохла у 2 рази і збільшення діаметру на 30%. Дистальна частина стержня щільно підходить до цитоплазматичної мембрани і кінець стержня проколює рихлі шари клітинної оболонки, що були зруйновані лізоцимом. На
131
наступному етапі відбувається ін’єкція ДНК в середину |
бактеріальної клітини. |
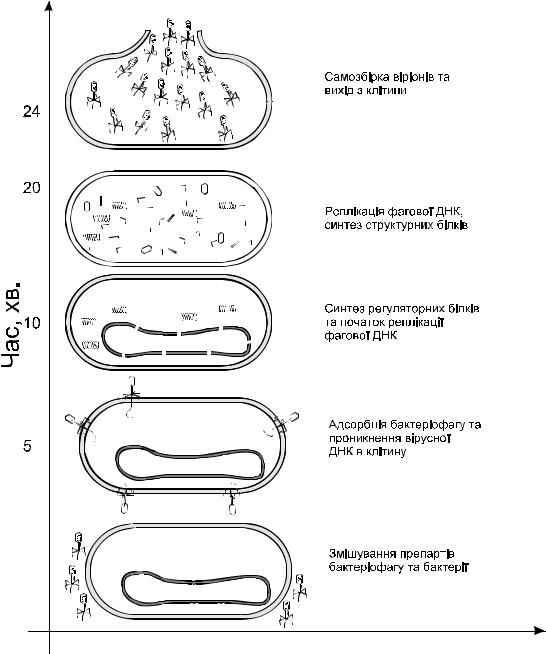
Рис.3.4. Схема розвитку подій при інфікувані Е.coli |
бактеріофагом Т4. |
Латентний період (період часу між зараженням і лізисом клітини) в стандартних умовах для бактеріофагу Т4 складає 24 хвилини (рис.3.4). Потрапивши в середину бактеріальної клітини, фагова ДНК викликає перебудову обміну речовин зараженої клітини (припиняється синтез бактеріальних РНК, ДНК, білків).
132
Рибосоми клітини-хазяїна модифікуються так, що починають функціонувати на м-РНК фагу ефективніше, ніж на м-РНК хазяїна. В клітині спочатку синтезуються “ранні” білки. Синтезуються наступні ферменти: ДНК-полімераза; ДНК-дезоксирибонуклеаза, що руйнує ДНК клітини-хазяїна; ферменти, що необхідні для утворення 5-оксиметилцитозину та його фосфорилювання. Синтезована ДНК-дезоксирибонуклеаза не діє на ДНК фагу, очевидно тому, шо в ній міститься 5-оксиметилцитозин. Ці ферменти забезпечуть синтез ДНК бактеріофагу. На наступному етапі починається синтез білків. Всі білки віріону та інші пізні білки (наприклад лізоцим) синтезуються більш-менш одночасно, і накопичуючись, утворюють фонд “попередників”. Потім вони прямо та специфічно взаємодіють з іншими молекулами, в результаті чого виникають субструктури, які потім збираються вже в цілі віріони. Збирання віріонів складається з чотирьох основних етапів, що приводять до утворення проміжних структур, які взаємодіють між собою лише у визначених критичних точках.
На останньому етапі взаємодії фагу та клітини накопичений лізоцим (продукт гена е) діє зсередини на пептидоглікановий шар клітини. Лізоцим утворюється в зараженій клітині задовго до початку лізису, але лізис наступає тільки в тому випадку, коли лізоцим отримує доступ до шару пептидоглікану. Для цього необхідна реакція, що ініціюється фагом (продукт гену t). В результаті розщеплення пептидогліканів клітинна стінка бактерії стає дуже тонкою і розривається під дією осмотичного тиску. Відбувається вихід бактеріофагу з клітини.
Типовим прикладом помірних фагів є бактеріофаг λ. Цей бактеріофаг може переходити з клітини в клітину в процесі інфекції, або передаватись з поколінння в покоління під час розмноження даного бактеріального штаму. В останньому випадку латентний геном фага називається профагом, а клітини, що несуть профаг – лізогенними. Природнім господарем даного бактеріофагу служить штам Е. Coli К12, генетика якого добре вивчена. Саме тому бактеріофаг λ був вибраний як об’єкт досліджень, направлених на з’ясування природи лізогенії.
Геном бактеріофага λ представлений дволанцюговою ДНК. Фагова ДНК упакована в білкову оболонку, що представляє собою досить складну структуру та складається з головки та хвостового відростку. Фагова частинка за допомогою хвостового відростку
133
приєднується до клітини, проколює її оболонку та вводить свою ДНК, залишаючи оболонку ззовні.
Подальші події можуть розвиватись двома способами (рис.3.5.). Для одних клітин спостерігається літичний шлях розвитку: різні групи фагових генів включаються та виключаються відповідно до певної програми. ДНК фага λ інтенсивно реплікується, синтезуються нові білки головки та хвостового відростку, в бактеріальній клітині утворюються нові інфекційні віріони. В решті решт клітина лізується та вивільняє приблизно 100 фагових частинок.
В інших клітинах фагова ДНК лізогенізує клітину-господаря: всі фагові гени, крім одного, виключаються та фагова ДНК, яка отримала назву профаг, стає частиною бактеріальної хромосоми. При поділі бактерії „профаг” пасивно реплікується та передається дочірнім клітинам. Цей процес може повторюватись безмежну кількість разів. Проте, при УФ-опроміненні майже всі лізогенні клітини лізуються та дають потомство фагу λ.
Як було сказано вище, в лізогенній клітині працює один єдиний фаговий ген, що кодує білок-репресор фагу λ. Репресор є позитивним та негативним регулятором експресії генів. Приєднуючись до двох операторних ділянок фагу λ, він вимикає всі інші гени бактеріофагу та експресує свій власний ген.
134
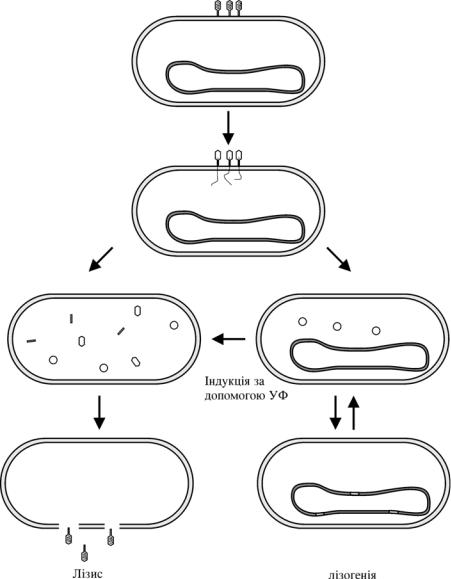
Рис.3.5. Шляхи розвитку бактеріофага λ.
Слід зауважити, що одразу після інфікування перші етапи регуляції експресії генів однакові незалежно від способу подальшого розвитку подій. На критичному етапі фаговий регуляторний білок “відчуває” стан клітини-господаря і подальші події направляються по одному з двох шляхів.
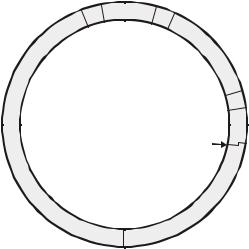
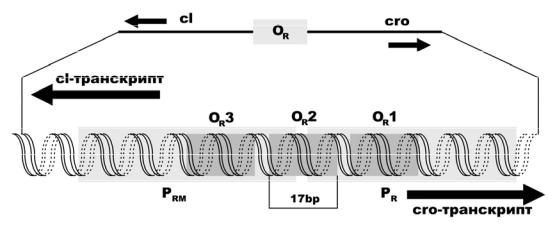
На рис.3.6. подана спрощена генетична карта фага λ. Бактеріальна хромосома у складі віріону є лінійною, але одразу після потрапляння в бактеріальну клітину замикається в кільце. В результаті з’єднання кінців ДНК (cos-сайтів) групи генів лізису та хвостового відростку зближуються. Гени, що кодують білок репресор (CI) та білок, який запускає літичний шлях (Cro), розміщені поруч на хромосомі фагу. Ці гени транскрибуються в
135
протилежних напрямках (рис.3.7.). Точки початку транскрипції цих генів розділені ділянкою 80 пар основ. В цій ділянці розміщені промотори та оператори, з якими з’єднуються білки-регулятори. На рис. . видно, що кожен з генів (c1 та cro) має свій власний промотор. Ці промотори не перекриваються між собою. OR1, OR2 та OR3 – це операторні ділянки, до яких приєднуються c1 та cro, регулюючи таким чином активність обох промоторів. Слід відмітити, що кожна з операторних ділянок перекривається з одним з промоторів, а OR2 перекривається з обома промоторами.
|
|
|
|
я |
|
|
|
|
і |
|
|
|
|
ц |
|
|
|
|
а |
|
|
б |
і |
н |
|
м |
|
||
о |
|
|
||
|
|
|
||
|
|
|
|
|
к |
|
|
|
|
е |
|
|
|
|
Р |
|
|
|
|

 a t t
a t t
|
І |
ІІ |
|
с |
|
N
 c
c
I 
c
r
o
c |
|
ll |
|
Р |
|
е |
|
п |
|
л |
|
і |
|
к |
|
а |
|
ц |
|
|
і |
|
я |
|
Д |
|
Н |
|
К |
|
Q |
|
Л |
|
і |
|
з |
|
и |
co s |
с |
|
|
а к в ілоГ
вХ
сі т
Рис.3.6. Генетична карта бактеріофага λ.
РНК-полімераза – це фермент, що транскрибує фагову ДНК з утворенням РНК. При зв’язуванні з PR (промотор гену cro), полімераза налаштовується на транскрипцію цього гену (в праву сторону), а при з’язування з PRM (промотор гену c1) транскрибується ген c1 в іншу сторону. В клітині ці два промотора ніколи не бувають зайняті одночасно: в залежності від стану апарату регуляції експресії полімераза зв’язується тільки з одним з них. В присутності репресора полімераза може зв’язатись з PRM, а в присутності Cro – з PR.
Отже репресор, приєднаний до OR2, виключає ген cro, перешкоджаючи зв’язуванню РНК-полімерази з PR. В даному випадку репресор здійснює негатитивну регуляцію. З іншого боку, репресор, приєднавшись до OR2, допомагає РНК-полімеразі зв’язатись та почати транскрипцію з PRM. Ефективність транскрипції збільшується приблизно в 10 разів. Таким чином,
136
білком-репресором здійснюється позитивна регуляція власного гену.
В лізогенізованій клітині репресор завжди зв’язаний з OR1 та OR2, в той час як OR3 зазвичай вільний від репресора. Таким чином, в даній клітині відбувається активний синтез білку репресора. Якщо в клітині дуже висока концентрація білку репресора, то останній приєнується до OR3 і блокує власний промотор. При діленні клітини концентрація даного білку дещо падає. В результаті цього білок-репресор від’єднується з ділянки OR3 і процес транскрипції гену c1 відновлюється. При відсутності зовнішніх впливів ці процеси можуть відбуватись необмежено довго, однак можуть бути призупинені будь-яким індуктивним впливом. Найкращим індуктором в даному випадку є ультрафіолетове опромінення.
Рис.3.7. Схематичне зображення апарату переключення генів у бактеріофагу лямбда.
Мішенню дії УФ-випромінення та інших індукуючих факторів є ДНК. Пошкодження ДНК під впливом опромінення викликає зміну в поведінці бактеріального білку Rec A. Останній стає високоспецифічною протеазою, що розщеплює мономери репресора λ та інших репресорів. Це призводить до двох наслідків. По-перше, по мірі того як репресор звільняє OR1 та OR2, швидкість його синтезу падає. По-друге, полімераза зв’язується з PR та починає транскрипцію гену cro. Тепер саме білок Cro визначає подальший розвиток подій. Перша синтезована молекула Cro зв’язується з OR3. Це пригнічує подальший синтез білку репресора. Поки ген PR продовжує працювати та ген cro транскрибується,
137
транскрибуються також гени, розмішені зправа від cro. Продукти цих генів необхідні на ранніх етапах літичного циклу. Синтезується все більше білка Crо, поки його конценцентрація не досягне рівня, при якому заблоковуються ділянки OR1 та OR2. Таким чином білок Cro вимикає синтез репресора, та запускає каскад експресії генів, відповідальних за літичний шлях розвитку фагу λ.
Практична частина
Методи титрування бактеріофагів
Активність бактеріофагу визначають за його властивістю викликати лізис бактеріальної культури в рідких або твердих середовищах і чисельно виражають ступенем максимального розведення, в якому досліджуваний фаг проявив свою літичну дію. Вид середовища, як правило, визначається здатністю певного фагу лізувати культуру в рідкому чи твердому поживному середовищі.
При дослідженні в рідкому середовищі (за Аппельманом) титр фагу– це найбільше його розведення (або найменша кількість), яке повністю стримує (пригнічує) ріст тест-культури в умовах даного досліду.
На твердому середовищі (титрування за Граціа) титр фагу – кількість часток фагу в 1 мл досліджуваного матеріалу.
Титрування фагу за методом Аппельмана (рідке середовище)
Завдання: опанувати методику титрування бактеріофагів в рідкому поживному середивищі, визначити титр бактеріофагу Т4.
Матеріальне забезпечення: Пробірки з ватно-марлевими пробками, штатив, груші та піпетки (самплери та носики), маркери, поживне середовище (LB), нічна бактеріальна культура, бактеріофаг, термостат.
138
Хід роботи:
1.В 9 стерильних пробірок вносять по 4,5 мл поживного середовища. Пробірки ставлять в штатив і нумерують від 1 до 7, на 8 пробірці ставлять позначку КК (контроль культури), на 9 - КФ (контроль фагу). Всі дослідні пробірки повинні бути підписані.
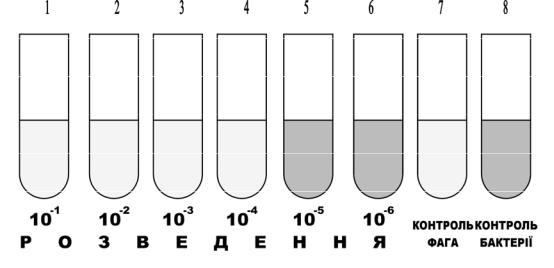
2.В пробірках під номерами від 1 до 7 готують послідовні десятикратні розведення фагу від 101 до 107. В першу пробірку вносять 0,5 мл фагу. Таку ж його кількість вносять в пробірку контролю фагу під №9. Замінивши піпетку новою, ретельно перемішують вміст 1-ї пробірки і переносять 0,5 мл його в 2-гу пробірку, 0,5 мл вмісту 2-ї пробірки переносять в 3-тю і так далі до 7-ї пробірки. Кожен раз необхідно брати нові піпетки (або носики). Перемішавши вміст 7-ї пробірки, 0,5 мл розведення із неї виливають в дезрозчин. Так само чинять із вмістом пробірки №9 - контролем фагу (рис. 3.8).
Рис.3.8. Результати титрування бактеріофагів за Апельманом
3.У всі пробірки досліду, крім пробірки №7, вносять по 1 краплині (0,05 мл) суспензії тест-культури. Внесення культури проводять однією піпеткою з пробірки № 9 до №1. Пробірки разом із штативом струшують. У всіх пробірках досліду, крім пробірки на контроль фагу, повинна з’явитись ледь помітна мутність.
139
4.Пробірки ставлять в термостат на 18-20 годин, після чого проводять облік результатів титрування, розпочинаючи з
контролів.
При титруванні фагу ставлять такі контролі: контроль фагу і середовища на стерильність, контроль тест-культури на її життєву активність.
При правильній постановці досліду в контролі культури відбулося інтенсивне розмноження бактерій і вона стала мутною, що добре видно візуально. Цей контроль дозволяє зробити висновок, що тест-культура, на якій титрували фаг, життєздатна, поживне середовище забезпечує їй оптимальний розвиток в умовах досліду. Виходячи із результатів росту тест-культури в контролі, можна зробити висновок: якщо в пробірках з фагом культура не виросла, то на неї подіяв фаг. Рідина в пробірці з контролем на фаг повинна лишатись прозорою. Це дозволяє зробити висновок, що посуд, середовище і фаг стерильні.
Враховують характер змін в титраційному ряду пробірок від №1 до №7 (рис. ). Ріст культури в пробірках титраційного (дослідного) ряду свідчить про відсутність в них фагу. Визначають титр фагу, тобто його найбільше розведення, яке здатне викликати лізис культури (вміст пробірки в порівнянні з контролем на ріст культури прозорий). Позначається титр фагу степенем розведення фагу з від’ємним знаком, що відповідає порядковому номеру пробірки. Наприклад, якщо в перших чотирьох пробірках титраційного ряду відсутній ріст культури, а в наступних пробірках культура росте, то титр фагу буде 104 фагових частинок на мілілітр (рис. ).
Методичні рекомендації:
Найголовніша вимога при роботі з бактеріями – це стерильність роботи. Всі операції слід виконувати біля полум’я пальника або в стерильному боксі. Лабораторний посуд, інстументарій та поживні середовища попередньо стерилізуються в автоклаві. До початку роботи необхідно обробити робоче місце ультрафілетом та спиртом. Роботу бажано проводити в гумових рукавичках, оскільки E.coli є умовно патогенною бактерією.
При розведенні бактеріофагу необхідно кожного разу брати нову піпетку (носик для самплера). Після додавання фагу в поживне середовище слід ретельно перемішати вміст пробірки. При титруванні фагу об’єм і склад середовища, температура,
140
