
Вірусологія
.pdfб) використовуються як для очищення, так і концентрації фітовірусів.
Контрольні запитання
1.Для яких цілей проводять виділення та очищення вірусів рослин?
2.Як отримують інокулюм?
3.Чим відрізняється екстракція вірусів рослин від освітлення вірусного екстракту?
4.При виділенні яких вірусів не використовують освітлення соку органічними розчинниками і чому?
5.Для чого використовкують рідкий азот при виділенні вірусів рослин?
6.Чому для виділення вірусів з рослин використовують різні буферні розчини?
7.Які чинники можуть впливати на інфекційність вірусу при виділенні та очищенні?
8.Охарактеризуйте диференційне центрифугування як метод отримання вірусного препарату.
9.Який принцип лежить в основі очищення вірусів методом висолюввання?
10.Який принцип лежить в основі очищення та концентрації вірусів методом осадження вірусу в ізоелектричній точці?
11.Що таке діаліз та приклади його застосування у фітовірусології ?
12.Принцип гель-фільтрації та навести приклади її застосування у фітовірусології
Список літератури
1.Гиббс А., Харрисон Б. Основы вирусологии растений. - М.:
Мир, 1978. – 429 с.
2.Метьюз Р. Вирусы растений. – М.: Мир, 1973. – 600 с.
3.Практикум із загальної вірусології. /За ред. А.Л. Бойка. – К.: Видавничий центр «Київський університет», 2000. – 269 с.
4.Практикум по общей вирусологии. Под ред. Атабекова И.Г.- М.: Университет, 1980.-191с.
5.Hadidi A., Khetarpal R.K., Koganezawa H. Plant Virus Disease Control.- 1998. - ASM Press, Minnesota. – 683 p.
161
РОЗДІЛ 5. ВИКОРИСТАННЯ ЕЛЕКТРОННОЇ МІКРОСКОПІЇ У ВІРУСОЛОГІЧНИХ ДОСЛІДЖЕННЯХ.
Зміст Теоретична частина
Будова електронного мікроскопу Плівки-підкладинки для препаратів Методи контрастування вірусів Практична частина Хід роботи
Контрольні завдання та запитання Список літератури
Оскільки однією з особливостей представників царства Vira є те, що вони мають субмікроскопічні розміри, їх неможливо досліджувати за допомогою світлового мікроскопу. Тільки найбільший з вірусів – вірус натуральної віспи, можна побачити під світловим мікроскопом, але неможливо розглянути навіть цей вірус детально. Тільки завдяки використанню електронного мікроскопу можливо детально розглянути морфологію вірусів.
Діагностика вірусів за допомогою ЕМ базується на ідентифікації вірусів за їх характерною морфологією. Головна перевага діагностики за допомогою ЕМ – можливість візуалізовати вірус. Можливо ідентифікувати вірус безпосередньо без попереднього вивчення вірусного агента. Інша перевага методу ЕМ – це швидкість діагностики, препарат може бути розглянутий протягом декільком хвилин після приготування препарату з вірусвмісної рідини. З іншого боку, головний недолік – неможливість дослідити одночасно багато матеріалу. По-друге, для виявлення повинна бути певна концентрація вірусних часточок (приблизно 106 часточок в мл). Деякі віруси, наприклад вірус саркоми Рауса, мають нечітку морфологію, що робить їх детекцію дуже складною. Наприкінець, утримання та обслуговування ЕМ дуже складне та потребує висококваліфікованого персоналу.
Виникнення електронної оптики, зокрема електронної мікроскопії, базуєтья на тьох основних долідженнях в області фізики, які відносяться до 1897-1926 років: відкриття електрону, встановлення хвильової природи матеріальних часточок, що рухаються, та винайдення відхиляючої дії електричних та магнитних полей на заряджені часточки. Ці посилання дозволили
162
Е. Руска та М. Кнолю в 1931 році розробити перший просвічуючий (трансмісійний) електронний мікроскоп (ЕМ, ТЕМ).
В сучасних ЕМ з успіхом використовується ряд конструктивних особливостей, значно полегшуючих їх експлуатацію: зйомка проводиться на фотоплівку, яка знаходиться поза вакуумною системою; в колонку ТЕМ вбудовується телекамера, це дає змогу збільшити контрасність зображення та зменшити інтенсивність електронного пучка; використовуються турбомолекулярні насоси, що дозволяє уникнути забруднення парами масла; запроваджені пристосування, які дозволяють фокусувати пучок електронів на невеликому полі об’єкту; прилади обладнані мікропроцесорами, які дозволяють фокусувати зображення, оптимізувати контрасність та експозицію, зберігати зображення в пам’яті та ін.
Сучасні серійні електронні мікроскопи дозволяють отримувати мікрофотографії з розподільчою здатністю досліджуваних структур до 4,5 А, а в окремих випадках розподільча здатність 2, 35 А. і навіть 1,43 А. Відстань між окремими нуклеотидами в полінуклеотидному ланцюгу складає приблизно 6 А, а період повторення в подвійній спіралі ДНК - 34 А. Здавалося б, первинна та вторинна структури ДНК могли бути досліджені електронномікроскопічно. Однак експериментатори, які працюють в цьому напрямку, стикаються з великими труднощами, і відчутних результатів поки що не досягнуто. Електронна мікроскопія окремих порівняно крупних білкових молекул в ряді випадків дозволила отримати точні відомості про четвертинну структуру молекул.
Всі труднощі, з якими стикаються дослідники, пов’язані з тим, що щільність біологічних об’єктів в декілька разів менше, ніж тих, при дослідженні яких отримують максимальну якість зображення. Для того, щоб отримати зображення макромолекул, їх доводиться контрастувати, вишукуючи для цього різні прийоми. Якість зображення біологічних структур, який досягається таким чином, поки що нижча ніж на мікрофотографіях кристалів або напилених в вакуумі часток металу.
Не дивлячись на великі експериментальні труднощі, електронна мікроскопія біологічних макромолекулл продовжує успішно розвиватися. Дозволяючи використовувати для досліджень звичайні суспензії та розчини препаратів, електронна мікроскопія значно розширила коло можливих досліджень. При
163
дослідженні вірусів, наприклад, застосування удосконалених методів контрастування дозволяє безпосередньо спостерігати форму білкових капсул, розташування та конфігурацію білкових субодиниць, з яких вони складені. Електронна міроскопія дозволяє досліджувати процес ресинтезу вірусів in vitro.
Застосування методу електронної мікроскопії для вивчення будови біологічних макромолекул має велике майбутнє. Запорука цьго - швидке вдосконалення приладів і методів досліджень, зростаючий інтерес, який приділяється розвитку цього напрямку вченими самих різних спеціальностей - біологами, фізиками, хіміками.
Найважливіша характеристика мікроскопу - здатність давати роздільне зображення точок об”єкта, розташованих в безпосередній близькості, називається розподільчою здатністю. Чим менше відстань між двома точками, при якому ці точки ще видно окремо, тим вища розподільча здатність приладу.
Зображення точки, яка світиться, що отримують за допомогою круглої лінзи, завдяки дифракції світла на отворі лінзи представляє собою не точку, а дифракційну картину. Якщо дві точки об”єкта розташовуються поблизу, то кожна з них дає свою дифракційну картину та розподіл інтенсивності є результатом їх додавання. Спостерігати окремо ці дві точки можливо, якщо максимум дифракційної картини зображення однієї з них знаходиться по відношенню до максимуму дифракційної картини сусідньої точки на відстані не ближче, ніж до першого мінімуму дифракційної картини. Можливо показати, що відстань (d) між центральним максимумом та першим мінімумом в масштабах об”єкта дорівнює:
d= |
0,61 λ |
(1) |
|
n sinα |
|||
|
|
де λ - довжина хвилі;
n - показник заломлення середовища, в якій знаходиться об”єкт;
α - апертурний кут лінзи.
З рівняння (1) витікає, що найбільша розподільча здатність (найменше значення d) може бути досягнута при мінімальній довжині хвилі, в той час як n та α повинні бути по можливості більше. В повітрі або в вакуумі n = 1. В умовах використання
164
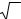
імерсійного об”єктива (n = 1,4) і α, близького до 90°, єдиним ресурсом для збільшення розподільної здатності залишається довжина хвилі.
Оскільки людське око найбільш чутливе до жовто-зеленої частини спектру, в світловій мікроскопії користуються світлом з довжиною хвилі 5200-5800 А. В цих умовах (при n= 1) теоретична границя розподілу складає близько 2000 А ( приблизно 1/5 розміру бактеріальної клітини). Використання ультрафіолетової оптики, коли безпосереднє спостерігання вже неможливе, дозволяє досягнути розподілу 1200 А. Таким чином, за межами можливості світлової мікроскопії залишаються дослідження тонкої структури клітин, вірусів, макромолекул.
Збільшити розподільчу здатність мікроскопів дозволило застосування електронів. Як відомо, довжина хвилі (λ) частки, що рухається, може бути підрахована з рівняння
λ = |
h |
, |
(2) |
|
m v |
||||
|
|
|
де h -постійна Планка; m - маса частки;
v - швидкість частки.
Якщо замінити в в формулі (2) h і m їх числовими значеннями та виразити швидкість v через прискорюючий потенціал V, отримаємо:
λ = |
12,25 |
Α. |
(2”) |
||
ν |
|
||||
|
|
|
|||
При прискорюючій напрузі в електронному мікроскопі 50 кв, λ відповідає 0,0536 А ( складає 1/100 000 довжини хвилі звичайного зеленого світла), при 80 кв - 0,0418 А та при 100 кв - 0,0370 А. Таким чином, довжина хвилі електронів значно коротша, ніж у видимого світла. Отже, і коло розсіювання завдяки дифракції в цьому випадку буде значно меншим. В цьому є причина ефективності електронного мікроскопу. Теоретично, (див. рівняння 1) при sin α=1 електрони з довжиною хвилі 0,04 А змогли б забезпечити розподільчу здатність 0,025 А. Однак магнітним лінзам, за допомогою яких в електронному мікроскопі створюється збільшене зображення, властиві різноманітні аберації, які, як це буде показано далі, при великих апертурних кутах дуже великі. Найкраща розподільча здатність відповідає α=10-2 - 10-3 радіан. В
165
цих умовах сучасні електронні мікроскопи здатні забезпечити розподіл до 1,43А. Треба сказати, що розподіл залежить не тільки від приладу, але й від фізичних властивостей досліджуваного об”єкта. Найбільшу розподільчу здатність вдається отримати для кристаличних препаратів.
Висока розподільна здатність електронних мікроскопів відкрила для досліджень велику область, в якій знаходяться відповіді на багато проблем біохімії та біофізики. Межа цієї області завдяки удосконаленню мікроскопів та розробці нових методів препарування в останні роки розширилась до молекулярного рівня, де раніше дослідження проводилися головним чином за допомогою рентгеноструктурного аналізу.
Спрощені схеми шляху електронів та розташування магнітних лінз в мікроскопах просвічуючого типу показані на рис.5.1. В цих приладах пучок електронів проходить через досліджуємий предмет і начебто “просвічує” його. Звичайно лінзи розташовуються одна над одною, формуючи вертикальну колонку, в верхній частині якої знаходиться джерело електронів - електронна гармата. Всередині колони підтримується вакуум 10-4 - 5х10-5 мм рт.ст. Джерело електронів та осі різних лінз мають знаходитися на одній лінії, тому передбачається можливість юстировки приладу.
166

Рис.5.1. Спрощена схема електронного мікроскопу трансмісійного типу. Магнітні лінзи умовно позначені як скляні.
а – мікроскоп з однією конденсорною лінзою та двоступеневим (за допомогою об’єктивної та проекційної лінз) збільшенням;
б - мікроскоп з подвійною конденсорною інзою та трьохступе
евим збільшення
Електрони, які проходять через речовину об’єкту, змінюють свої траєкторії - розсіюються. Приблизно співвідношення між числом попадаючих на дільницю зразка електронів N та числом
тих електронів, що |
|
розташовуються на кут більший θ - |
N |
|||||||||
можливо виразити таким чином: |
|
|||||||||||
N |
= |
ρ N |
A |
• |
Z2e2 |
+ |
|
1 |
•t |
|
||
|
|
|
1 |
|
|
|
|
|||||
N |
A |
|
|
|
|
|||||||
|
|
|
V 2θ2 |
|
|
Z |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
167 |
|
де ρ - густина досліджуваної речовини; NA -число Авогадро;
A - атомна вага;
Z - атомний номер;
V - прискорююча напруга; e - заряд електрону;
t - товщина зразку.
Таким чином, число розсіяних електронів збільшується зі збільшенням густини досліджуваної речовини, його атомного номера, товщини зразку та зменшенням енергії електронів.
Практика доводить, що при сучасних методах контрастування біологічних макромолекул оптимальна прискорююча напруга для їх досліджень знаходиться в діапазоні 70-100 кв. При напрузі нижче 70 кв зразок швидше руйнується під впливом електронів, в результаті втрати енергії чатиною електронів при проходженні через об”єкт збільшується хроматична аберація, зменшується розподільча здатність. При напрузі вище 100 кв деталі досліджуваних структур також виявляються гірше через зменшення розсіювання електронів.
Біологічні об’єкти складаються з речовин з малими атомними номерами - водню, вуглецю, азоту, фосфору та ін. Густина ρ для різних біологічних об”єктів складає від 1 до 2 г/см3 . Мінімальна товщина біологічного об”єкту такої щільності, яка виявляється при прискорюючій напрузі в електронному мікроскопі 50 кв, дорівнює приблизно 50 А. Практично не контрастовані частки невеликих вірусів, розташовані на підтримуючій плівці, спостерігаються в електронному мікроскопі в вигляді безструктурних плям, а окремі неконтрастовані молекули нуклеїнових кислот взагалі неможливо спостерігати. Але завдання сучасної електронної мікроскопії в біології - по можливості глибше вникнути в будову клітини та її структурних компонентів, в будову вірусних часточок. В зв”язку з цим біологічні об”єкти необхідно тим чи іншим чином контрастувати.
Поряд з контрастуванням відтіненням металами і використанням широко розповсюдженого методу реплік розроблені специфічні методи контрастування, які застосовуються головним чином в біології. Широке застосування отримав метод вибіркового “фарбування” тканин, тонких зрізів та окремих часток та молекул та молекул солями важких металів, а також метод так званого негативного контрастування.
168
До специфічних особливостей електронної мікроскопії в біології відноситься також велика ймовірність виникнення артефактів, тобто внесених в структуру об”єкта викривлень його реальної форми. Це пов’язано з одного боку - з процесом фіксації та висушування, з другого - з процесом контрастування. Для виявлення артефактів та попередження їх необхідні ретельний аналіз отриманого зображення, порівняння отриманих даних з результатами інших досліджень.
Плівки-підкладинки для препаратів.
Біологічні макромолекули, для того щоб їх можливо було досліджувати в електронному мікроскопі, розміщуються на тонесеньких плівках-підкладинках. В свою чергу опорою для цих плівок слугують спеціальні сітки, виготовлені з міді електролітичним способом або сплетені з тонкого дроту. Ті ж електрони, які формують зображення досліджених об”єктів, взаємодіють з плівкою-підкладинкою. Тому, якщо товщина плівки відносно велика або матеріал, з якого вона зроблена, сильно розсіює електрони, контрасність зображення розміщеного об”єкту різко погіршується. Матеріал плівки повинен бути механічно міцний, мати значну теплопровідність та стійкість до бомбардування електронами (таб.5.1). Іноді препарати, розташовані на плівці-підкладинці, піддаються спеціальній обробці, в таких випадках до плівки пред”являють додаткові вимоги хімічної стійкості. Слід відмітити ще одну важливу особливість плівок-підкладинок. При дослідженні молекул біополімерів підтримуюча плівка в силу властивостей своєї поверхні (гідрофільність або гідрофобність, наявність заряду) може суттєво впливати на їх конфігурацію. Це необхідно враховувати при виборі підкладинки чи трактовці результатів.
Таблиця 5.1. Деякі властивості плівок-підкладинок (Атабеков, 1980)
Плівка |
Прозорість |
Механічна |
Стійкість |
Хімічна |
|
по |
міцність |
до |
стійкість |
|
відношенн |
|
бомбардува |
|
|
ю до |
|
ння |
|
|
електронів |
|
електронам |
|
|
|
|
и |
|
Колодієва |
Велика |
Низька |
Низька |
Низька |
|
|
169 |
|
|
Формваров |
Велика |
Низька |
Низька |
Низька |
а |
Середня |
Висока |
Висока |
Дуже |
Вуглецева |
Мала |
Середня |
Середня |
висока |
Кварцева |
|
|
|
Висока |
Якість зображення об’єкта залежить від товщини плівкипідкладинки. Зменшення товщини плівки зменшує її механічну міцність. Дуже тонка плівка буде розриватися в процесі препарування або під впливом пучка електронів. Тонкими плівками можна користуватися, якщо застосовувати в якості додаткової опори дірчасті плівки, виготовлені з колодію та укріплені шаром вуглецю.
Для приготування плівок використовується 0.1-0.2%-ний розчин формвара (поліфінілформальдегіда). Розчинниками можуть бути діоксан, діхлоретан, хлороформ. Розчин слід готувати за одну добу до використання, зберігати в посуді з притертою кришкою в темному місці, строк придатності до 6 місяців.
МЕТОДИ КОНТРАСТУВАННЯ ВІРУСІВ
Віруси є електронно-оптично прозорими. Контрасність зображення в трансмісійному ЕМ можливо підвищити шляхом зниження прискорюючої напруги, зменшення апертурної діафрагми, збільшення фокусної відстані об’єктивної лінзи. Найбільш єфективним підходом є хімічне контрастування – штучне збільшення електроної щільності ультраструктур. За рахунок осадження електронно-щільних речовин контрастування може бути позитивним – підсилення електронної щільностідосліджеваних структур порівняно з фоном, який оточує об’єкт, та негативним – збільшення електронної щільності фону. В першому випадку електронно-шільні речовини осаджуються на вірусах, в другому вони вводяться в середовище, яке оточує досліджувані об’єкти (вірусні частки, білки, тощо).
Позитиве контрастування.
Для контрастування найчастіше використовуються уранілацетат та цитрат свинцю.
Уранілацетат (УА) реагує головним чином з фосфатними, карбоксильними та аміногрупами та має велику спорідненість до нуклеїнових кислот. Для позитивного контрастування за допомогою УА використовують 2% або насичений розчини у 50,
170
