
Вірусологія
.pdfПоїдання |
приплоду |
іншими |
- “ -, вчасне постачання їжі та |
|||||||||
тваринами |
|
виду |
|
при |
води |
|
|
|
|
|
||
голодуванні чи дефіциті води |
|
|
|
|
|
|
||||||
(навіть протягом 4-6 год) |
|
|
|
|
|
|
|
|||||
Поїдання |
|
|
|
самками |
Своєчасне |
|
|
видалення |
||||
мертвонароджених |
|
|
|
мертвонароджених з гнізда |
|
|||||||
Поїдання собі подібних після |
Частину |
підстилки |
|
потрібно |
||||||||
заміни |
підстилки |
|
в |
гнізді |
залишати для підтримання запаху |
|||||||
(зникає природний |
запах і |
|
|
|
|
|
|
|||||
з’являється незнайомий) |
|
|
|
|
|
|
|
|||||
Канібалізм |
при |
перенаселенні |
Розселення |
тварин |
у |
декілька |
||||||
клітки |
|
|
|
|
|
|
кліток |
|
|
|
|
|
Канібалізм |
може |
мати |
місце |
Тварин |
|
потрібно |
|
брати |
||||
при |
появі |
на |
|
тваринах |
стерильними |
інструментами |
||||||
сторонніх |
запахів |
(особистий |
(пінцетом, корнцангом). Для |
|||||||||
запах |
людини, |
|
гумових |
знищення |
|
запаху |
|
спинку |
||||
рукавичок, ефіру, йоду, спирту |
дитинчат |
змащують |
камфорою, |
|||||||||
тощо) |
внаслідок |
проведення |
сечею, |
|
вагінальними |
|||||||
експерименту |
|
|
|
|
виділеннями |
матері. |
Перед |
|||||
|
|
|
|
|
|
|
взяттям |
новонародженого |
з |
|||
|
|
|
|
|
|
|
клітки руки можна |
обтерти |
||||
|
|
|
|
|
|
|
пухом з гнізда, а перед |
|||||
|
|
|
|
|
|
|
поверненням |
змастити |
його |
та |
||
|
|
|
|
|
|
|
ніс матері етанолом. |
|
|
|
||
Тварин, які схильні до канібалізму, обов’язково вибраковують з експерименту.
Етапи роботи з тваринами при виконанні вірусологічного експерименту
Залучення будь-яких тварин до вірусологічного експерименту вимагає обов’язкового виконання конкретних кроків. До необхідних етапів роботи з лабораторними тваринами відносять:
-підбір лабораторних тварин;
-обстеження та підготовка тварин до досліду (визначення основних параметрів нормальної життєдіяльності);
-маркування;
-наркотизація;
31
-депіляція;
-фіксація;
-зараження;
-контроль за зараженими тваринами;
-одержання патологічного матеріалу від лабораторних тварин;
-евтаназія;
-розтин лабораторних тварин.
Підбір лабораторних тварин
Для вірусологічних досліджень підбирають тварин, які повинні відповідати наступним вимогам:
1)тварини повинні бути сприйнятливими до досліджуваного захворювання чи патогену в умовах експерименту та безпосередньо відповідати поставленим цілям;
2)тварини повинні бути вільними від інфекційних та інвазійних хвороб для забезпечення чистоти експерименту;
3)тварини мають бути безумовно здоровими, знаходитися в доброму стані та бути спокійного норову;
4)тварини повинні бути потрібної ваги, віку, статі та достатньої угодованості;
5)тварини повинні легко пристосовуватися до лабораторних умов і бути зручними в поводженні.
При виборі віку тварини потрібно мати уяву про поняття “статева зрілість” та “зрілість тіла”. Статева зрілість – це досягнення твариною віку, при якому з’являються і проявляються статеві цикли. Зрілість тіла – це стан тварини, коли скінчився ріст кісток її скелету і формування внутрішніх органів.
В експерименті повинна бути задіяна певна кількість тварин для проведення статистичної обробки результатів (мінімум три).
У конкретному експерименті потрібно використовувати тварин одного визначеного виду і, навіть, певної породи. Для стандартизації умов проведення експерименту бажано використовувати тварин однакового віку, ваги та статі.
Обстеження та підготовка тварин до досліду
Більшість вірусів різних таксономічних груп можуть бути розмежовані одна від одної на основі їхнього спектру патогенності для різних видів тварин або для різних вікових категорій одного й того ж виду тварин, їхньої статі, ваги, тощо. Саме тому при підборі тварин у вірусологічний дослід проводять обстеження їх анатомічних та фізіологічних особливостей для контролю стану тварин.
32
Спочатку проводять спостереження за поведінкою тварини. Здорова тварина пересувається по клітці, п’є воду, приймає їжу, доглядає за собою згідно її виду та віку. Захворіла тварина пересувається мляво, слабко реагує на зовнішні подразнення і навіть на присутність їжі. Іноді вона, навпаки, бурхливо реагує і може бути агресивною. Таке збудження, якщо воно не є характерною ознакою якогось захворювання, через деякий час змінюється пригніченим станом.
Вік тварин визначають, головним чином, за станом зубів, шерсті та кігтей (пазурів). Наприклад, вік собак визначають за стертими коронками різців (в 5-річному віці) і всіх інших зубів (до 10-12 років). Про вік кроликів, мурчаків, пацюків, мишей можна судити за їх зовнішнім виглядом. У старих тварин шерсть рідка, без блиску, кігті (пазурі) викривлені, очі тьмяні, на зубах коричневий чи жовтий наліт.
Наступним етапом обстеження є огляд зовнішніх ознак тварини. Насамперед звертають увагу на стан волосяного покриву.
Уздорових тварин шерсть гладка, блискуча, щільно прилягає до тіла. У захворілої тварини шерсть неблискуча, ламка, скуйовджена, іноді набуває жовтуватого відтінку та неприємного запаху. Шкіра здорової тварини гладка, еластична; зібрана в складку, вона швидко й легко розправляється. Шкіра хворої тварини, зібрана в складку, розправляється повільно, іноді вона патологічно змінена. Видимі слизові оболонки у здорових тварин блідо-рожевого кольору, помірно зволожені, а у хворих – молочно-білого, яскраворожевого або червонуватого кольору, іноді вкриті серозним або гнійним слизом.
Характеризує стан тварини розміри та маса її тіла. Довжину тіла у великих та середніх тварин вимірюють антропометрами. У собак звертають увагу на їх екстер’єр: форму голови, довжину морди, особливості прикусу зубів, стан мочки носу (у здорових тварин вона завжди волога та холодна), вид шиї, спини, тощо. Часто роблять проміри окремих частин тіла.
Удрібних гризунів без патології маса щоденно збільшується.
Увеликих тварин вона залежить від віку, годування, умов утримання та стану здоров’я. Тварину перед початком експерименту зважують 2-3 рази з інтервалом у 3-5 днів. Тварин, у яких маса тіла не збільшується, в експеримент не беруть. Встановити масу тіла тварин необхідно також для обчислення дози зараження, тому що вона вимірюється кількістю вірусу на
33
одиницю ваги тіла. Крім того, є віруси, продуктивна інфекція яких призводить до зміни ваги тіла тварин. Тварин, які знаходяться в умовах тривалого експерименту, зважують 1 раз в 7-10 днів в одну і ту ж пору доби до прийняття їжі.
Наступним етапом підготовки тварин до експерименту є вимір температури тіла, який здійснюється методом ректальної термометрії. Цей показник змінюється протягом доби (вранці температура нижча), тому треба міряти температуру в один і той же час. На температуру впливають пора року та вік тварини. У дрібних лабораторних тварин у віці до 1 місяця температура тіла відповідає температурі зовнішнього середовища, коливання якої змінює температуру тіла. Не можна вимірювати температуру тварин зразу ж після їх транспортування, тому що в них в результаті цього розвивається так звана “транспортна хвороба”, яка супроводжується підвищенням температури тіла, слабкістю, адинамією. Через декілька годин ознаки її зникають і показники температури повертаються до норми. Крім того, у собак ця незвична процедура може викликати емоційний шок, результатом якого є підвищення температури тіла. В таких випадках тварину треба заспокоїти і через 20-30 хв. знову зробити термометрію. Для проведення термометрії медичний, ветеринарний або дитячий термометр зберігається в дезінфекційному розчині (10%-й розчин лізолу або денатурований спирт). Перед використанням його струшують, обтирають ватою та змащують ділянку, яка буде вводитися, вазеліном або несолоним жиром. Термометр вводять легким обертаючим рухом в просвіт прямої кишки на певну глибину: наприклад, мурчакам – на 3,5 см, собакам – на 3-4 см. Для дотримання цієї умови на скляний стовпчик одягають обмежувач – гумове кільце. Значне підвищення температури у собак, кроликів та мурчаків легко виявити, якщо доторкнутися рукою до вух та носу тварин.
Закінчивши огляд тварини та обстеження її поведінки, потрібно перевірити функціонування окремих систем життєдіяльності організму тварини.
Для цього підраховують частоту та тип дихання, його ритмічність. Частоту дихання у тварин встановлюють шляхом підрахунку числа вдихів та видихів протягом 1 хв. На неї впливають вік, темперамент, вагітність, температура та вологість повітря, ступінь наповнення шлунково-кишкового тракту, збудження, тощо. У всіх тварин дихання змішаного
34
грудочеревного типу. Патологічні процеси можуть змінювати тип дихання на грудний або на черевний.
Серцево-судинну систему обстежують, аналізуючи характер пульсу, серцевий поштовх, межі та тони серця, ритм серцевих скорочень. Пульс підраховують шляхом пальпації протягом 1 хв.
Основі показники нормальної життєдіяльності різних видів тварин наведені в таблиці 2.5.
Маркування лабораторних тварин
При виконанні вірусологічних досліджень виникає необхідність мітити тварин для їх подальшого впізнання протягом експерименту. Запропоновано цілий ряд методичних прийомів мічення, а саме: татуювання, використання радіопередавачів, мічених атомів, різнокольорових фарб, тощо.
Таблиця 2.5.
Основні показники нормальної життєдіяльності різних видів тварин
|
|
|
Коливанн |
|
|
|
|
Число |
я |
Вага |
|
Вид |
Частота |
нормальн |
Тривалість |
||
пульсу |
дихальних |
ої |
дорослої |
||
тварини |
за 1хв. |
рухів за |
температ |
тварини, |
життя, роки |
|
|
1хв. |
ури |
кг |
|
|
|
|
|
|
|
|
|
|
(°C) |
|
|
Мавпа |
140-240 |
15-30 |
37,5-39,0 |
5-30 |
дуже варіює |
|
(60-70) |
|
|
|
|
Собака |
90-140 |
10-30 |
37,5-39,0 |
30-40 |
12-20 |
Кішка |
120-180 |
20-30 |
38,0-39,5 |
3,5-4,5 |
11-15 |
Кролик |
140-360 |
50-100 |
37,7-39,8 |
2,5-6,0 |
8-12 |
Мурчак |
250-355 |
80-130 |
37,3-39,5 |
0,5-1,0 |
7-8 |
Пацюк |
286-500 |
110-150 |
37,5-39,5 |
0,3-0,45 |
3-4 |
Миша |
520-780 |
140-210 |
37,0-39,0 |
0,02-0,05 |
2-3 |
Хом’як |
120-220 |
110-140 |
|
0,15-0,18 |
1-5 |
1)Татуювання вух у злегка наркотизованих тварин, що мають достатньо великі непігментовані вушні раковини (кролики, собаки, тхорі) голландською сажею чи китайською тушшю з допомогою спеціальних татуювальних щипців або голок.
35
Татуювання використовують також для мічення мавп на внутрішньому боці верхньої третини стегна.
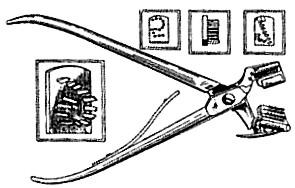
2)Таврування шляхом нанесення надрізів та насічок на достатньо великих вушних раковинах з допомогою ножиць та проколів компостерними щипцями (кролі, мурчаки, свині) (рис.2.1, 2.2.).
3)Вистригання шерсті на спині та стегнах у мавп, кроликів, тхорів, хом’яків, кішок. Цей спосіб непрактичний, тому що може використовуватись тільки при короткочасному досліді (шерсть через тиждень відростає).
4)Мітка описом характерних природних плям на поверхні тіла, коли за забарвленням шерсті одна тварина відрізняється від іншої того ж виду (мурчаки).
5)Клеймування тварин з використанням металевих жетонів, бляшок, кілець з м’якої білої жерсті зі штампованими номерами, які наносяться штампом, чи спеціальними чорнилами (до 10 мл насиченого розчину мідного купоросу додається 2 мл концентрованої сірчаної кислоти). Бляшки надягають кроликам на корінь вуха та вставляють мурчакам, як сережку, у вушну раковину. Куркам прикріплюють кільце на лапу або бирку на крило. Великим тваринам одягають нашийник з номерами на металевих жетонах. При використанні цього методу клеймування потрібно слідкувати за поведінкою тварин. Якщо предмет, застосований для мітки, дратує тварину, і протягом тривалого часу вона намагається його зняти, то це необхідно зробити експериментатору, а надалі використовувати інший спосіб маркування. У іншому разі ці тварини відгризають лапку разом з бляшкою чи кільцем.
6)Для маркування ембріонів багатоплідних тварин (мишей, пацюків) використовують введення під шкіру спеціальної забарвленої маркувальної маси (до 10 г безводного ланоліну додається 3 г чорної туші та 0,5 мл розчину антибіотику (пеніцилін або інший 5000 ОД)), яка шприцом з гострою голкою та жорстким мандреном (для штовхання маси через голку) вводять під шкіру ембріону на спині. Мітка після народження дитинчати добре помітна у вигляді плями чи смуги.
7)Кольорове маркування здійснюють шляхом нанесення різнокольорових плям на ділянки тіла тварини (альбіноси
36
мишей, пацюків та кролів) за певними схемами (приклади схем наведені на рис.2.3 та 2.5). Використовують анілінові барвники: 0,5% розчин карболового фуксину (червоний колір означає одиниці), насичений розчин пікринової кислоти (жовтий колір означає десятки), 0,5% розчин малахітового зеленого (зелений колір означає сотні), 0,5% розчин генціану фіолетового (фіолетовий колір означає тисячі). Однією фарбою можна помітити 9 тварин, двома – до 100, трьома – до 1 000, чотирма – до 10 000. Фарби наносять на непігментовану шерсть у вигляді крапель, кружечків чи смуг на спину та по боках тварини.
Для кольорового маркування за методом Тойффеля потрібний тільки один барвник для позначки 1 000 тварин. Подумки треба уявити спину тварини, розділену на 9 рівних частин, утворених трьома поздовжніми та трьома поперечними смугами. Ліва смуга використовується для позначення сотень, середня - для позначки десятків, а права - одиниць. Позначки у вигляді плям та смуг наносяться за певною схемою (рис.2.4, 2.5).
Загальним недоліком методів кольорового позначення є нестійкість барвників під час тривалих дослідів – вони знебарвлюються. Найкращим є пікринова кислота, що тримається на шерсті тварин протягом 2-3 місяців.
Рис.2.1. Компостерні щипці для таврування вушних раковин тварин.
Наркоз тварин
Перед зараженням тварин застосовують загальний наркоз або місцеве знеболювання. Для наркозу мишей, хом’яків, мурчаків, тхорів, курей, кроликів та собак використовують ефір та хлороформ, для пацюків та котів – ефір (внаслідок того, що вони погано переносять хлороформ). Техніка введення наркотизуючих
37
речовин полягає в інгаляції в замкненому просторі, або ж безпосередньо змоченим ватно-марльовим тампоном поблизу носової чи ротової порожнини.
Перед ефірним наркозом собакам та іншим великим тваринам необхідно заздалегідь ввести анальгетик для зняття переднаркотичного збудження, наприклад, 1%-й розчин пропафеніну в дозі 0,2 мл на 1 кг живої ваги інтрамускулярно. Через 30 хв інтравенозно вводять тіопентал в кількості 20 мг на 1 кг живої ваги.
Для більш тривалого наркозу (30-45 хв) можна використовувати 10%-й розчин хлоралгідрату. Метод введення для мурчаків – інтраперітонеальний у дозі 0,5 - 0,75 мл, для курей, котів та кроликів – інтравенозний в дозах 0,2-0,4 мл та 3мл, відповідно.
Мавп наркотизують тіопенталом у вигляді 5%-го розчину інтрамускулярно в дозі 1-2 мл на тварину або у вигляді 2,5%-го розчину в кількості 1,5-2 мл на тварину.
Місцеву анестезію проводять 1%-м розчином кокаїну, 5%-м розчином новокаїну по 0,5 г. Для збільшення тривалості анестезії до розчину новокаїну чи кокаїну додають 2-5 крапель розчину адреналіну у концентрації 1:1000. Для анестезії слизових
38

|
|
|
оболонок |
|
носа, |
очей, |
|||
|
|
|
порожнини рота |
чи |
прямої |
||||
|
|
|
кишки використовують 5%-й |
||||||
|
|
|
розчин кокаїну. |
|
|
|
|
||
|
|
|
Потрібно пам’ятати, що |
||||||
|
|
|
пацюки |
|
погано |
переносять |
|||
|
|
|
хлороформ; тхорі – надто |
||||||
|
|
|
чутливі до ефіру, і незначне |
||||||
|
|
|
передозування |
веде |
до |
їхньої |
|||
|
|
|
загибелі. |
|
|
|
|
|
|
|
|
|
При |
|
використанні |
||||
|
|
|
наркотизуючих |
речовин |
треба |
||||
|
|
|
дотримуватися |
обережності: |
у |
||||
|
|
|
дрібних |
лабораторних |
тварин |
||||
|
|
|
після |
|
наркозу |
|
часто |
||
|
|
|
спостерігається набряк легень і |
||||||
|
|
|
загибель. |
|
|
|
|
|
|
|
|
|
Депіляція |
|
|
|
|
||
|
|
|
Тварини, |
призначені |
у |
||||
|
|
|
дослід, |
|
повинні |
бути |
|||
|
|
|
підготовлені до нього за день. |
||||||
|
|
|
Одним |
з |
етапів |
підготовки |
|||
|
|
|
тварин є депіляція (епіляція) – |
||||||
Рис.2.2. |
Схема |
нанесення |
видалення |
волосся |
зі |
шкіри, |
|||
мітки надрізами, насічками та |
коли це необхідно за умовами |
||||||||
проколами |
вушних |
раковин |
експерименту. |
Депіляцію |
не |
||||
тварин. |
|
|
можна |
робити бритвою, тому |
|||||
|
|
що після гоління залишаються |
|||||||
|
|
|
|||||||
дрібні ураження шкіри, в які можуть попасти збудники раневих інфекцій.
Для видалення волосся існують різні депіляційні засоби : 30- 36%-й водний розчин односірчистого натрію, суміш сірчистого барію та оксиду цинку у співвідношенні 1:2; 10%-на мазь сульфату кальцію на ланоліні; сульфгідрат кальцію; сульфіт стронцію, сірчистий барій та пшеничне борошно у співвідношенні 1:1 з невеликою кількістю води до пастоподібного стану та інші. Вони зберігаються в скляному посуді з притертими пробками. Депілятор змішують з водою до утворення кашоподібної маси, яку наносять дерев’яною лопаточкою на потрібну ділянку шкіри. Через 10-15 хв.
39

її разом з шерстю знімають, оголену шкіру ретельно змивають водою та змащують вазеліном для запобігання сильного подразнення шкіри.
Фіксація тварин
Для уникнення травм (подряпин чи укусів) при проведенні дослідів лабораторних тварин потрібно фіксувати у певному положенні. Для іммобілізації тварин використовують спеціальні станки, циліндри з металу або плексигласу, утримувачі, ящики, де можна закріпити мордочки, лапки або саму тварину, фіксування руками, обгортання рушником, тощо (рис.2.6). Тварину можна фіксувати на спині або на животі.
За відсутності спеціальних пристроїв використовують підручні засоби – корнцанги, пінцети, рушники, рукавички та ін. Мишу беруть рукою, анатомічним пінцетом чи корнцангом за хвіст, а великим та вказівним пальцями іншої руки захоплюють складку шкіри біля потилиці. Пацюка фіксують з допомогою двох корнцангів, захоплюючи шкіру на потилиці одним, а шкіру хвоста іншим і
Рис.2.3. Схема нанесення барвників для кольорового маркірування тварин.
40
