
Вірусологія
.pdf70 або 100% етанолі чи метанолі. УА добре проникає в тканини тому він частіше використовується для контрастування зрізів тканин, уражених вірусами. Робота з спиртовими розчинами УА має ряд труднощів. За рахунок великої летючості спиртів при довготривалому контрастуванні на зрізах нерідко випадає осад. Окрім того, спиртові розчини УА досить агресивні: вони руйнують деякі плівки-підкладинки. Це особливо ебезпечно при монтуванні зрізів на бленди.
З іонів свинцю для контрастування біологічних об’єктів частіше за все використовується цитрат свинцю (ЦС), рідше гідрооксид свинцю, ацетат та інші солі. ЦС зв’язується з негативно зарадженими компонентами, такими як гідроксильні групи та реагуючі з осмієм частини. В цей процес залучені також фосфатні групи.
Фосфорно-вольфрамова кислота (ФВК) в залежності від рН (більше чи менше 3) забарвлює полісахариди та глікопротеіни, а також нуклеопротеіди та білки.
Метод негативного контрастування.
Негативне контрастування забезпечує отримання високого розподілу при дослідженні біологічних макромолекул та ізольованих ультраструктур. При цьому навкруги вірусу утворюється гомогенний фон речовини високої електронної щільності. Негативний контрастер збільшує контрасність біологічних часточок шляхом інфільтрації пор та нерівностей на поверхні зразку та оточення електронно-прозорого об’єкту електронно-щільним матеріалом: біологічний об’єкт має вигляд як електронно-прозора область на фоні електронно-щільного оточення. Методика проста та не вимагає багато часу. Цей метод рідко використовується для тканинних зрізів.
Розподільча здатність при негативному контрастуванні вища, ніж при позитивному. Границя розподілу визначається розміром часточок висушеного барвника. При використанні фосфорновольфрамової кислоти (ФВК) границя складає приблизно
1,2 нм.
Речовини, які використовуються для негативного контрастування, мають відповідати деяким вимогам (таб. 5.2). Поперше, вони не повинні вступати в реакцію з об’єктом. По-друге, вони повині бути добре розчинними та мати високу електронну щільність. По-третє, мати високу точку плавлення та бути
171

термічно стабільними для попередження сублімації та плавлення під електронним пучком. Речовини, які використовуються для негативного контрастування, наведено в таблиці.
Таблиця 5.2. Речовини, які використовуються для негативного контрастування.
Сіль |
Концентрація, |
Для контастування яких |
|
|
% |
структур використовується |
|
Молібденацетат |
1-3 |
Мембрани, |
субодиниці |
|
|
ферментів, клітинні фракції |
|
ФВК |
0,5-2 |
Віруси, бактерії, клітинні |
|
|
|
фракції, |
зрізи, |
|
|
макромолекули |
|
УА |
0,5-2 |
Віруси, бактерії, клітинні |
|
|
|
фракції, |
зрізи, |
|
|
макромолекули |
|
Ураніл- |
1 |
Віруси, бактерії, клітинні |
|
магнезіумацетат |
|
фракції, |
зрізи, |
|
|
макромолекули |
|
Уранілоксалат |
0,012 М |
Невеликі макромолекули |
|
Уранілформат |
0,5-2 |
Невеликі макромолекули |
|
Сутність методу полягає в тому, що біологічний об’єкт занурюють у речовину високої електронної щільності, в результаті чого малоконтрастний зразок стає більш чітким повівняно з оточуючим темним фоном. В цьому випадку отримується негативний ефект (рис.5.2. ). Частіше використовуються 1-2%-ний розчини фосфорновольфрамової кислоти (ФВК) або уранілацетату (2-5%) на дистильованій воді. Розподільча здатність цього методу вища, ніж методу віддтінення, і досягає 12 А.
Рис.5.2. Схема формування зображення об’єкту при негативному контрастуванні (Атабеков, 1980).
172
А- вид збоку; Б – вид зверху. 1 – об’єкти; 2 – розчин солі важкого металу 3 – підкладка.
Загальна схема негативного контрастування.
Успіх негативного контрастування залежить від того, чи будуть частки агрегувати та наскільки випадково вони розподілені по підкладинці. Барвник може змішуватися з розчином об’єкту до нанесення на підкладинку, або наноситися на підкладинку після адгезії до неї об’єкту. Суспендування зразків в розчині контрастеру дозволяє отримувати різну орієнтацію вивчаємих часточок на підкладинці. При звичайній процедурі негативного контрастування концентрація часточок повинна бути порядка 10-6 – 10-7 на 1 мл. Прі підборі оптимальної концентрації важливо досягти стану, щоб не було наложення часточок одна на одну.
Існують різні способи нанесення зразків на підкладинку.
Метод краплі.
На взяту пінцетом сіточку з підкладинкою наносять краплю зависі об’єкту. Через 1 хв після адсорбції об’єктів на сіточку наносять краплю розчину для негативного контрастування. Надлишок рідини видаляють фільтрувальним папером. Вміщують сіточку в контейнер. Після 15-30 хв зразок може бути досліджений в ЕМ. Можливо змішати завис зразку з барвником (1:1, по краплі) на плівці парафільму, а потім краплю суміші переносять на сіточку з підкладинкою.
Метод флотації.
Сіточку з підкладинкою вміщують на поверхню краплі вірусвмісного матеріалу об’єкту. За 1 хв об’єкт встигає адсорбуватися на поверхні підкладинки. Потім сіточку з об’єктом переносять на розташовану поруч краплю розчину негативного контрастера на 30 с та висушують.
Метод напилення.
Розчин барвника змішують з суспензією об’єкту та напиляють на підкладинку. Але при роботі з патогенними об’єктами (вірусами) така процедура являє собою велику небезпеку для здоров’я працівників. Завис матеріалу зазвичай готують в 1%-ному водному розчині контрастера та за допомогою пульвелізатора або за допомогою піпетки
173
наносять на поверхню сіточки з підкладинкою. Сіточки висихають майже миттєво, та утворюється тонка плівка барвника, яка містить в собі об’єкт.
Контрастування відтіненням
При контрастування за методом відтінення проводиться випаровування металу в вакуумі. Атоми металу розлітаються від місця випаровування по прямолінійним траєкторіям. Якщо під деяким кутом по направленню до пучка часток, що розпилюються, розташувати дослідний об’єкт, то на його поверхні буде осідати шар металу різної товщини. На ділянках, розташованих перпендикулярно до направлення льоту часток, утворюється більш товстий шар. В тих місцях, де об’єкт буде екранувати пучок часток, утворюються “тіні”. Розсіювання електронів для різних ділянок об”єкта є різним, в результаті чого контрастність зображення підвищується. В зв’язку з специфічним явищем утворення тіні кут між направленням часток, що розпилюються, і об’єктом називається “кутом віддтінення”, а сам метод - “методом відтінення”.
Артефакти, які виникають при контрастуванні.
Артефакти утворюються в основному при недостатньому або надлишковому забарвленні структур, у випадку використання старих реактивів та ін. Артефакти часто обумовлені наявністю температури повітря та вологості. Своєрідним артефактом є псевдо негативна контрасність, що іноді виникає при надлишковій обробці зрізів насиченим розчином уранілацетату.
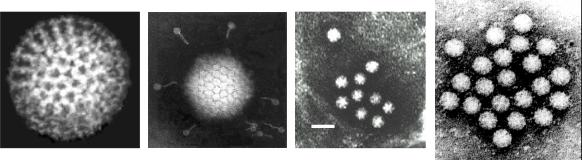
Рис. 5.3. Електронномікроскопічні зображення вірусів, отримані за допомогою негативного контрастування зліва направо: rotavirus, adenovirus, astroviruses, Norwalk-like viruses. (Linda M. Stannard, University of Cape Town)
Практична частина
174

Хід роботи
1.Чисте предметне скельце швидко занурити в розчин формвара, через 5-10 с скло витягти та підсушити (сушити слід 4060 с до зникнення запаху розчинника). Плівку, що утворилася на склі, можна виявити, якщо подихати на скло (рис. 5.4.).
2.Отриману плівку підрізати лезом бритви, потім зняти плівку на воду (скло повільно занурити у воду під кутом 450). На плівку викласти сітки і зняти їх за допомогою фільтрувального паперу. Сітки з плівкою висушуються та зберігаються в чашках Петрі.
3.На сітку з плівкою нанести краплю суспензії вірусних часток. Рідину відбирають фільтровальним папером через 30-60 с, сітку висушують.
4.На сіточку нанести краплю контрастуючої речовини і через 1 хв відбирають рідину; після просушування препарат готовий для дослідження.
5.Дослідити препарати в електронному мікроскопі.
6.Визначити розміри вірусних часточок за допомогою отриманих електронномікроскопічних знімків.
За допомогою лінійки виміряти довжину та діаметр вірусних часточок на електронній мікрофотографії. Визначити середнє значення. Порівняти отримане число з лінійкою в кутку фотографії (в 1 см кількість нанометрів). Визначити розміри часточок в нанометрах.
Рис.5.4. Приготування плівок-підкладинок з формвару. 1- предметне скельце; 2 – стаканчик з розчином формвару.
Контрольні завдання:
-Приготування плівок-підкладинок з формвару.
-Негативне контрастування препарату вірусу.
-Приготування препататів для електронної мікроскопії.
175
-Обрахунок розмірів вірусних часточок (по фото).
-Будова електронного мікроскопу;
-Схема приготування плівок підкладинок з формвару.
Контрольні запитання.
1.Мета використання електронної мікроскопії у вірусології.
2.Порівняти розподільчу здатність світлових мікроскопів з такою електронних мікроскопів.
3.Що дозволяє отримувати більшу розподільчу здатність в електронній мікроскопії?
4.Формування зображення в трансмісійному електронному мікроскопі.
5.Чим обумовлена необхідність контрастування вірусів для досліджені в ЕМ?
6.Розподільча здатність електронного мікроскопу.
7.Методи приготування препаратів.
8.Як обраховують розміри вірусів за електронномікроскопічними зображеннями?
Список літератури.
1.Вирусология. Методы. Под ред. Меихи Б.М. М.:Мир, 1988.- 344с.
2.Миронов А.А., Комиссарчик Я.Ю., Миронов В.А. Методы электронной микроскопии в биологии и медицине. С-П., Наука, 1994г.- 398с.
3.Практикум із загальної вірусології / за ред. А.Л. Бойка. –К.: Видавничий центр „Київський університет”, 2000. -269 с.
4.Практикум по общей вирусологии. Под ред. Атабекова И.Г.- М.: Университет, 1980.-191с.
5.Троценко Н.И., Белоусова Р.В., Преображенская Э.А. Практикум по ветеринарной вирусологии.- 2-е изд., перераб. и
доп. –М.: Колос, 2000.- 272 с, ил.
6.S.J. Flint et al. Principles of Virology. N-Y, ASM Press, 2000.- 579рр.
7.A.J. Cann. Molecular Virology. London, Academic Press, 2001.- 395рр.
176
РОЗДІЛ. 6. МЕТОДИ ДІАГНОСТИКИ ВІРУСНИХ ІНФЕКЦІЙ ТА ІДЕНТИФІКАЦІЇ ВІРУСІВ
Тема 1. Серологічні методи досліджень
Зміст Теоретична частина
Реакція гемаглютинації Серологічні методи дослідження Імунодифузійні тести Радіоімунологічний аналіз Імунофлуоресцентний аналіз Імуноферментний аналіз
Практична частина Практична робота №1 Хід роботи
Контрольні завдання та запитання Практична робота №2 Хід роботи
Контрольні завдання та запитання Список літератури
Теоретична частина Реакція гемаглютинації
Можливість використовувати еритроцити різноманітних тварин як індикатори, що дозволяють виявляти різні антигени або антитіла, була продемонстрована в 1902р., коли Р.Крауз та Д.Людвіг вперше показали здатність стафілококів і вібріонів викликати аглютинацію еритроцитів. Г. Херст в 1941р. помітив, що при розтині заражених грипом ембріонів кров, яка витікала з пошкоджених судин, при змішуванні з вірусвмісною алантоїсною рідиною збиралась в конгломерати з червоних кров’яних тілець.
Пізніше було показано, що багато вірусів мають гемаглютинуючі властивості, наприклад, ортоміксовіруси, параміксовіруси, рабдовіруси, поксвіруси, реовіруси, аденовіруси та інші; крім того, було виявлено, що віруси аглютинують не тільки еритроцити курей, але й інших видів птахів та ссавців (курчат, качок, голубів, чайок, морських свинок, собак, людини), завдяки чому цей метод почав широко використовуватись для ідентифікації вірусів.
177
Принцип реакції гемаглютинації заключається в тому, що аглютинація відбувається за рахунок адсорбції вірусних часток на поверхневих рецепторах еритроцитів різноманітних видів тварин (без участі в реакції специфічних антисироваток). Ця властивість зумовлена взаємодією поверхневих вірусних білків (у простих вірусів це білки капсиду, у складних – глікота ліпопротеїни суперкапсиду), які дістали назву гемаглютининів, з поверхневими білками еритроцитів (глікопротеїнами). В результаті такої адсорбції еритроцити склеюються один з одним, що призводить до утворення агрегату, який осідає на дно пробірки чи лунки планшету тонкою плівкою у вигляді перевернутої парасольки (повна аглютинація). Якщо ж реакція не відбулась, тобто в розчині відсутні гемаглютинуючі віруси, то еритроцити осідають на дно щільним осадом. Взаємозв’язок між вірусом та еритроцитами є зворотним і може наступити фаза елюції (звільнення) вірусу за допомогою вірусного ферменту нейрамінідази, яка дисоціює утворені зв’язки. Швидкість елюції залежить від ряду факторів: концентрації солей в розчині, температури, рН середовища. Здатність вірусу елюювати з еритроцитів часто використовують при роботі з вірусом грипу для його очистки та концентрації.
Реакція гемаглютинації (РГА) широко застосовується у вірусологічній практиці як швидкий, технічно простий, дешевий та достатньо надійний метод виявлення гемаглютинуючих вірусів в досліджуваному матеріалі, а також для титрування вірусів.
Умови постановки реакції гемаглютинації залежать від багатьох чинників. Різні типи вірусів, а іноді і штами одного й того ж вірусу відрізняються чутливістю до спектру еритроцитів (гемаглютинуючих видів). Наприклад, до вірусу грипу найбільш чутливі еритроцити курей, людини (0 – групи), морських свинок; до вірусів енцефаліту – еритроцити гусей; до вірусу кору – еритроцити мавп; фітовіруси активно аглютинують баранячі еритроцити. Таку видову приналежність еритроцитів часто використовують для індикації вірусів. У лабораторній діагностиці найчастіше використовують еритроцити птахів, а не ссавців, бо вони швидше аглютинуються і дають чіткий результат. Інтенсивність реакції залежить від температури та виду вірусу. Наприклад, для вірусів грипу та паротиту інтенсивність РГА найбільша при 4 – 220С, для вірусу поліоми – 40С. РГА, як правило, ставлять в ізотонічних розчинах з рН в межах 6,0 – 9,0 (наприклад,
178
0,85% NaCl). В кислому та лужному середовищах відбувається швидка інактивація гемаглютинуючих властивостей вірусу.
Для реакції використовують завис еритроцитів від 0,25 до 3%, але найбільш оптимальною є 0,5 – 1,5% завис. Для її приготування свіжоотриману кров дефібринують механічно (за допомогою стерильних намистин), або використовуючи антикоагулянти (2,5 – 5% розчин цитрату натрію, Альсевера, гепарину). Дефібриновану кров тричі відмивають центрифугуванням у фізіологічному розчині при 1000-1500 об/хв, а з осаду готують необхідну концентрацію еритроцитів. Зберігаються вони в холодильнику приблизно тиждень. В разі потреби можна використати формалінізовані еритроцити.
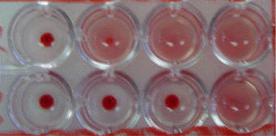
Постановка реакції складається з приготування двократних розведень вірусу на фізіологічному розчині і додавання до кожного розведення рівного об’єму зависі еритроцитів. В контролі замість розведення вірусу використовують фізіологічний розчин. Планшет струшують і залишають при певній температурі. Після визначеного часу експозиції враховують результати. За позитивний результат приймають аглютинацію еритроцитів, тобто вони вільно розміщені по дну лунки, а за негативний – компактне осідання еритроцитів у вигляді диска на дно лунки (Рис. 6.1). Позитивну реакцію оцінюють плюсами від одного до трьох відповідно, за інтенсивністю аглютинації.
Те найбільше розведення вірусвмісного матеріалу, з яким аглютинація оцінюється не менше, як на два плюси (воно відповідає приблизно 50 % аглютинованих еритроцитів), містить 1 гемаглютинуючу одиницю (1 ГАО).
1 ГАО ≈ 105 БУО (бляшкоутворюючих одиниць) ≈ 107 фізичних часток, що виявляються за допомогою електронного мікроскопу.
Рис. 6.1. Врахування результатів реакції гемаглютинації
179
Імунологічні методи дослідження
Від самого початку досліджень вірусних хвороб постала актуальна проблема їх розпізнавання й діагностики, оскільки були відсутні швидкі та надійні методи. Візуальне спостереження зовнішніх симптомів широко застосовувалось, так як прояв симптомів залежить головним чином від взаємодії вірусу і організму. Але на характер прояву симптомів впливають різноманітні фактори, що ускладнює діагностику. Саме тому було розроблено методи виявлення та використання антитіл (імуноглобулінів) для розпізнавання антигенів, тобто серологічні реакції. Ці методи досліджень, засновані на виявленні антигенної специфічності вірусів, не залежать від взаємовідносин вірусу та організму. Завдяки специфічності антитіла реагують тільки з тими антигенними детермінантами вірусного білку, у відповідь на введення якого вони утворились, або з вірусами, що подібні за антигенною структурою. При контакті специфічних антитіл з антигеном між амінокислотними залишками антигензв’язуючого центру і епітопом антигену утворюються багаточисельні нековалентні зв’язки. В порівнянні з ковалентними зв’язками сили нековалентної міжмолекулярної взаємодії (водневі зв’язки, електростатичні, ван-дер-ваальсові та гідрофобні взаємодії) досить слабкі, однак при великій кількості слабких взаємодій сумарна енергія зв’язування стає значною.
Основна структурна одиниця імуноглобуліну будь-якого класу складається з двох однакових легких і двох однакових важких поліпептидних ланцюгів, що утримуються разом дисульфідними зв‘язками (Рис. 6.2). Від типу важких ланцюгів залежить приналежність молекули імуноглобуліну до того чи іншого класу і підкласу. Так у людини чотири підкласи IgG (IgG 1, IgG 2, IgG 3 та IgG 4). Відомі також два підкласи IgА (IgА 1 та IgА 2), але підкласів IgМ, IgD та IgЕ людини не виявлено.
180
