
kompendium_po_fizike
.pdfКроме того, если имеются три равновесные системы А, В, С,
иесли системы А и В порознь находятся в равновесии с системой С, то системы А и В находятся в термодинамическом равновесии
имежду собой.
Таким образом, состояние термодинамического равновесия системы определяется не только внешними параметрами (они зависят от положения не входящих в систему внешних тел), но еще некоторой величиной, характеризующей ее внутреннее состояние. Эта величина, выражающая состояние внутреннего движения равновесной системы и имеющая одно и то же значение для всех ее частей, называется температурой.
Изложенное положение о существовании температуры, характеризующей состояние равновесной системы, представляет собой второе исходное положение термодинамики, которое иногда называют "нулевым началом". По своему физическому содержанию второй постулат термодинамики, по сути дела, выражает закон теплового равновесия. Этот закон утверждает,
что любая изолированная система тел с течением времени сама собой переходит в состояние, при котором температура всех тел системы одинакова. Такое состояние и называется состоянием теплового равновесия. Закон этот многим кажется и всегда казался очевидным, на его открытие не претендует ни один ученый, и никто не может указать дату его открытия. Поэтому он и известен как один из постулатов, на которых базируется термодинамика.
Полная энергия W системы может быть представлена как сумма двух слагаемых:
W Wц U
где Wц – часть энергии, которая зависит от движения и положения системы как целого; вторая часть (U) называется внутренней энергией системы. Внутренняя энергия включает энергию теплового движения и взаимодействия частиц, химическую энергию, ядерную энергию. Если химический состав системы в ходе энергетических преобразований остается неизменным, то при вычислении внутренней энергии системы можно учитывать только кинетическую энергию движения N частиц и потенциальную энергию их
61
N |
m |
v2 |
N |
N |
|
взаимодействия: U Ek E p |
i |
i |
ij , |
||
2 |
|||||
i 1 |
i |
j i |
|||
где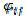 – потенциал взаимодействия i-й иj-й частиц.
– потенциал взаимодействия i-й иj-й частиц.
Внутренняя энергия системы, будучи внутренним параметром системы, есть функция внешних параметров. А так как состояние равновесия системы дополнительно характеризуется внутренним параметром, получившим название температуры, то внутренняя энергия любой равновесной термодинамической системы определяется внешними параметрами и температурой. Для простейших систем внутренняя энергия есть функция объема (внешний параметр) и температуры: U=U(V,T). В частности, для идеального газа, молекулы которого не имеют объема, внутренняя энергия зависит только от температуры: U=U(T).
Из полной энергии системы W выделяют так называемую энтальпию H системы: H=U+pV. Физический смыл энтальпии состоит в следующем: если система находится при постоянном давлении, то изменение энтальпии равно количеству теплоты,
полученной системой:
dQ H
Поэтому энтальпию иногда называют теплосодержанием системы.
3. Первое начало термодинамики и его применение к живым системам
Из определения внутренней энергии системы следует один принципиально важный вывод: внутреннюю энергию системы принципиально можно изменить двумя разными способами – путем изменения внешних параметров системы и изменением температуры системы.
Изменение внутренней энергии системы посредством изменения ее внешних параметров получило название работы. Количество энергии, переданной системе от внешних тел, или, наоборот, отобранной от системы, называется работой и в
62
общем случае выражается как dA ik X i dxi , где Xi – обобщенная
сила, хi – обобщенная координата, сопряженная с силой Xi. В случае идеального газа элементарная работа, совершаемая газом при тепловом расширении, имеет вид: dA=pdV (p – давление, V – объем).
Изменение внутренней энергии системы посредством изменения ее температуры получило название теплоты. Количество энергии, отдаваемое или получаемое системой посредством теплоты (теплообмена), получило название
количество теплоты. Таким образом, внутренняя энергия
системы может быть изменена с помощью работы и теплоты. Первое начало термодинамики представляет собой одну из форм записи сохранения энергии системы и отражает существующие два разных способа изменения внутренней энергии. Количество теплоты, переданное системе от внешних тел, может быть использовано системой для изменения ее внутренней энергии и совершения системой работы:
Q dU A
Втермодинамике существует следующее правило знаков:
количество теплоты считается положительным, если система получает энергию от внешних тел, если же система отдает энергию в форме теплоты, такое количество теплоты имеет знак «минус»;
работа считается положительной, если система ее совершает против внешних тел, если же внешние тела совершают работу над системой, такая работа считается отрицательной;
изменение внутренней энергии считается положительным, если температура системы увеличивается.
Применение первого начала термодинамики к биологическим системам никогда не вызывало сомнений. Более того, оно первоначально было сформулировано учеными Майером и Гельмгольцем именно для живых организмов. Однако классическая математическая форма первого начала была сформулирована в связи с потребностями теплотехники. Поэтому выражение первого начала (см. формулу, приведенную выше) не совсем удобно для живых организмов, так как не отражает сути
63

термодинамических процессов, протекающих в них.
В отличие от тепловых машин, живые организмы производят работу не за счет тепловой энергии (как это происходит в тепловых машинах), а посредством использования химической энергии, получаемой из продуктов питания. Поэтому изменение внутренней энергии организма может быть представлено как
dU Wпищи A Q
Для гомойотермных организмов, которые поддерживают постоянство температуры тела, dU=0 и выражение первого начала может быть записано в форме:
Wпищи A Q
Трактуется полученное равенство достаточно просто – энергия, поступающая в организм, расходуется на совершение организмом различных работ и выделение теплоты.
4. Тепловой баланс организма. Способы теплообмена
Теплота, производимая организмом в процессе жизнедеятельности, называется теплопродукцией, в биофизической литературе чаще всего обозначается буквой М.
Уравнение теплового баланса для организма имеет вид:
M QT QC QR QE 0
Здесь Q k Ti Te St – количество теплоты, переданное |
|
T |
l |
организму (отнятое у организма) посредством процесса теплопроводности; теплопроводность играет основную роль при переносе тепла через одежду;
k – коэффициент теплопроводности;
Ti, Te – температуры тела Ti и окружающей среды Te; l – толщина слоя, через который переносится тепло.
Qc – количество теплоты, переносимое перемещающейся средой, которая контактирует с организмом (воздух, жидкость). Такой способ теплообмена называется конвекцией. Математическое выражение для Qc имеет такой же вид, как и для теплопроводности, с тем лишь различием, что коэффициент k есть коэффициент конвекции, который не имеет постоянного значения и зависит от конкретных условий теплообмена.
64
Перенос тепла посредством электромагнитного излучения выражается формулой Стефана-Больцмана:
QR S(Ti4 Te4 ) ,
где S – площадь излучаемой поверхности
=5,8 10-8 Вт м-2 К-2.
Тепло, отдаваемое телом в окружающую среду посредством испарения, вычисляется по формуле:
QE Lm ,
где m – масса испарившейся жидкости, L – удельная теплота испарения (для воды L = 2,25 106 Дж/кг)
5. Энерготраты организма. Теплопродукция организма как следствие необратимости реальных процессов. Первичная и вторичная теплота организма
В биофизике и физиологии величину М в выражении теплового баланса организма M QT QC QR QE 0
называют энерготратами организма, так как она выражает количество энергии, отдаваемое организмом в окружающую среду.
Энерготраты сильно изменяются в зависимости от условий, в которых находится организм, и от характера деятельности организма. Измеряя энерготраты пациента, врач может судить о состоянии его здоровья, особенностях трудовой деятельности, диагностировать некоторые заболевания.
Для оценки функционального состояния организма необходимо создание стандартных условий при измерении его энерготрат. Для этого следует исключить влияние тех факторов, которые усиливают энергообмен (мышечная работа, прием пищи, отклонение температуры среды от зоны комфорта, эмоциональное состояние и т.д).
Энерготраты бодрствующего организма в условиях исключения действия на него факторов внешней среды, влияющих на термодинамические процессы в организме, получили название основного обмена. По своей сути основной обмен организма – это минимизированные энерготраты
65
организма.
Величина основного обмена измеряется в условиях бодрствования организма (не во время сна), пациент при этом должен спокойно лежать в постели. Процедура измерения производится рано утром (5-6 часов утра), когда интенсивность метаболиза минимальная. За 2 суток до измерения из рациона пациента исключается белковая пища, измерения проводят натощак (через 12-14 часов после последнего приема молочнорастительной пищи) в помещении с температурой 20-22 С и относительной влажностью 50-60%. Время исследования не должно превышать 15 минут.
Величина основного обмена у здоровых людей весьма постоянна. Так, у здорового мужчины среднего возраста
основной обмен составляет 1,0-1,2 ккал/(кг час), или
4,5 кДж/(кг час). При средней массе тела в 70 кг основной обмен составляет в сутки 1800 ккал, или 7800 кДж, что соответствует мощности в 90 Вт. У женщин величина основного обмена в расчете на кг массы тела на7–10% ниже, чем у мужчин. Основной обмен зависит также от возраста: чем старше человек, тем ниже значение основного обмена. У мускулистых людей основной обмен выше при одинаковой массе тела.
Теплота, выделяема организмом, получается на стадии преобразования энергии пищи в энергию АТФ (первичная теплота) и на стадии использования энергии АТФ для совершения работы организмом (вторичная теплота).
6. Прямая и непрямая калориметрия
Для определения энерготрат необходимо разработать технологию измерения теплоты, выделяемой организмом. Для этого применяют прямую и непрямую калориметрию.
В методе прямой калориметрии используют специальной конструкции физиологические калориметры, в которые на нужное время помещают животных или людей, и в которых с высокой степенью точности измеряют энерготраты организма.
При изучении энерготрат человека в ходе трудовой деятельности (например, у водителя во время проездки, рабочего
66
у станка и т.д.) используют непрямую калориметрию. Данный метод основан на измерении газообмена организма. Установлено, что между объемом потребляемого биологической системой кислорода и энерготратами существует линейная зависимость. Коэффициентом для такой зависимости служит так называемый
калорический эквивалент кислорода, равный количеству тепла,
образующемуся в организме при использовании 1 л кислорода при окислении питательных веществ.
Калорический эквивалент не одинаков при окислении белков, жиров и углеводов. О том, какие вещества преимущественно окисляются в организме, судят по так называемому
дыхательному коэффициенту ДК, который вычисляется как отношение объема, выдыхаемого CO2, к поглощаемому O2:
ДК=VCO2/VO2. ДК стремится к 1 при окислении углеводов, а при окислении жиров получают самое низкое значение ДК (ДК=0,7).
При непрямой калориметрии посредством газоанализа измеряют объемы потребляемого кислорода и выделенного углекислого газа. Далее определяют дыхательный коэффициент, по которому находят калорический эквивалент. Умножив калорический эквивалент на количество поглощенного кислорода, определяют энерготраты организма.
67
БИОЭНЕРГЕТИКА. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ И ЖИВЫЕ ОРГАНИЗМЫ
1. Свободная и связанная энергия в организме
Движение частиц в любом теле может быть упорядоченным или неупорядоченным. Между упорядоченным и неупорядоченным движениями существует принципиальная разница: упорядоченное может полностью превратиться в неупорядоченное, а переход в неупорядоченное движение в упорядоченное никогда не бывает полным. Причина различия между двумя типами движения связана с неодинаковой вероятностью каждого из них.
Внутренняя энергия в идеальном газе полностью, а в других телах в значительной части, связана с неупорядоченным тепловым движением молекул. В то же время совершение работы всегда требует переноса вещества, т.е. упорядоченного (направленного) движения. Поэтому принципиально невозможно всю внутреннюю энергию тела использовать для совершения работы.
Та часть внутренней энергии системы, которую в принципе можно использовать для совершения работы, называется свободной энергией G . Остальная часть внутренней энергии системы, которую даже в принципе нельзя превратить в работу, называется связанной энергией WCB , т.е. U G WCB .
При необратимых процессах свободная энергия не может быть преобразована в работу полностью, так как часть энергии диссипирует, а при обратимых процессах – может.
В живых организмах разновидностью свободной энергии является химическая энергия молекул dG x dv , где x –
химический потенциал (химический потенциал системы по отношению к некоторому веществу равен приросту свободной энергии системы при возрастании количества этого вещества на 1 моль).
Свободная энергия, как и полная, является функцией состояния, т.е. функцией тех условий, в которых находится система (T , p , x ).
68

2. Энтропия и её свойства
Тепловая энергия в организме представляет собой конкретную форму связанной энергии биосистемы, так как в условиях жизнедеятельности она не может быть преобразована ни в одну из форм работ, совершаемых организмом. Связанная энергия зависит от температуры (WCB ~ T ), однако связанная энергия
разных систем с одинаковой температурой не всегда одинакова, – она зависит еще и от свойств системы. Эти свойства S принято называть энтропией (от греческого «изменение», «превращение»). Тогда свободная энергия будет равна:
WCB ST , а энтропия – S WTCB
Энтропия – это физическая величина, характеризующая значение связанной энергии данной системы, приходящееся на единицу температуры (1K).
Свойства энтропии
Энергия в разных формах имеет разную практическую ценность, которая тем выше, чем большую часть этой энергии можно преобразовать в работу, а, поскольку мерой связанной энергии является энтропия, то чем ниже энтропия системы, тем выше ценность свойственной ей внутренней энергии. В организме все процессы сопряжены, т.е. организованы так, чтобы достигнуть максимума использования свободной энергии. Это достигается на клеточном уровне с помощью мембран на органном уровне за счет регуляторных систем: нервной, эндокринной, гуморальной.
Энтропия является функцией состояния системы. Это означает, что величина энтропии определяется параметрами системы в данный момент и не зависит от ее «истории», т.е. от того, как система пришла в данное состояние.
Так как энтропия – функция состояния, то изменение энтропии в обратимом процессе будет таким же и в реальном необратимом процессе, хотя затраченное количество тепла будет фактически больше, чем при обратном процессе.
Для обратимых процессов изменение энтропии равно 0, для
69
необратимых процессов – всегда больше 0. Т.е., в изолированной системе энтропия может только возрастать. Энтропия указывает направление естественных процессов – в изолированной системе они приводят к возрастанию энтропии (доля связанной энергии возрастает, свободной – уменьшается).
Энтропия системы, находящейся в равновесном состоянии, будет максимальной.
Между энтропией состояния и его вероятностью существует определенная зависимость: S k ln Pтд, где Pтд –
термодинамическая вероятность (число возможных микросостояний, которыми может быть реализовано данное макросостояние системы).
3. Второе начало термодинамики
Второе начало термодинамики говорит о направлении процессов. В простых случаях их направление можно предсказать на основании «здравого смысла». Например, тепло переходит от теплого тела к холодному, при трении механическая энергия превращается в тепловую. Однако не всегда в биофизике и биохимии можно правильно предвидеть, как будет проходить явление. Поэтому нужен алгоритм, который давал бы возможность достоверно предсказать направление процессов – это и есть второе начало термодинамики.
2-е начало термодинамики: «В изолированной системе общее изменение энтропии всегда положительно: S 0.
II начало термодинамики для биологических систем
И.П. Пригожин предположил, что полное изменение энтропии открытой системы нужно представить в виде 2-х частей: причиной первой из них ( i S ) служат внутренние процессы,
которые необратимы и непременно сопровождаются диссипацией энергии; вторая часть ( e S ) обусловлена обменом энергией и
веществом между системой и окружающей средой. Следовательно, S e S i S . Аналогичное выражение можно
написать и для изменения полной свободной энергии открытой
70
