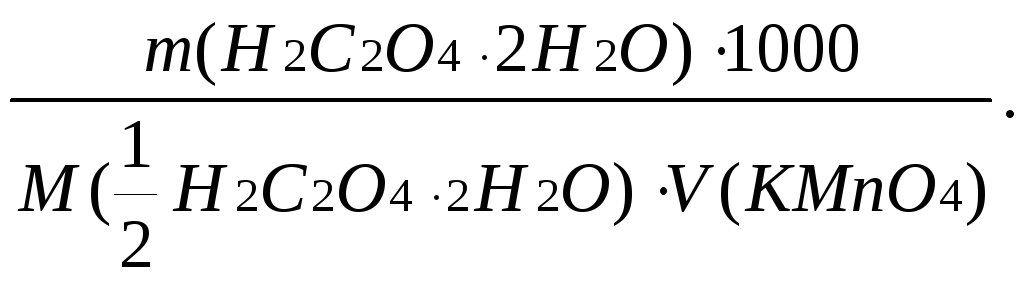- •6.0929 „ Промислова біотехнологія ”
- •6.0929 „ Промислова біотехнологія ”
- •Розділ 1. Якісний аналіз
- •Якісний аналіз неорганічних катіонів
- •Лабораторна робота №1 Якісні реакції катіонів і-іі груп.
- •Контрольні питання.
- •Якісний аналіз неорганічних аніонів
- •Реакції аніонів I аналітичної групи Реакції сульфат-іонів sо42-
- •Реакції карбонат-іонів со32-
- •Реакції фосфат-іонів ро43-
- •Реакції аніонів II аналітичної групи
- •Реакції хлорид-аніонів Сl-
- •Реакції бромід-іонів Вr-
- •Реакції йодид-іонів і-
- •Реакції аніонів III аналітичної групи
- •Реакції нітрат-аніонів no3-
- •Лабораторна робота №2 Якісні реакції катіонів ііі групи. Якісні реакції аніонів
- •Контрольні питання.
- •Лабораторна робота №3 Контрольний аналіз суміші катіонів і аніонів (невідома сіль)
- •Аналіз речовини або суміші речовин невідомого складу
- •Розділ 2. Титриметричні методи аналізу
- •Кислотно-основне титрування (метод нейтралцзації)
- •Лабораторна робота № 4 Приготування розчину соляної кислоти. Визначення концентрації соляної кислоти за титрованим розчином NаОн.
- •Контрольні питання.
- •Лабораторна робота № 5 Визначення концентрації соляної кислоти за натрій тетраборатом.
- •Контрольні питання.
- •Лабораторна робота № 6 Приготування робочого розчину натрію гідроксиду з наважки та визначення його концентрації за оксалатовою кислотою. Визначення масової частки лимонної (винної) кислоти.
- •Контрольні питання.
- •Перманганатометрія
- •Лабораторна робота № 7 Приготування та стандартизація робочого розчину kMnO4
- •Контрольні питання.
- •Йодометрія
- •Лабораторна робота № 8 Приготування титрованого розчину йоду за точною наважкою хімічно чистого препарату.
- •Лабораторна робота № 9 Приготування титрованого розчину натрію тіосульфату та визначення його точної концентрації за розчином калію біхромату.
- •Контрольні питання.
- •Лабораторна робота № 10 Йодометричне визначення міді
- •Контрольні питання.
- •Комплексонометрія
- •Лабораторна робота № 11 Приготування титрованого розчину комплексону ііі
- •Контрольні питання.
- •Лабораторна робота № 12 Трилонометричне визначення цинку
- •Контрольні питання.
- •Лабораторна робота № 13 Комплексонометричне визначення загальної жорсткості води
- •Контрольні питання.
- •Розділ 3. Фізико-хімічні методи аналізу Потенціометричний метод
- •Лабораторна робота № 14 Визначення заліза в солі Мора
- •Результати титрування заліза р-ном к2Сr2o7 концентрацією 0,1 m
- •Контрольні питання.
- •Лабораторна робота № 15 Потенціометричне титрування хлорид - та йодид - іонів
- •Контрольні питання.
- •Вольтамперометричний метод аналізу
- •1. Визначення концентрації металів за рівняння м Ільковича
- •2. Визначення концентрації методом стандартних розчинів
- •3. Визначення концентрації речовини за методом калібрувального графіка
- •4. Визначення концентрацій речовин методом добавок
- •Лабораторна робота № 16 Визначення концентрації гідрохінона
- •Контрольні питання.
- •Амперметричне титрування
- •Лабораторна робота № 17 Визначення заліза ванадатом амонію
- •Контрольні питання.
- •Фотометричний метод аналізу
- •Прилади, які використовуються для фотометрії
- •Лабораторна робота № 19 Визначення заліза (III) із сульфосаліциловою кислотою диференційним методом
- •Контрольні питання.
- •Розділ 4. Використання фізико-хімічних методів в аналізі біооб’єктів Лабораторна робота № 20 Кількісне визначення вмісту білків за нінгідриновим методом
- •Контрольні питання.
- •Хроматографічні методи
- •Список літератури
Контрольні питання.
Чому неможливо приготувати титрований розчин натрій гідроксиду розчиненням точної наважки NaOH?
Якими домішками може бути забруднений NaOH?
Розрахуйте яку наважку натрію оксалатової кислоти потрібно взяти для встановлення молярності ~1 М розчину NaOH.
За яким методом концентрація NaOH буде визначена точніше – методом пипетування чи методом окремих наважок?
Обчисліть рН в точці еквівалентності.
Чому для титрування лимонної або винної кислоти необхідно як індикатор використовувати фенолфталеїн?
Перманганатометрія
Перманганатометрія - метод, заснований на використанні калій перманганату як титранта для визначення сполук, які мають відновні властивості.
Продукти відновлення перманганат-іонів можуть бути різними, залежно від рН середовища:
•в сильнокислому середовищі: MnO4-+5ē+8Н+→Мn2++4Н2O, Е0=1,51В
•в слабколужному або нейтральному середовищі:
MnO4-+3ē+4Н2O→МnO2↓+4OH-, Е0=0,60В
Для аналізу частіш за все використовують окисні властивості MnО4--іонів в кислому середовищі, тому що продуктом їх відновлення є безбарвні іони Мn2+ (на відміну від бурого осаду МnО2), на фоні яких чітко видно забарвлення від надлишкової краплі розчину титранту.
Необхідне значення рН середовища створюють за допомогою розчину сірчаної кислоти. Інші сильні мінеральні кислоти не використовують. Так, хлороводнева кислота (HCl) при певних умовах (в присутності Fe2+-іонів) взаємодіє з KMnO4 і відбувається індуктивна реакція окиснення хлорид-іонів:
2МnО4-+16Н++10Сl-↔2Мn2++5С12+8Н2О
Тому, калії перманганат витрачається як на окислення речовини що титрується, так і на часткове окиснення Сl--іонів, тобто результати титрування виявляються завищеними.
Титрант методу - розчин калій перманганату (С1/5 KMnO4) - готують і стандартизують за стандартними речовинами: щавлевою кислотою, натрію оксалатом, арсену (Ш) оксидом, сіллю Мора тощо.
Встановлення кінцевої точки титрування виконується безіндикаторним (за забарвленням надлишку перманганат-іонів) методом.
Лабораторна робота № 7 Приготування та стандартизація робочого розчину kMnO4
Мета: Приготувати та стандартизувати робочий розчин KMnO4.
Обладнання та посуд:.
1.Бюретка, 50,0 мл;
2.Колба для титрування;
3.Мірний циліндр, 50 мл;
4.Оксалатова кислота(H2C2O4∙2H2O);
5.Сірчана кислота H2SO4 (1:4);
6.Розчин KMnO4.
Завдання:
Приготувати розчин KMnO4.
Визначити концентрацію робочого розчину KMnO4
Калій перманганат не задовольняє вимогам вихідних речовин і тому приготувати його робочий розчин виходячи з наважки немає можливості. Препарат KMnO4 завжди містить домішки MnO2 і інших продуктів його відновлення.
Розчини KMnO4 нестійкі, так як має місце реакція:
4MnO4-+2H2O![]() 4MnO2+3O2+4OH-
E0=0,187В.
4MnO2+3O2+4OH-
E0=0,187В.
Швидкість цієї реакції дуже мала, її прискорюють кислоти, основи, солі мангану (II) і, особливо MnO2 а, також нагрівання і дія світла.
Для одержання стійкого титрованого розчину KMnO4 необхідно відокремити від нього манган діоксид. Оскільки запобігти реакції між перманганатом і органічними речовинами, які є у дистильованій воді, неможливо, слід дати можливість дійти цій реакції до кінця.
Після розчинення KMnO4 у воді, розчин нагрівають для прискорення реакції і дають відстоятися. Відокремлюють осад MnO2 за допомогою скляних фільтрів або зливають розчин над осадом. Зберігають розчин KMnO4 у посуді з темного скла.
Робочий розчин KMnO4 має концентрацію близько (С1/5KMnO4)=0,1моль/л. Для приготування 1 л розчину беруть наважку m=0,1∙31,61=3,16 г, де 31,61- молярна маса еквівалента KMnO4=M(1/5KMnO4).
Визначення концентрації розчину KMnO4. Для визначення точної концентрації розчину калій перманганату використовують вихідні речовини: арсену оксид (As2O3), натрій оксалат (Na2C2O4), оксалатову кислоту (H2C2O4∙2H2O), солі заліза (II). Найчастіше використовують оксалатову кислоту або натрій оксалат. При титруванні відбувається реакція:
5C2O42-+2MnO4-+16H+→2Mn2++8H2O+10CO2
Окиснення C2O42- відбувається за схемою:
C2O42-+2ē![]() 2CO2
2CO2
Особливістю цієї реакції є те, що перші краплі розчину KMnO4 реагують дуже повільно і тільки у підігрітому до 700C розчині наступні порції титранту реагують все швидше і швидше і, нарешті, реакція стає миттєвою. Так відбуваються реакції, у яких один із продуктів є каталізатором реакції, такі реакції називаються автокаталітичними, а каталізатори – автокаталізаторами. У наведеній нами реакції автокаталізаторами є іони Mn2+.
Наважку оксалатової кислоти для титрування за методом окремих наважок обчислюють, виходячи із рівності кількостей моль-еквівалентів реагуючих речовин.
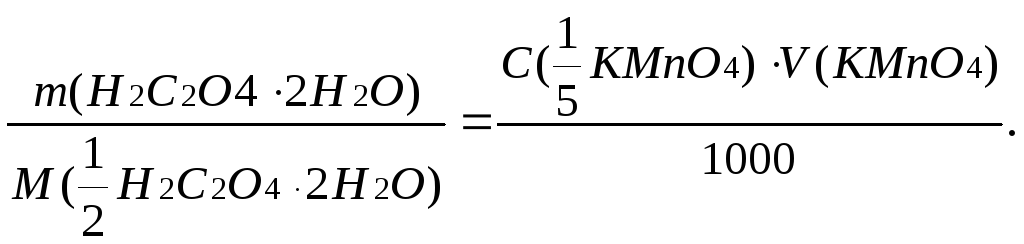
m(H2C2O4∙2H2O)=![]()
де 20 - приблизний об’єм розчину KMnO4 в мл, витрачений на титрування при користуванні бюреткою місткістю 50,0 мл; 63,04- молярна маса еквівалента H2C2O4·2H2O=M(1/2 H2C2O4·2H2O).
Хід аналізу. Наважку оксалатової кислоти близько 0,126 г розчиняють у 40см3 води, добавляють 10 мл розчину H2SO4 (1:4), нагрівають суміш до 70-800C. Титрують гарячий розчин розчином KMnO4 до появи рожевого забарвлення. Титрування повторюють 2-3 рази. Обчислюють концентрацію розчину калій перманганату.
C(![]() KMnO4)=
KMnO4)=