
- •6.0929 „ Промислова біотехнологія ”
- •6.0929 „ Промислова біотехнологія ”
- •Розділ 1. Якісний аналіз
- •Якісний аналіз неорганічних катіонів
- •Лабораторна робота №1 Якісні реакції катіонів і-іі груп.
- •Контрольні питання.
- •Якісний аналіз неорганічних аніонів
- •Реакції аніонів I аналітичної групи Реакції сульфат-іонів sо42-
- •Реакції карбонат-іонів со32-
- •Реакції фосфат-іонів ро43-
- •Реакції аніонів II аналітичної групи
- •Реакції хлорид-аніонів Сl-
- •Реакції бромід-іонів Вr-
- •Реакції йодид-іонів і-
- •Реакції аніонів III аналітичної групи
- •Реакції нітрат-аніонів no3-
- •Лабораторна робота №2 Якісні реакції катіонів ііі групи. Якісні реакції аніонів
- •Контрольні питання.
- •Лабораторна робота №3 Контрольний аналіз суміші катіонів і аніонів (невідома сіль)
- •Аналіз речовини або суміші речовин невідомого складу
- •Розділ 2. Титриметричні методи аналізу
- •Кислотно-основне титрування (метод нейтралцзації)
- •Лабораторна робота № 4 Приготування розчину соляної кислоти. Визначення концентрації соляної кислоти за титрованим розчином NаОн.
- •Контрольні питання.
- •Лабораторна робота № 5 Визначення концентрації соляної кислоти за натрій тетраборатом.
- •Контрольні питання.
- •Лабораторна робота № 6 Приготування робочого розчину натрію гідроксиду з наважки та визначення його концентрації за оксалатовою кислотою. Визначення масової частки лимонної (винної) кислоти.
- •Контрольні питання.
- •Перманганатометрія
- •Лабораторна робота № 7 Приготування та стандартизація робочого розчину kMnO4
- •Контрольні питання.
- •Йодометрія
- •Лабораторна робота № 8 Приготування титрованого розчину йоду за точною наважкою хімічно чистого препарату.
- •Лабораторна робота № 9 Приготування титрованого розчину натрію тіосульфату та визначення його точної концентрації за розчином калію біхромату.
- •Контрольні питання.
- •Лабораторна робота № 10 Йодометричне визначення міді
- •Контрольні питання.
- •Комплексонометрія
- •Лабораторна робота № 11 Приготування титрованого розчину комплексону ііі
- •Контрольні питання.
- •Лабораторна робота № 12 Трилонометричне визначення цинку
- •Контрольні питання.
- •Лабораторна робота № 13 Комплексонометричне визначення загальної жорсткості води
- •Контрольні питання.
- •Розділ 3. Фізико-хімічні методи аналізу Потенціометричний метод
- •Лабораторна робота № 14 Визначення заліза в солі Мора
- •Результати титрування заліза р-ном к2Сr2o7 концентрацією 0,1 m
- •Контрольні питання.
- •Лабораторна робота № 15 Потенціометричне титрування хлорид - та йодид - іонів
- •Контрольні питання.
- •Вольтамперометричний метод аналізу
- •1. Визначення концентрації металів за рівняння м Ільковича
- •2. Визначення концентрації методом стандартних розчинів
- •3. Визначення концентрації речовини за методом калібрувального графіка
- •4. Визначення концентрацій речовин методом добавок
- •Лабораторна робота № 16 Визначення концентрації гідрохінона
- •Контрольні питання.
- •Амперметричне титрування
- •Лабораторна робота № 17 Визначення заліза ванадатом амонію
- •Контрольні питання.
- •Фотометричний метод аналізу
- •Прилади, які використовуються для фотометрії
- •Лабораторна робота № 19 Визначення заліза (III) із сульфосаліциловою кислотою диференційним методом
- •Контрольні питання.
- •Розділ 4. Використання фізико-хімічних методів в аналізі біооб’єктів Лабораторна робота № 20 Кількісне визначення вмісту білків за нінгідриновим методом
- •Контрольні питання.
- •Хроматографічні методи
- •Список літератури
Контрольні питання.
Суть йодометричного метода визначення міді.
Для чого необхідно надлишок калію йодида?
З чим пов’язані помилки в йодометрії?
Як обчислити вміст міді за результатами титрування?
Комплексонометрія
Комплексонометрія ґрунтується на реакціях утворення комплексів. Титрування з використанням полідентантатних органічних реагентів називають комплексонометрією, а самі реагенти - комплексонами. В практиці використовують добре розчинну (108 г/л при 22оС) динатрієву сіль етилендіамінтетраоцтової кислоти Na2H2Y 2H2O (комплексон ІІІ), де Y4- - аніон поліамінокарбонової кислоти. Цей реагент широко відомий під торговою назвою – трилон Б.
Лабораторна робота № 11 Приготування титрованого розчину комплексону ііі
Мета: Приготувати розчин комплексону ІІІ. Встановити нормальність трилону Б.
Обладнання та посуд:.
1.Бюретка, 50,0 мл;
2.Колба для титрування;
3. Мірна колба, 250 мл
4.Мірний циліндр, 25мл;
5. Піпетка на 25 мл;
6. Аміачна буферна суміш.
7.Сульфат магнію MgSO4;
8. Розчин трилону Б невідомої концентрації;
9. Індикатор - еріхром чорний Т.
Завдання:
Приготувати розчин комплексону ІІІ.
Встановити нормальність трилону Б.
Принцип методу. Двозаміщена натрієва сіль етилендіамінтетраоцтової кислоти не є вихідною речовиною (Na2H2C10H12O8N2 2H2O).

Спочатку готують розчин приблизної концентрації, а потім, титруванням робочим розчином MgSO4 або ZnSO4 визначають точну концентрацію. Використовують в якості індикатора еріхром чорний (ЕХЧ-Т), який відноситься до барвників групи 0,0-діоксіазонафталіну:

рК 6,3 рК 11,5
![]()
червоний
синій жовто-оранжевий![]()
Індикатор застосовують при титруванні металів в інтервалі рН=7-11, у цьому інтервалі рН індикатор має синє забарвлення, а комплекси з металами Mg2+, Ca2+, Zn2+ та інші-червоне забарвлення.
Кінець титрування визначається за зміною забарвлення від червоного до синього кольору:
![]()
![]()
де Y4- -аніон етилендіамінтетраоцетової кислоти.
Розрахунки. Для приготування 1л 0,1 М розчину необхідно взяти наважку Na2H2C10H12O8N2∙2H2O
![]() г.
г.
Хід аналізу .Наважку солі MgSO4∙7H2O близько 3,1 г переносять у мірну колбу ємкістю 250,0 мл. Розчиняють сіль водою і наповнюють колбу дистильованою водою до риски. Відбирають піпеткою 25,0 мл розчину і переносять його у колбу для титрування, добавляють 5 мл аміачного буферного розчину і невелику кількість індикатора еріхром чорного Т. Суміш нагрівають до 600 С і титрують розчином комплексну ІІІ, концентрацію якого визначають, до зміни забарвлення розчину від черво-фіолетового до синього. Поблизу точки еквівалентності, розчин титранта добавляють по краплям і ретельно переміщують розчин. За результатами титрування обчислюють концентрацію розчину комплексону ІІІ.
C(Na2H2C10H12O8N2
2H2O)=

Контрольні питання.
Суть метода визначення нормальності трилону Б.
Обчисліть масу наважки вихідної речовини.
Який механізм дії індикатора еріхром чорного Т?
Як обчислити нормальність трилону Б за результатами титрування?
Лабораторна робота № 12 Трилонометричне визначення цинку
Мета: Обчислити вміст цинка в досліджуваному розчині.
Обладнання та посуд:.
1.Бюретка, 50,0 мл;
2.Колба для титрування;
3. Титрований розчин трилону Б
4.Мірний циліндр, 50мл;
5. Ацетатний буфер (рН=5,5)
6. Індикатор – ксиленоловий оранжевий.
Завдання:
1. Обчислити вміст цинка в досліджуваному розчині.
Принцип методу. Цинк реагує з трилоном з утворенням стійкої безбарвної внутрішньо комплексної сполуки. Досліджуваний розчин, що містить іони цинку, титрують трилоном Б в ацетатному буферному розчині рН=5,5. Точку еквівалентності визначають за допомогою індикатора – ксиленолового оранжевого, аніон якого має будову


а) б)
Рис. 1 Комплексна сполука цинку з Трилоном Б (а), ксиленоловий оранжевий (б)
При додаванні ксиленолового оранжевого до розчину, що містить цинк, цинк частково зв’язується з індикатором, і розчин забарвлюється у червоний колір:
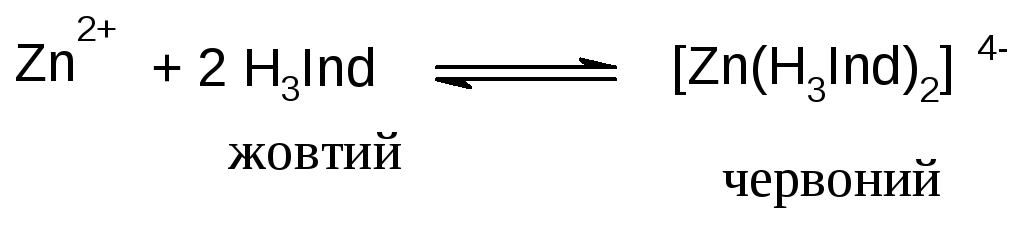
При титруванні трилоном послідовно перебігають реакції:

Хід аналізу. До досліджуваного розчину додають 10 мл ацетатного буферного розчину та 30 мл дистильованої води. Додають декілька кристаликів індикатору, при цьому розчин забарвлюється у червоний колір. Ретельно перемішуючи розчин починають титрувати Трилоном Б до переходу забарвлення розчину в жовтий колір. Розрахунки ведуть за формулою:
![]()
