
- •6.0929 „ Промислова біотехнологія ”
- •6.0929 „ Промислова біотехнологія ”
- •Розділ 1. Якісний аналіз
- •Якісний аналіз неорганічних катіонів
- •Лабораторна робота №1 Якісні реакції катіонів і-іі груп.
- •Контрольні питання.
- •Якісний аналіз неорганічних аніонів
- •Реакції аніонів I аналітичної групи Реакції сульфат-іонів sо42-
- •Реакції карбонат-іонів со32-
- •Реакції фосфат-іонів ро43-
- •Реакції аніонів II аналітичної групи
- •Реакції хлорид-аніонів Сl-
- •Реакції бромід-іонів Вr-
- •Реакції йодид-іонів і-
- •Реакції аніонів III аналітичної групи
- •Реакції нітрат-аніонів no3-
- •Лабораторна робота №2 Якісні реакції катіонів ііі групи. Якісні реакції аніонів
- •Контрольні питання.
- •Лабораторна робота №3 Контрольний аналіз суміші катіонів і аніонів (невідома сіль)
- •Аналіз речовини або суміші речовин невідомого складу
- •Розділ 2. Титриметричні методи аналізу
- •Кислотно-основне титрування (метод нейтралцзації)
- •Лабораторна робота № 4 Приготування розчину соляної кислоти. Визначення концентрації соляної кислоти за титрованим розчином NаОн.
- •Контрольні питання.
- •Лабораторна робота № 5 Визначення концентрації соляної кислоти за натрій тетраборатом.
- •Контрольні питання.
- •Лабораторна робота № 6 Приготування робочого розчину натрію гідроксиду з наважки та визначення його концентрації за оксалатовою кислотою. Визначення масової частки лимонної (винної) кислоти.
- •Контрольні питання.
- •Перманганатометрія
- •Лабораторна робота № 7 Приготування та стандартизація робочого розчину kMnO4
- •Контрольні питання.
- •Йодометрія
- •Лабораторна робота № 8 Приготування титрованого розчину йоду за точною наважкою хімічно чистого препарату.
- •Лабораторна робота № 9 Приготування титрованого розчину натрію тіосульфату та визначення його точної концентрації за розчином калію біхромату.
- •Контрольні питання.
- •Лабораторна робота № 10 Йодометричне визначення міді
- •Контрольні питання.
- •Комплексонометрія
- •Лабораторна робота № 11 Приготування титрованого розчину комплексону ііі
- •Контрольні питання.
- •Лабораторна робота № 12 Трилонометричне визначення цинку
- •Контрольні питання.
- •Лабораторна робота № 13 Комплексонометричне визначення загальної жорсткості води
- •Контрольні питання.
- •Розділ 3. Фізико-хімічні методи аналізу Потенціометричний метод
- •Лабораторна робота № 14 Визначення заліза в солі Мора
- •Результати титрування заліза р-ном к2Сr2o7 концентрацією 0,1 m
- •Контрольні питання.
- •Лабораторна робота № 15 Потенціометричне титрування хлорид - та йодид - іонів
- •Контрольні питання.
- •Вольтамперометричний метод аналізу
- •1. Визначення концентрації металів за рівняння м Ільковича
- •2. Визначення концентрації методом стандартних розчинів
- •3. Визначення концентрації речовини за методом калібрувального графіка
- •4. Визначення концентрацій речовин методом добавок
- •Лабораторна робота № 16 Визначення концентрації гідрохінона
- •Контрольні питання.
- •Амперметричне титрування
- •Лабораторна робота № 17 Визначення заліза ванадатом амонію
- •Контрольні питання.
- •Фотометричний метод аналізу
- •Прилади, які використовуються для фотометрії
- •Лабораторна робота № 19 Визначення заліза (III) із сульфосаліциловою кислотою диференційним методом
- •Контрольні питання.
- •Розділ 4. Використання фізико-хімічних методів в аналізі біооб’єктів Лабораторна робота № 20 Кількісне визначення вмісту білків за нінгідриновим методом
- •Контрольні питання.
- •Хроматографічні методи
- •Список літератури
Лабораторна робота №1 Якісні реакції катіонів і-іі груп.
Мета: ознайомитися із якісними реакціями на катіони І-ІІ груп у розчинах та мікрокристалоскопічно.
Обладнання та посуд: набір реактивів для проведення якісних реакцій на катіони, пробірки, предметне скло, скляна паличка, мікроскоп, центрифуга, електрична плитка.
Завдання:
1. У даній лабораторній роботі пропонується виконати наступні якісні реакції катіонів I-ІІ груп
2. Провести систематичний аналіз суміші катіонів I-ІІ груп. Рівняння реакцій записати в лабораторний журнал.
Контрольні питання.
Які групові реагенти використовують для відкриття І та ІІ аналітичної групи катіонів?
За допомогою яких реакцій можна визначити катіони K+, Na+? Наведіть приклади реакцій.
За допомогою яких реакцій можна визначити катіони NH4+? Наведіть приклади реакцій.
За допомогою яких реакцій можна визначити катіони Ва2+, Ca2+, Mg2+, Mn2+?
За допомогою яких реакцій можна визначити катіони Sr2+, Аl3+, Cr2+, Bi2+?
За допомогою яких реакцій можна визначити катіони Fe2+, Fe3+?
Опишіть особливості аналізу суміші І та ІІ групи катіонів.
Катіони третьої аналітичної групи Cu2+, Cd2+, Hg2+, Co2+, Ni2+, Zn2+
Груповим реактивом є гідроксид амонію NH4OH, який в стехіометричних кількостях осаджує їх у вигляді гідроксидів, основних солей та амідів. При надлишку гідроксиду амонію вони розчиняються, тоді як фосфати катіонів другої аналітичної групи в надлишку аміаку нерозчинні. Більшість солей катіонів третьої групи малорозчинні у воді та багато з них забарвлені. Так розчинними є хлориди, окрім хлориду одновалентної міді, сульфати, нітрати, нітрити, ацетати. Малорозчинними є всі гідроксиди, гексаціаноферати (II, III), карбонати, оксалати, фосфати, арсенати, силікати, хромати, сульфіди. Забарвленими сполуками є всі солі та гідроксиди міді (II), кобальту, нікелю, ртуть йодид, всі сульфіди, за винятком цинк сульфіду, білого кольору, а також солі, що утворені забарвленими аніонами.
Реакції іонів Cu2+
Реакція з калій гексаціанофератом (II, III) K4Fe(CN)6], K3Fe(CN)6].
Іони Си2+ з калій гексаціанофератом (II) утворюють червоно-бурий осад гексаціоноферату міді (ІІ) Cu2[Fe(CN)6]:
![]()
Осад не розчиняється в розведених кислотах, розкладається лугами, внаслідок чого утворюється блакитний осад гідроксиду міді (II) i розчиняється в розчині NH4OH з творенням аміакату міді:

Взаемодія іонів Сu2+ з калій гексаціанофератом (III) K3[Fe(CN)6] приводить до утворення жовто-зеленого осаду Cu3[Fe(CN)6]:
![]()
Осад не розчиняється в хлорид ній кислоті, але розчиняється в розчині аміаку.
Реакція з тіосульфтом натрію Na2S2O3. Сu2+- іони з тіосульфатом натрію в кислому середовищі при нагріванні утворюють чорний осад Cu2S:

Цю реакцію використовують для відокремлення Сu2+-іонів від іонів Сd2+, оскільки іони кадмію при дії Н2S2О3 в кислому середовищі осаду СdS не утворюють.
Виконання
реакції. До
10-15 крапель розчину в пробірці добавляють
2 н. розчин
Н2SО4
до кислої реакції (рН![]() 2),
2-3 кристаликаNa2S2O3
і суміш нагрівають
до кипіння.. В присутності іонів Сu2+
утворюється чорний осад Cu2S.
2),
2-3 кристаликаNa2S2O3
і суміш нагрівають
до кипіння.. В присутності іонів Сu2+
утворюється чорний осад Cu2S.
Дія калій йодиду КI. Іони Сu2+ окиснюють I--іони, при цьому Сu2+-іони відновлюються до міді (І), яка утворює білий осад СuI і виділяється вільний І2, який забарвлює розчин з осадом в бурий колір:
![]()
Дія калій тіоціанату КSСN. При взаємодії іонів Сu2+ з SCN--іонами утворюється чорний осад тіоціанату міді (IІ) Сu(SCN)2:
![]()
Осад Сu(SCN)2 поступово перетворюється в малорозчинний СuSCN білого кольору, при цьому виділяється родан (SCN)2.
![]()
Якщо до розчину добавити відновник, наприклад Na2S2O3, то відновлення Сu(ІІ)до Сu(І) в осаді відбувається досить швидко і швидко змінюється забарвлення осаду від чорного до білого:
![]()
Дія амоній, тетрародано (тетратіоціанато) меркурата (II) (NH4)2[Hg(SCN)4] Іони Сu2+ в присутності іонів Zn2+ з амоній тетрароданомеркуратом (II) (NH4)2[Hg(SCN)4] утворюють осад Cu[Hg(SCN)4]Zn[Hg(SCN)4], забарвлений у фіолетовий колір:
![]()
Реакції заважають іони Fе3+, Со2+, Ni2+, які за аналогічних умов утворюють забарвлені розчини.
Виконання реакції. До 1 краплі розчину у пробірку додають 2 - 3 краплі 1%-го розчину цинку сульфату ZnSO4, 1 - 2 краплі 2 н. розчину Н2SО4 i 1 краплю розчину (NH4)2[Hg(SCN)4] (8 г НgCl2 і 9 г NH4SCN розчиняють в 100 мл води). Суміш перемішують скляною паличкою. Поява осаду фіолетового кольору свідчить про присутність іонів Сu2+ в розчині.
Відновлення іонів Сu2+ металами: залізом, цинком, алюмінієм та іншими. Маючи досить високий окисно-відновний потенціал Е(Сu2+∕Сu0)=+0,34В іони Сu2+ відновлюються до Сu0 (металічної) металами, для яких окисно-відновні потенціали характеризуються меншими позитивними величинами: залізом, цинком; алюмінієм. Для них величини
![]() ;
;
![]() ;
;![]() .
.
Тому, якщо занурити залізний цвях в розчин, в якому знаходяться іони Сu2+, то останні відновлюються до металу і червоним осадом покривають залізний цвях:
![]()
Реакції іонів Сu2+ з NH4OH, (NН4)2[Нg(SСN)4]+ZnSO4 та металічним залізом є характерними і їх застосовують для виявлення іонів Сu2+ в присутності інших металів.
Загальні реакції катіонів III третьої аналітичної групи. Дія гідрофосфатів лужних металів і амонію призводить до утворення білих осадів кадмію, цинку, ртуті (II), зелених – нікелю, фіолетових – кобальту, голубих – міді.
![]()
![]()
Осади гідрофосфатів і фосфатів катіонів III групи розчиняються в оцтовій і мінеральних кислотах:

Всі фосфати іонів III групи розчиняються в NH4OH, гідрофосфат та фосфат цинку розчиняється в розчині лугів:
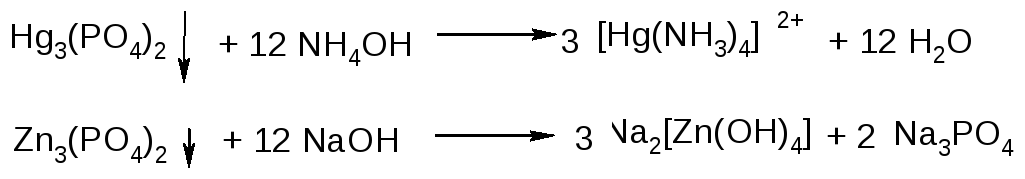
Дія NН4ОН. Водний розчин аміаку осаджує Со(ОН)2 рожевого кольору, Ni(OH)2 зеленого кольору, Сd(ОН)2 і Zn(ОН)2 білого кольору, Сu(ОН)2 - зеленувато-синього кольору. Солі ртуті (II) утворюють білий осад НgNН2Сl амідосполуки. Гідроксиди металів і НgNН2С1 в надлишку NH4OH розчиняються і утворюють розчинні у воді аміакати: [Со(NН3)6]2+- брудно-жовтого, [Ni(НN3)6]2+-синього кольору, [Сu(NН3)6]2+-інтенсивно синього кольору, [Сd(NН3)4]2+[Zn(NН3)6]2+[Hg(NН3)4]2+-у водних розчинах безбарвні.
![]()
На повітрі розчин з [Со(NН3)6]2+-іонами поступово червоніє внаслідок окиснення і утворення аміачного комплексу кобальту (III):
4[Co(NH3)6]2++O2+2H2O↔4[Co(NH3)6]3++4OH-
Кислоти руйнують аміакати, при цьому утворюються NН4+-іони
[Co(NH3)6]2++6H+↔Co2++6NH4+
Дія розчинів лугів NаОH, КОН. Розчини лугів осаджують гідроксиди Со(ОН)2 Ni(ОН)2, Zn(ОН)2, Сd(ОН)2, Сu(ОН)2, Нg(ОН)2. Гідроксид ртуті (II) є нестійкою сполукою, яка розкладається з утворенням НgО жовтого кольору:
Hg(OH)2↓↔HgO↓+H2O
При дії NаОН+Н2O2 випадає гідроксид кобальту (III) Со(ОН)3. Внаслідок амфотерності Zn(ОН)2 розчиняється в надлишку лугу:
Zn(ОН)2↓+2ОН-↔[Zn(ОН)4]2-
В концентрованих лугах частково розчиняється і Сu(ОН)2 утворенням купритів:
Сu(ОН)2↓+2ОН-↔[Сu(ОН)4]2-
Дія карбонатів калію, натрію або амонію (МН4)2СО3. Розчини карбонатів лужних металів та амонію осаджують основні карбонати катіонів III групи: (СоОН)2СО3 - рожевою кольору, (NіОН)2СО3 - зеленого кольору, (ZnОН)2СО3 - білого кольору, (СoОН)2СО3 - білого кольору, (СuОН)2СО3 - зеленого кольору, (HgOH)2CO3 – червоного кольору.
Осади основних карбонатів катіонів III групи розчиняються в кислотах і pозчинах NH4OH:

Дія сірководню H2S або амоній сульфіду (NH4)2S Сірководень та його солі утворюють з катіонами III групи осади сульфідів: СоS, NiS, СuS, НgS - чорного кольору, СdS - жовтого кольору, ZnS — білого кольору.
![]()
Сульфід цинку ZnS легко розчиняється в розведених мінеральних кислотах (ДРZnS=1,2∙10-23), сульфіди СоS, NiS і СdS розчиняються у відносно концентрований НСl і Н2S04 (ДРCoS =2∙10-27, ДPNiS =2∙10-28, ДРCdS=3,6∙10-29), сульфід міді (II) СuS розчиняється в концентрованій HNO3 (ДРCuS=8,5 ∙10-45).
Дія окисників і відновників. До III групи відносяться катіони, які не дуже схильні до зміни своєї валентності, тому реакції окиснення-відновлення не характерні для них. Тільки при дії таких сильних окисників, як хлор, бром, гіпохлорит, гіпоброміт в лужному середовищі можна окиснювати Со2+ до Со3+, та при певних умовах іони Nі2+ бути окиснені до Nі3+-іонів. При певних умовах і при дії певних реактивів можна відновити іони Нg2+ до Нg22+ - іонів і навіть до металічної Нg, а також і Сu2+-іони до Сu+- іонів і до Сu0.
А сульфід ртуті (II) HgS (ДРНgS=4∙10-53) не розчиняється навіть в концентрованій HNO3, але розчиняється в суміші концентрованих НСІ+HNO3 або суміші НС1+Н2О2

Реакції іонів Со2+
Дія калій гексаціаноферату (II, III) К4[Fе(СN)6], К3[Fе(СN)6]. Калій гексаціаноферат (II) при взаємодії з іонами Со2+ утворює зеленуватий кобальт гексаціаноферат (II) Со2[Fе(СN)6].
Калій гексаціаноферат (III) при взаємодії з іонами Со2+ утворює бурувато-червоний кобальт гексаціаноферат (III) Со3[Fе(СN)6]2.
Дія амоній тіоціанату NH4SCN (КSСN). Тіоціанат-іони SCN- з іонами Со2+ утворюють забарвлену в синій колір комплексну сполуку (NН4)2[Со(SCN)4]:
![]()
Реакцію виконують в присутності ацетону або амілового спирту, в середовищі яких зменшується дисоціація комплексних іонів [Со(SCN)4]2- на іони Со2+ і SCN- і забарвлення внаслідок цього стає більш інтенсивним. Цій реакції заважають іони Fe3+ які з тіоціанат - іонами утворюють комплексну сполуку Fе(SCN)3, забарвлену в інтенсивно червоний колір і тому маскують забарвлення тіоціанатного комплексу кобальту. Тому, якщо в розчині присутні іони заліза, їх зв’язують в більш стійкий безбарвний комплекс [FеF6]3- додаванням амоній або натрій фториду.
Виконання реакції. До 2-3 крапель розчину, в якому виявляють іони Со2+, добавляють 2-3 кристалика сухої солі або 3-5 крапель насиченого розчину NH4SCN або KSCN, 8-10 крапель амілового спирту і суміш в пробірці збовтують. Забарвлення неводного шару в інтенсивно синій колір свідчить про наявність іонів Со2+ в розчині.
Замість амілового спирту до розчину можна добавити 10-15 см3 ацетону, при цьому в присутності іонів Со2+ весь розчин забарвлюється в синій колір.
Якщо розчин забарвлюється в червоний колір, то краплинами до розчину вносять насичений розчин NaF до зникнення червоного забарвлення. Синій колір розчину свідчить про наявність іонів Со2+.
Дія амоній тетрароданомеркурата (II) (NH4)2[Hg(SCN)4] Амоній тетрароданомеркурат (II) з іонами Со2+ утворює осад Со[Нg(SCN)4] синього кольору. У присутності іонів Zn2+ випадає осад блакитного кольору, склад якого відповідає формулі Со[Hg(SCN)4]Zn[Hg(SCN)4]
Виконання реакції. До 1-2 крапель слабкокислого розчину добавляють 1 краплю розчину цинку, 2-3 краплі розчину (NH4)2[Hg(SCN)4] і збовтують суміш. Поява осаду блакитного кольору свідчить про присутність іонів Со2+.
Дія а-нітрозо-р-нафтолу

Іони Со2+ окиснюються (α-нітрозо-β-нафтолом до кобальту (III), який і утворює осад Со(С]0Н6NОО)3 червоно-бурого кольору. Осад не розчиняється в мінеральних кислотах.
Аналогічні реакції дають іони Fе3+ ,Сu2+, Нg2+. Але осади цих металів, на відміну від осаду кобальту з α-нітрозо-β-нафтолом, розчиняються в мінеральних кислотах.
Виконання реакції. До 2 - 3 крапель розчину додають 3 - 4 краплі 6 н. розчину НС1 і нагрівають суміш до кипіння. Потім в гарячий розчин добавляють 3 - 4 краплі свіжоприготовленого насиченого розчину реактиву в 50% оцтовій кислоті і знову нагрівають. У присутності іонів Со2+ випадає червоно-бурий осад або розчин забарвлюється в червоний колір.
Дія нітриту калію KNO2. Нітрит калію, добавлений в надлишку до не дуже розбавленого розчину солі Со2+, підкисленого оцтовою кислотою, утворює жовтий кристалічний осад К3[Со(N02)6]:
![]()
Виконання реакції. До 2 - 3 крапель розчину добавляють 5 - 8 крапель 10% розчину КNO2 або суміші NaNО2 і КС1, 3 - 5 крапель 2 н. розчину оцтової кислоти і суміш збовтують. Поява жовтого кристалічного осаду свідчить про присутність іонів Со2+.
Утворення перлів бури (реакція сухим способом).
При сплавленні сполук кобальту з бурою Na2В4О7∙10H2O утворюються перли синього кольору. Великі кількості нікелю заважають реакції тому, що забарвлюють перли в бурий колір.
Виявлення іонів Co2+ в суміші катіонів всіх аналітичних груп. До 2 - 3 крапель розчину вносять кристалик NН4СSN і 10 крапель амілового спирту.
Суміш збовтують. Якщо шар амілового спирту забарвлюється в червоний колір (наявність Fе3+-іонів), то в розчин вносять декілька кристаликів NaF до зникнення червоного кольору. В присутності Со2+-іонів шар амілового спирту забарвлюється в синій колір.
Реакції іонів Nі2+
Дія калій гексаціаноферату (II, III) К4[Fe(CN)6] К3[Fe(CN)6] Калій гексаціаноферат (II) утворює з іонами Ni жовто-зелений осад нікель гексаціаноферату (II) Nі2[Fе(СN)6], який не розчиняється в кислотах, але розчиняється в концентрованому розчині аміаку:
Калій гексаціаноферат (III) утворює з іонами Ni2+ жовто-бурий осад нікель гексаціаноферату (III) Ni3[Fе(СN)6]2:

![]()
Реакція з диметилгліоксимом. Іони нікелю в аміачному середовищі (рН=9) утворюють з диметилгліоксимом червоний осад внутрішньо комплексної солі диметилгліоксимату нікелю. Реакції заважають іони Fе2+ і Сu2+
Виконання реакції. 2-3 краплі розчину містять в пробірку, добавляють 1-2 краплі розчину NН4ОН, 2 краплі 1% спиртового розчину диметилгліоксиму. В присутності Nі2+- іонів випадає червоний осад:

Утворення перлів бури (реакція сухим способом). При сплавленні сполук нікелю з бурою Na2В4О7∙10Н2О утворюються перли Na2Ni(ВО2)4 червоно-коричневого кольору.
Виявлення іонів Ni+2 в присутності катіонів інших аналітичних груп. Як уже зазначалось, виявленню іонів Ni2+ за допомогою диметилгліоксиму заважають іони Fе2+ і Сu2+. Для усунення впливу Fе2+-іонів їх переводять дією азотної кислоти в Fе3+-іони, які потім зв’язують в безбарвні фторидні або тартратні комплексні іони Fе3+:

Для усунення впливу Сu2+ -іонів останні переводять в присутності Na2SО3 дією тіоціанат-іонів SCN в осад СuSCN і відокремлюють центрифугуванням
![]()
Виконання реакції. До 3-5 крапель розчину добавляють 2-3 краплі НNО3, суміш в пробірці нагрівають до кипіння. Потім добавлянні в пробірку 2-3 краплі насиченого розчину NaF, 2-3 краплі розчину Na2SО3, 2-3 краплі розчину NH4SCN і знову нагрівають. Після охолодження відокремлюють СuSСN центрифугуванням, а до розчину додають краплями NН4ОН до створення аміачного середовища і 2-3 краплі спиртового розчину диметилгліоксиму. В присутності Ni+-іонів випадає червоний осад диметилгліоксимату нікелю.
Реакції іонів Zn2+
Дія калій гексаціаноферату (II, III) К4[Fе(СN)6], К3[Fе(СN)6]. Іони Zn2+ з калій гексаціанофератом (II) утворюють білий осад К2Zn3[Fе(СN)6]2:
![]()
Осад К2Zn3[Fе(СN)6]2: не розчиняється в кислотах, але розчиняється в лугах з утворенням цинкату. Реакції заважають Fе3+, Сu2+, Сd2+, Нg2+, Аg+ та інші іони.
Виконання реакції. До 2-3 крапель розчину добавляють краплю розчину калій гексаціаноферату (II). В присутності іонів Zn2+ випадає білий осад. Взаємодія іонів Zn2+ з калій гексаціанофератом (III) К3[Fе(СN)6] приводить до утворення коричнево-жовтого осаду Zn3[Fе(СN)6]2 або КZn[Fе(CN)6]. Реакції заважають Fе3+, Fе2+, Сu2+, Сd2+ та багато інших іонів.
Дія амоній тетрароданомеркурата (II) (NH4)2[Hg(SCN)4]. Амоній тетрароданомеркурат (II) з іонами Zn2+ утворює осад Zn[Hg(SCN)4] білого кольору, а з іонами Сu2+ - осад Сu[Нg(SCN)4] зеленого кольору. Якщо іони Zn2+, Сu2+ в розчині присутні одночасно, то при дії (NH4)2[Hg(SCN)4] випадає осад фіолетового кольору:
![]()
Виконання реакції. До 2-3 крапель розчину в пробірку додають 1 краплю розведеної сірчаної кислоти, 2-3 краплі 0,1 % розчину СuSО4·5Н2О і 3-4 краплі розчину (NH4)2[Hg(SCN)4]. Внутрішні стінки пробірки потирають скляною паличкою. В присутності іонів Zn2+ випадає осад фіолетового кольору.
При виконанні даної реакції необхідно звернути увагу на концентрацію іонів Сu2+ в розчині: вона повинна бути невисокою. При високій концентрації іонів Сu2+ може випасти індивідуальна комплексна сіль міді Сu[Нg(SCN)4] зеленого кольору.
Подвійну забарвлену в блакитний колір комплексну сіль іони Zn2+ з (NН4)2[Нg(SCN)4] утворюють і в присутності іонів Со2+:
![]()
Дія сірководню Н2S. Іони Zn2+ осаджуються у вигляді білого осаду ZnS при дії Н2S в нейтральному, слабколужному або слабкокислому середовищі:
![]()
Найчастіше цією реакцією користуються в слабкокислому середовищі при рН=2. В цих умовах не осаджуються іони Со2+, Ni+2, Мn2+, Fе2+ і тому вони не заважають виявленню іонів Zn2+. Розчин з рН=2 створюють добавлянням форміатного буферного розчину, тобто, суміші форміатної кислоти та її солі. Але виявленню іонів Zn2+ дією Н2S при рН=2 заважають іони металів, які утворюють сульфіди менш розчинні, ніж сульфід цинку. Тому ці іони повинні бути відокремлені. Це іони Сd, Вs, Рb2+, Сu2+, Аg+, Нg2+, Sn2+, SЬШ, SЬV.
Утворення кобальт цинкату (реакція сухим способом). Смужку фільтрувального паперу змочують розчином, в якому виявляють іони Zn2+, і розчином Со(NO3)2, висушують і спалюють. В присутності цинку утворюється кобальт цинкат ("ринманова зелень"), який забаpвлює золу в зелений коліp:
![]()
Проведенню реакції заважають іони А13+, які утворюють в аналогічних умовах золу темно-синього кольору, так звану "тенарову синь", а також іони Сг3+, Nі2+, Сu2+, які власним забарвленням маскують колір золи.
Виявлення іонів Zn2+ в суміші катіонів інших груп. 3-4 краплі розчину містять в пробірку, добавляють надлишок розчину NH4OH, осад гідроксидів важких металів відокремлюють центрифугуванням. Центрифугат (розчин) підкислюють оцтовою кислотою до кислого середовища і нагрівають до кипіння. Якщо при цьому утворюється осад, його відокремлюють центрифугуванням. Відбирають 3-4 краплі лужного розчину, який нейтралізують добавлянням 2 н. НС1. Розчин НС1 добавляють краплями до рН=2, потім додають 1-2 краплі К4[Fе(СN)6]. Якщо в розчині присутні іони Zn2+, випадає білий осад.
Реакції іонів Сd2+
Дія калій гексаціаноферату (II) ) К4[Fе(СN)6], Калій гексаціаноферат (II) утворює з іонами Сd2+ білий осад кадмій гексаціа-ноферату (II) ) Cd2[Fе(СN)6], який розчиняється в мінеральних кислотах:
Cd2+
+
К4[Fе(СN)6]
![]() Cd2[Fе(СN)6]
Cd2[Fе(СN)6]
Реакція з сірководнем та його солями Н2S, (NH4)2S.
Сірководень Н2S та (NН4)2S осаджує іони Сd2+ у вигляді сульфіду СdS жовтого кольору:
Сd2++Н2S![]() СdS+2Н+.
СdS+2Н+.
СdS практично не розчиняється в 0,3 н. (рН>0,5) мінеральних кислотах, але розчиняється в більш концентрованих розчинах мінеральних кислот при нагріванні:
СdS+2НС1![]() СdСl2+Н2S
СdСl2+Н2S
СdS легко розчиняється в азотній кислоті при нагріванні:
3СdS+2NO3-+8Н+![]() 3Сd2++2NO+3S+4Н2О
3Сd2++2NO+3S+4Н2О
Реакції заважають іони важких металів, надлишок кислоти і висока концентрація хлорид-іонів.
В систематичному ході аналізу іони Сd2+ і Сu2+ опиняються разом у вигляді аміакатів. Для виявлення іонів Сd2+ необхідно спочатку ці іони розділити. Цього можна досягти, використавши неоднакову розчинність сульфідів кадмію і міді. На відміну від СdS (ДРCdS = =3,6·10-29) сульфід міді СuS (ДРСuS=8,5·10-45) має значно меншу величину добутку розчинності і утворюється навіть в сильно кислому середовищі і в присутності великого надлишку хлорид-іонів. Цим фактом і можна скористатися для відокремлення Сu2+-іонів від Сd2+-іонів. Таке відокремлення можна здійснити різними способами.
а) Аміачний розчин, який містить іони [Сu(NН3)4]2+ і [Сd(NHз)4]2+ обережно підкислюють, додаючи краплями 2 н. розчин НСl до зміни темно-синього забарвлення аміачного комплексу міді на голубе забарвлення іону Сu+2. Після цього добавляють до розчину ще такий же об’єм 2н розчину НСl.
Одержаний розчин (1 н по вмісту НСl) нагрівають майже до кипіння і насичують сірководнем. Переконавшись в повноті осадження, осад СuS відокремлюють і відкидають. Центрифугат розводять в 3-4 рази водою і пропускають Н2S. Поява осаду жовтого кольору вказує на присутність іонів Сd2+.
б) До аміачного розчину, який містить іони [Сu(NН3)4]2+, [Сd(NН3)4]2+, добавляють 2 н. розчин НСІ до кислої реакції і твердий NН4Сl до насичення ним розчину при збовтуванні. Розчин нагрівають і пропускають в нього Н2S. Випадає СuS, в розчині залишаються іони Сd2+. Добившись повного осадження СuS, осад відокремлюють і відкидають. Центрифугат (фільтрат) розводять в 4-5 разів дистильованою водою і пропускають Н2S. Поява жовтого осаду СdS свідчить про наявність іонів Сd2+.
в) До аміачного розчину, що містить іони [Сu(NН3)4]2+, [Сd(NН3)4]2+, краплями добавляють 2 н. розчин НСІ до переходу синього забарвлення в блакитне іонів Сu2+, розчин нагрівають і пропускають Н2S до повного осадження сульфідів СuS і СdS. Осад сульфідів відокремлюють від розчину, до осаду добавляють рівні об'єми води і 2 н НСl (по 5-7 крапель) і нагрівають. При цьому СdS розчиняється, а СuS залишається в осаді. Осад СuS відокремлюють, а розчин розбавляють в 3—4 рази водою і діють на нього Н2S або сірководневою водою. Поява жовтого осаду свідчить про наявність іонів Сd2+ в розчині.
Реакція з калій тетрайодовісмутатом К[ВіІ4]. Реакція виконується крапельним способом. Краплю розчину наносять на фільтрувальний папір, до центру плями додають 1 краплю розчину К[ВіІ4]. В присутності іонів Сd2+ пляма чорніє внаслідок утворення BiI3
Сd2+
+2[ВіІ4]-
![]() СdI2
+2 BiI3
СdI2
+2 BiI3
Виявлення іонів в суміші катіонів інших груп. Виявлення іонів Ссі2+ дробним методом ґрунтується на осадженні іонів важких металів у вигляді сульфідів при дії РbS, який має вищу розчинність за розчинність сульфідів важких металів (ДРРbS=1,1·10-29) і меншу розчинність, ніж розчинність СdS (ДРСdS=3,6·10-29).
Виконання реакції. До 3-5 крапель розчину добавляють надлишок суспензії свинець сульфіду РbS і суміш гріють протягом 2 хвилин. Осад сульфідів металів відокремлюють центрифугуванням, до розчину добавляють 2 н НС1 і сірководневу воду. Поява жовтого осаду свідчить про присутність іонів Сd2+.
Систематичний хід аналізу суміші катіонів ПІ аналітичної групи Со2+, Ni2+, Zn2+, Сd2+, Сu2+, Hg2+
1. Попередні випробування. Систематичному ходу аналізу будь-якої суміші катіонів повинні передувати попередні дослідження. Якщо відомо, що в розчині містяться тільки катіони III аналітичної групи, необхідно звернути увагу на забарвлення, розчину. У випадку рожевого забарвлення розчину можна зробити попередній висновок про присутність в розчині іонів Со2+, зеленого - ioнів Nі2+, блакитного іонів Сu2+. Якщо розчин безбарвний, то жоден із названих іонів в розчині присутнім не може бути.
І). Виявлення іонівCu2+ До 3-4 крапель розчину добавляють надлишок NH4ОН. Темно-синє забарвлення вказує на присутність іонів Сu2+.
2). Виявлення іонів Со2+. До 3-4 крапель розчину добавляють 2-3 краплі оцтової кислоти, 3-4 краплі насиченого розчину NН4SСN і 0,5 мл (10 крапель) амілового спирту. В присутності іонів Со2+ верхній шар амілового спирту забарвлюється в синій колір.
3). Виявлення іонів Нg2+. На блискучу мідну пластинку наносять 1 краплю розчину, що досліджується і дають постояти. Поява на пластинці темної плями свідчить про присутність в розчині іонів Нg2+.
Після попередніх випробувань приступають до систематичного ходу аналізу суміші катіонів.
Систематичний хід аналізу виконується в окремій порції розчину.
Схема систематичного ходу аналізу суміші катіонів III аналітичної групи
І). Відокремлення іонів Нg2+ і Си2+ у вигляді сульфідів. До 10-15 крапель розчину в пробірці прибавляють 5-7 крапель 2 н. H2SO4 та 2-3 мл 2 н. Na2S2O3 і нагрівають до кипіння:
Осад 1 Розчин 1
НgS, Сu2S, S Со2+ Ni2+ [Cd(S2O3)2]2-, Zn2+-іони
Осад 1 відокремлюють центрифугуванням.
2). Відокремлення осаду НgS. Осад 1 переносять у фарфорову чашку, добавляють 3 н НNO3 і нагрівають до кипіння. В розчин переходять іони Сu2+, в осаді залишається НgS, який відокремлюють центрифугуванням.
Осад 2 Розчин 2
НgS, S Сu2+-іони
3). Виявлення іонів Нg2+. Осад 2 переносять у фарфорову чашку, добавляють суміш 2 н. НС1 і 3%-ний розчин Н2О2 і нагрівають до кипіння. В розчин переходять іони ртуті у вигляді [НgСl4,]2-, які виявляють за допомогою розчину SnС12. Поява білого осаду Нg2Cl2, який в часі темніє, свідчить про присутність іонів Нg2+.
Розчин 3
[HgCl4]2-
4). Виявлення іонів Си2+. 2-3 краплі розчину 2 в пробірці обробляють розчином NH4OH до лужної реакції. Поява інтенсивно синього забарвлення свідчить про присутність іонів Сu2+ в розчині.
Розчин 4
[Сu(NH3)4]2+-іони
5). Відокремлення іонів цинку від іонів Сd2+ Nі2+ Со2+
Розчин 1 нагрівають до кипіння і кип’ятять до повного видалення сірководню Н2S. Повноту видалення Н2S перевіряють за допомогою фільтрувального паперу, змоченого розчином Рb(NO3)2 і у відсутності Н2S змочений папір неповинен чорніти. Потім до розчину додають 6 н. розчин NaOH до лужної реакції і нагрівають. В осад випадають гідроксиди Со(ОН)2, Nі(ОН)2, Cd(ОН)2, а в розчині залишаються іони цинку у вигляді [Zn(ОН)4]2- іонів.
Осад 3 Розчин 5
Со(ОН)2, Ni(ОН)2, Сd(ОН)2 [Zn(ОН)4]2--іони
6). Переведення в розчин осаду 3. Осад 3 розчиняють в 2 н. розчині НСl
Розчин 6
Сd2+ , Nі2+, Со2+
7). Виявлення іонів Сd2+ Nі2+ Со2+ Розчин 6 ділять на З частини (порції) і в одній порції виявляють іони Со2+ в другій - іони Nі2+ , в третій - іони Сd2+
а) Виявлення іонів Со2+ До 3-4 крапель розчину 6 добавляють 2-З краплі 2 н. розчину оцтової кислоти і 5-6 крапель 6 н.розчину КNО2. В присутності Со2+-іонів випадає жовтий осад К2Na[Со(NO2)6].
Іони Со2+ можна виявити і за допомогою амоній тіоціанату NН4SCN. Для цього до 3-5 крапель розчину 6 добавляють 3-5 крапель насиченого розчину NН4SCN, 0,5 мл амілового спирту. Забарвлення верхнього шару амілового спирту в синій колір говорить про присутність іонів Со2+ в розчині.
б) Виявлення іонів Nі2+ До другої частини розчину 6 додають NН4ОН до лужної реакції і 2-3 краплі спиртового розчину диметилглioксиму. В присутності іонів Nі2+ утворюється ярко-червоний осад.
в) Виявлення іонів Сd2+ Третю порцію розчину 6 ділять ще на 2 частини і до однієї порції додають розчин К[ВіІ4], в присутності іонів утворюється чорний осад ВіІ3. А другу порцію розбавляють в 4-5 разів дистильованою водою і додають сірководневу воду. Поява жовтого осаду свідчить про наявність іонів Сd2+ в розчині.
г) Виявлення іонів Zп2+. Розчин 5 підкислюють 2 н. розчином оцтової кислоти до кислої реакції і добавляють розчин К4[Fе(CN)6]. Поява білого осаду свідчить про присутність іонів Zn2+.
