
- •Глава 60. Оценка питательного статуса пациента и лечебное питание
- •1. Что понимают под питательным статусом пациента?
- •2. Что такое нарушение питания (синдром мальнутриции)? Как различные типы нарушения питания влияют на функции организма и исходы различных заболеваний?
- •3. Какова разница между вынужденным голоданием и повышенным метаболизмом?
- •4. Как оценивают питательный статус пациента? Какие существуют для этого дополнительные лабораторные и инструментальные методы?
- •5. Каким образом организм расходует энергию? Какие существуют клинические показатели расхода энергии?
- •6. Опишите типы пероральных диет, наиболее часто используемых в клинической практике.
- •7. В каких ситуациях пациентам назначают парентеральное питание?
- •8. Какие составы применяются для энтерального питания? Классификация составов для энтерального питания (для взрослых)
- •9. Какие предосторожности необходимо соблюдать при применении принудительного энтерального кормления? Какие могут при этом возникать осложнения?
- •10. В каких случаях для проведения энтерального кормления применяют не зонд, а энтеростому? Какой тип энтеростомии наиболее предпочтителен для этой цели?
- •11. Перечислите основные типы парентерального питания.
- •12. Назовите возможные осложнения парентерального питания.
- •13. Что является дополнительными, или "скрытыми", источниками энергии?
- •14. Почему энтеральное питание предпочтительнее парентерального?
- •16. Рассчитайте потребности в белке у этого же пациента.
- •17. Каковы потребности организма в жидкости, витаминах и минералах?
- •18. Как Вы будете осуществлять кормление пациента, о котором идет речь в вопросе 15?
- •19. Контроль каких показателей необходимо осуществлять у пациента при проведении принудительного кормления?
- •20. Как оценивают азотистый баланс пациента?
- •21. Каковы типичные проявления недостаточности или избытка различных питательных микроэлементов? Признаки недостаточности и передозировки витаминов и минералов
- •22. Какие проблемы с питанием возникают у пациентов с воспалительной болезнью кишки? Какие существуют при этом варианты лечебного питания?
- •23. Каковы принципы лечебного питания у пациентов с синдромом короткой кишки?
- •24. Каков должен быть подход к питанию у пациентов с острым панкреатитом?
- •25. Каковы особенности лечебного питания у пациентов с запущенными заболеваниями печени? в какой форме им необходимо вводить белок?
- •26. Каково значение условно незаменимых питательных веществ, антиоксидантов и пищевых иммуномодуляторов?
- •27. Какие нормативные принципы помогают врачам принять решение, использовать ли лечебное питание у пациентов, находящихся в терминальном состоянии?
- •Медицинская реабилитация стомированных больных.
- •Средства ухода за стомойкомпании "конватек" великобритания
- •Справочно-информационные материалы
- •Гастроэнтерит, вызванный Salmonella и Campylobacter, увеличивает риск развития воспалительных заболеваний кишечника
- •Свиной грипп при воспалительных заболеваниях кишечника
- •1 Комментарий
- •Как размещать рекламные ссылки на КронПортале?
- •Что нужно знать о дезинфекции колоноскопов
- •Дезинфекция колоноскопов. Как это часто происходит в действительности
- •Стандарты диагностики
- •Недостаточность витамина d и взк (болезнь Крона и неспецифический язвенный колит)
- •Витамин d как регулятор иммунной системы
- •3 Комментария
- •Разрешенные и запрещенные продукты Хлеб и мучное:
- •7 Комментариев
- •Строение тонкого и толстого кишечника для чайников
- •Восстановительная операция как финал борьбы с язвенным колитом и стоит ли ее бояться (j-Pouch, s-Pouch, w-Pouch)
- •4 Комментария
27. Какие нормативные принципы помогают врачам принять решение, использовать ли лечебное питание у пациентов, находящихся в терминальном состоянии?
Лечебное питание отнесено к одному из видов лечения, а не к неоспоримой потребности для всех пациентов. Решение о том, когда начинать лечебное питание и какую его форму необходимо использовать, должно быть основано на общих медицинских принципах и общих принципах питания. Значительно сложнее ответить на вопрос, насколько можно улучшить качество и продолжительность жизни при проведении адекватного питания и насколько вредно (или вовсе не вредно) вынужденное голодание. Не следует забывать, что принудительное кормление само по себе может нести угрозу для жизни. Всегда необходимо проводить оценку питательного статуса каждого пациента и в обязательном порядке учитывать результаты индивидуальных отклонений, степень независимости пациента, принципы милосердия и целостности подхода к лечению.
|
ЭНТЕРАЛЬНОЕ ПИТАНИЕ В ГАСТРОЭНТЕРОЛОГИИ: ВЧЕРА, СЕГОДНЯ, ЗАВТРА И.Е. ХорошиловСанкт-Петербургская медицинская академия последипломного образования, Санкт-Петербург | |
|
Энтеральное питание – способ обеспечения организма питательными веществами через желудочно–кишечный тракт. Альтернативным ему является парентеральное питание – введение питательных веществ непосредственно в кровь. В широком смысле к энтеральному питанию относится и естественное, пероральное питание, поскольку при этом пищевые вещества (нутриенты) поступают в организм через желудочно–кишечный тракт [1]. Однако в отечественной медицинской литературе под энтеральным питанием понимают в основном искусственное питание [2]. В отличие от обычного (естественного) питания, субстратом которого является пища, при энтеральном искусственном питании в организм доставляются искусственно созданные питательные смеси. Здесь можно провести аналогию с искусственным и естественным вскармливанием новорожденных. Попытки использования энтерального питания в качестве замены обычного питания при невозможности последнего в случае болезни или травмы предпринимались еще в глубокой древности. До нас дошли сведения, что еще в Египте 3500 лет назад жрецы–врачи использовали питательные клизмы [3]. Ректальное питание медики назначали пациентам вплоть до конца XIX в. Лишь в 1910 г. М. Эйнгорн (Einhorn M.) выступил с критикой этого метода питания, предложив вместо этого вводить питательную смесь (молоко, яйца) через желудочный или дуоденальный зонд, когда обычное питание невозможно или нежелательно [4]. Отдельные попытки зондового внутрижелудочного питания предпринимались еще в XVII – XVIII вв. В 1617 г. И. Фабриций (Fabricius H.) проводил питание больному столбняком с помощью серебряной трубки, введенной в пищевод. В 1793 г. в Лондоне хирург английского короля Дж. Хантер (Hunter J.) применил в качестве желудочного зонда китовый ус, обернутый кожей угря. Больному с параличом он вводил в желудок зондовое питание, состоящее из молока, яиц, сахара, студня [5]. Но настоящее развитие энтеральное зондовое питание получило лишь в XX в., после разработки состава искусственных питательных смесей и специальных зондов [6, 7]. Первой искусственной питательной смесью, полностью заменяющей питание грудных детей, был Нутрамиген, произведенный в США в 1942 г. И только в 1974 г. эта же компания, Мид Джонсон, выпустила первую смесь для взрослых пациентов – Изокал [8]. Практическая разработка и внедрение методов энтерального питания были бы невозможны без фундаментальных исследований ученых, в т. ч. отечественных – И.П. Павлова, А.М. Уголева, Ю.М. Гальперина, А.А. Покровского, М.Ф. Нестерина, И.А. Рогова и др. В нашей стране первые промышленно выпускаемые смеси для энтерального питания (энпиты) появились в 1970–х гг., а в 1980–х были созданы отечественные сбалансированные смеси Инпитан, Оволакт, Унипит и Композит [9, 10]. В настоящее время в мире производится более 200 искусственных смесей для энтерального питания [11]. В нашей стране на сегодняшний день разрешено использование 37 официально зарегистрированных питательных смесей [12]. Питательной смесью называется концентрированная смесь пищевых веществ (нутриентов), подвергнутых промышленной обработке для улучшения усвояемости в организме. В ее состав входят цельные или гидролизованные белки, длинно– и среднецепочечные жиры, поли– и олигосахариды, витамины, макро– и микроэлементы. Смеси отличает точный химический состав, сбалансированность всех нутриентов между собой. В этом их принципиальное отличие от обычной пищи (диеты). Разовую и суточную дозу назначаемых питательных смесей и показания к их применению определяет лечащий врач. По своему составу и показаниям смеси для энтерального питания могут быть разделены на 5 групп:
Стандартные смеси используются в качестве основного или дополнительного питания, когда пищеварительные функции существенно не нарушены. В их состав входят нативные белки, растительные жиры, легко усваиваемые углеводы, витамины, макро– и микроэлементы в сбалансированных соотношениях (табл. 1). Показанием для их назначения является дефицит массы тела, истощение на фоне любых заболеваний и травм, когда обычной диетой не удается обеспечить потребности организма [13]. Полуэлементные смеси, в отличие от стандартных, содержат белки, гидролизованные до пептидов и аминокислот, которые усваиваются даже при выраженных нарушениях пищеварения и кишечного всасывания. Большая часть жиров представлена среднецепочечными триглицеридами, которые перевариваются без участия липазы поджелудочной железы. Полуэлементные смеси назначаются при нарушениях пищеварения и всасывания, вызванных заболеванием или операцией (табл. 2). Их использование является альтернативой парентеральному (внутривенному) питанию. Модульные смеси дополняют рацион питания необходимыми нутриентами – белками, жирами, отдельными аминокислотами, пищевыми волокнами. Это позволяет удовлетворить индивидуальные потребности конкретного пациента. Специальные (метаболически направленные) смеси разработаны с учетом изменяющихся метаболических потребностей при конкретной патологии – сахарном диабете, печеночной, почечной, дыхательной недостаточности. Например, смеси, назначаемые при патологии печени, содержат измененный аминокислотный состав белков. В них больше аминокислот с разветвленной цепью (валин, изолейцин, лейцин) и меньше ароматических аминокислот (фенилаланин, тирозин, триптофан) [14]. Питательная смесь Модулен, предназначенная для энтерального питания при болезни Крона и язвенном колите, содержит специальный противовоспалительный трансформирующий фактор роста TGF–бета 2. Иммуномодулирующие смеси предназначены для коррекции нарушений иммунного статуса у пациентов с тяжелыми травмами, обширными ожогами, тяжелой инфекцией, иммунодефицитом. Они обогащены специальными нутриентами, усиливающими иммунитет, – аргинином, глютамином, ω–3 жирными кислотами, нуклеотидами. Одной из широко используемых в клиниках нашей страны стандартных смесей для энтерального питания является Берламин Модуляр (Берлин–Хеми, Германия). Эта питательная смесь состоит из молочного и соевого белков, растительных масел, мальтодекстринов, витаминов, макро– и микроэлементов. Содержит полный набор всех незаменимых и заменимых аминокислот с оптимальным соотношением ω–6 и ω–3 полиненасыщенных жирных кислот (7:1). Имеет в составе 9 водорастворимых и 4 жирорастворимых витаминов, 15 макро– и микроэлементов (включая железо, медь, цинк, йод, селен). Дополнительно в состав смеси включены таурин, инозитол и карнитин. В составе Берламин Модуляра нет холестерина, лактозы, глютена, что позволяет назначать ее пациентам с сердечно–сосудистыми, гастроэнтерологическими заболеваниями без выраженных нарушений пищеварения и кишечного всасывания (рвота, диарея, мальабсорбция). Имеется опыт клинического применения Берламина Модуляра у пациентов с язвенной болезнью желудка и двенадцатиперстной кишки, жировым гепатозом, гепатитом, синдромом раздраженного кишечника [15, 16]. В состав Берламина Модуляра могут быть включены дополнительные модули – среднецепочечных жиров (МСТ модуль), белков (Протеин модуль), глютамина, пектина, карнитина. Так, среднецепочечные жиры перевариваются и всасываются в тонкой кишке без участия липазы поджелудочной железы и желчных кислот. Поэтому МСТ модуль Берламин Модуляр назначается пациентам с острым и хроническим панкреатитом, холециститом, энтеритами, муковисцидозом, циррозом печени. Карнитин модуль Берламин Модуляр содержит L–карнитин – витаминоподобное вещество, необходимое для метаболизма клеток. Карнитин в обычных условиях образуется в печени из метионина, лизина, витаминов группы В, С и железа. Карнитин способствует оптимальному окислению жирных кислот в митохондриях клеток, в частности гепатоцитов. Кроме того, он удаляет из клеток конечные продукты окисления жиров. Дефицит карнитина развивается при истощении любого происхождения, вегетарианском питании, беременности, спортивных нагрузках, физическом и умственном переутомлении. Кроме того, Карнитин модуль Берламин Модуляр назначается с лечебной целью при гепатитах, гепатозах, циррозах, панкреатитах, холециститах. Его можно принимать вместе с энтеральным питанием Берламин Модуляр или обычной диетой. Глютамин модуль Берламин Модуляр содержит условно незаменимую аминокислоту – глютамин. Установлено, что при тяжелых травмах, ожогах содержание глютамина в тканях уменьшается в 2–5 раз. Показано, что дополнительное обогащение диеты глютамином способствует повышению клеточного иммунитета, усилению регенеративных процессов, в т. ч. в тонкой и толстой кишке. Глютаминовый модуль назначается при тяжелых травмах, ожогах, сепсисе, язвенном колите, болезни Крона, энтеритах, пострезекционном синдроме короткой кишки. Пектин модуль Берламин Модуляр содержит ферментируемые пищевые волокна – пектиновые вещества. Пектин имеет несколько механизмов действия на желудочно–кишечный тракт: сохраняет морфологическую структуру кишечных ворсинок, увеличивает активность липазы в тонкой кишке, обеспечивает своевременное опорожнение желудка, увеличивает время транзита пищи по кишечнику. Пектиновые вещества полностью ферментируются микрофлорой толстой кишки (бифидобактериями) до короткоцепочечных жирных кислот, которые, в свою очередь, являются питательным субстратом для колоноцитов. Этот модуль назначается вместе с энтеральным питанием при диарее, мальабсорбции, дисбактериозах кишечника. У гастроэнтерологических пациентов часто отмечаются нарушения переваривания и всасывания пищевых веществ [17]. При этом обычная пища (диета) не успевает усвоиться, что приводит к развитию нарушений питания. Энтеральное питание имеет ряд существенных преимуществ перед традиционной лечебной диетой, а именно:
Энтеральное питание может быть назначено гастроэнтерологическим пациентам в двух вариантах: пероральным сипингом или зондовым питанием. Сипингом (от англ. sip – маленький глоток) называется вариант энтерального питания, когда питательная смесь потребляется через рот мелкими глотками [18]. Данный способ является наиболее предпочтительным, если сознание и глотание не нарушены, сохранена проходимость пищеварительного тракта для жидкости. Вторым вариантом является постановка назогастрального (назоинтестинального) зонда для энтерального питания. Обычно это делается во время фиброгастродуоденоскопии: зонд проводится через канал эндоскопа. При необходимости пролонгированного (свыше 3–4 недель) зондового кормления выполняется гастро– или еюностомия. В настоящее время имеются наборы для чрескожной эндоскопической гастростомии (еюностомии). Питательная смесь для энтерального питания обычно готовится непосредственно перед введением путем растворения сухого порошка в остуженной до 30–40 °С кипяченой воде. Важно обеспечить стерильность и полное растворение смеси, особенно для введения через зонд. Одним из наиболее частых осложнений зондового питания является закупорка зонда (до 10 %). При проведении энтерального питания как в режиме сипинга, так и зондового введения должно осуществляться поэтапное увеличение скорости и объемов энтерального питания (табл. 3). Это позволяет избежать явлений пищевой перегрузки, тошноты, рвоты, диареи. В необходимых случаях объем суточного введения готовой питательной смеси может быть доведен до 2 литров в сутки. Если пациент получает дополнительное энтеральное питание на фоне полноценной лечебной диеты, достаточно назначить 500 мл питательной смеси в сутки. Энтеральное питание продолжается до получения эффекта в виде улучшения состояния питания, обычно не менее 10–14 дней. Критериями его эффективности являются:
Таким образом, на сегодняшний день имеются возможности широкого использования энтерального питания при гастроэнтерологической патологии. Назначение питательных смесей и модулей в качестве основного лечебного питания или вместе с диетой способствует повышению эффективности проводимого лечения – более быстрому купированию диареи, мальабсорбции, белковой и витаминной недостаточности, улучшению качества жизни пациентов. В ближайшей перспективе практически каждый гастроэнтерологический пациент будет получать лечебный рацион с включением тех или иных питательных смесей или модулей. Об этом уже сегодня свидетельствует опыт ведущих отечественных и зарубежных клиник [19, 20]. По прогнозам ученых, в ближайшие 15–20 лет питательные смеси, нутрицевтики и метаболические препараты на 35–50 % заменят многие современные лекарственные средства. В лечении хронических заболеваний основное внимание будет направлено на коррекцию метаболических нарушений, вызванных той или иной патологией. Будут созданы новые питательные смеси, направленные на патогенетическое лечение конкретных заболеваний. Получит дальнейшее развитие фармаконутрициология – новая научная область, находящаяся на стыке науки о питании, пищевой промышленности и клинической фармакологии.
ЛИТЕРАТУРА
|
|
Искусственное питание является сегодня одним из базисных видов лечения больных в условиях стационара. Практически не существует области медицины, в которой оно бы не применялось. Наиболее актуально применение искусственного питания (или искусственная нутриционная поддержка) для хирургических, гастроэнтерологических, онкологических, нефрологических и гериатрических контингентов больных.
Нутриционная поддержка – комплекс лечебных мероприятий, направленный на выявление и коррекцию нарушений нутриционного статуса организма с использованием методов нутриционной терапии (энтерального и парентерального питания). Это процесс обеспечения организма пищевыми веществами (нутриентами) с помощью методов, отличных от обычного приема пищи.
“ Неспособность врача обеспечить питание больного должна расцениваться, как решение уморить его голодом. Решение, для которого в большинстве случаев было бы трудно подобрать оправдание" – писал Арвид Вретлинд.
Своевременная и адекватная нутриционная поддержка позволяет в значительной степени сократить частоту инфекционных осложнений и летальность больных, добиться повышения качества жизни пациентов и ускорить их реабилитацию.
Искусственная нутриционная поддержка может быть полной, когда все (или основная часть) потребности больного в питании обеспечиваются искусственным путем, либо частичной, в случае если введение нутриентов энтеральным и парентеральным путем является дополнительным по отношению к обычному (пероральному) питанию.
Показания к проведению искусственной нутриционной поддержки многообразны. В целом их можно описать как любые заболевания, при которых потребность больного в нутриентах не может быть обеспечена естественным путем. Обычно это заболевания желудочно-кишечного тракта, не позволяющие пациенту питаться адекватно. Также искусственное питание может быть необходимо пациентам с метаболическими проблемами – выраженным гиперметаболизмом и катаболизмом, высокой потерей нутриентов.
Широко известно правило "7 дней или снижение массы тела на 7%". Оно означает, что искусственное питание необходимо проводить в тех случаях, когда больной 7 дней и более не сможет питаться естественным путем, или если больной потерял более 7% от рекомендуемой массы тела.
Оценка эффективности нутриционной поддержки включает следующие показатели: динамику параметров нутриционного статуса; состояние азотистого баланса; течение основного заболевания, состояние хирургической раны; общую динамику состояния пациента, выраженность и течение органной дисфункции.
Различают две основных формы искусственной нутриционной поддержки: энтеральное (зондовое) и парентеральное (внутрисосудистое) питание.
Особенности метаболизма человека при голодании
Первичной реакцией организма в ответ на прекращение поступления нутриентов извне является использование гликогена и гликогеновых депо в качестве источника энергии (гликогенолиз). Однако запас гликогена в организме обычно не велик и истощается в течение первых двух-трех дней. В дальнейшем самым легким и доступным источником энергии становятся структурные белки организма (глюконеогенез). В процессе глюконеогенеза глюкозо-зависимые ткани вырабатывают кетоновые тела, которые по реакции обратной связи замедляют основной обмен и начинается окисление запасов липидов в качестве источника энергии. Постепенно организм переходит в белково-сберегающий режим функционирования, и глюконеогенез возобновляется лишь при полном истощении запасов жира. Так, если в первые дни голодания потери белка составляют 10 –12 г в сутки, то на четвертой неделе – лишь 3-4 г при отсутствии выраженного внешнего стресса.
У больных в критическом состоянии происходит мощный выброс стрессовых гормонов - катехоламинов, глюкагона, обладающих выраженным катаболическим действием. При этом нарушается выработка или блокируется ответ на такие гормоны с анаболическим действием как соматотропный гормон и инсулин. Как это часто бывает при критических состояниях, приспособительная реакция, направленная на разрушение белков и обеспечение организма субстратами для построения новых тканей и заживления ран, выходит из под контроля и становится чисто разрушительной. Из-за катехоламинемии замедляется переход организма на использование жира в качестве источника энергии. В этом случае (при выраженной лихорадке, политравме, ожогах) может сгорать до 300 г. структурного белка в сутки. Такое состояние назвали аутоканибаллизмом. Энергозатраты увеличиваются на 50-150% . Какое-то время организм может поддерживать свои потребности в аминокислотах и энергии, однако запасы белка ограничены и потери 3-4 кг структурного белка считаются необратимыми.
Принципиальное отличие физиологической адаптации к голоданию от приспособительных реакций при терминальных состояниях состоит в том, что в первом случае отмечается адаптивное снижение потребности в энергии, а во втором - потребление энергии значительно возрастает. Поэтому в постагрессивных состояниях следует избегать отрицательного азотистого баланса, так как белковое истощение в конечном итоге приводит к смерти, которая наступает при потере более 30% общего азота организма.
Желудочно-кишечный тракт при голодании и в критическом состоянии
В критических состояниях организма часто возникают условия, при которых нарушается адекватная перфузия и оксигенация желудочно-кишечного тракта. Это ведет к повреждению клеток кишечного эпителия с нарушением барьерной функции. Нарушения усугубляются, если длительное время отсутствуют нутриенты в просвете желудочно-кишечного тракта (при голодании), так как клетки слизистой получают питание в значительной степени непосредственно из химуса.
Важным повреждающим пищеварительный тракт фактором является любая централизация кровообращения. При централизации кровообращения происходит уменьшения перфузии кишечника и паренхиматозных органов. В критических состояниях это усугубляется еще и частым использованием адреномиметических препаратов для поддержания системной гемодинамики. По времени восстановление нормальной перфузии кишечника отстает от восстановления нормальной перфузии жизненно важных органов. Отсутствие химуса в просвете кишечника нарушает поступление антиоксидантов и их предшественников в энтероциты и усугубляет реперфузионные поражения. Печень за счет ауторегуляторных механизмов несколько меньше страдает от снижения кровотока, но все же и ее перфузия уменьшаться.
При голодании развивается микробная транслокация, то есть проникновение микроорганизмов из просвета желудочно-кишечного тракта через слизистый барьер в крово- или лимфоток. В основном в транслокации участвуют Escherihia coli, Enterococcus и бактерии рода Candida. В определенных количествах микробная транслокация присутствует всегда. Проникающие в подслизстый слой бактерии захватываются макрофагами и транспортируются в системные лимфоузлы. При проникновении в кровоток они захватываются и уничтожаются купферовскими клетками печени. Устойчивое равновесие нарушается при неконтролируемом росте микрофлоры кишечника и изменении ее нормального состава (т.е. при развитии дисбактериоза), нарушении проницаемости слизистой, нарушении местного иммунитета кишечника. Доказано, что микробная транслокация имеет место у критических больных. Она усиливается при наличии факторов риска (ожоги и тяжелая травма, системные антибиотики широкого спектра, панкреатит, геморрагический шок, реперфузионные поражения, исключение твердой пищи и т.д.) и часто является причиной инфекционных поражений у критических больных. В США у 10% госпитализированных развивается нозокомитальная инфекция. Это 2 миллиона человек, 580 тысяч смертей и затраты на лечение около 4,5 биллионов долларов.
Нарушения кишечной барьерной функции, выражающиеся в атрофии слизистой и нарушении проницаемости, у критических больных развиваются достаточно рано и бывают выражены уже на 4-е сутки голодания. Многими исследованиями был показан благоприятный эффект раннего энтерального питания (первые 6 часов от поступления) для предотвращения атрофии слизистой.
При отсутствии энтерального питания происходит не только атрофия слизистой кишечника, но и атрофия так называемой ассоциированной с кишечником лимфоидной ткани (gut-associated lymphoid tissue – GALT). Это Пейеровы бляшки, мезентериальные лимфоузлы, лимфоциты эпителия и базальной мембраны. Поддержание нормального питания через кишечник способствует поддержанию иммунитета всего организма в нормальном состоянии.
Принципы нутриционный поддержки
Одним из основоположников учения об искусственном питании Арвидом Вретлиндом (A. Wretlind) были сформулированы принципы нутриционный поддержки:
Своевременность.
Искусственное питание необходимо начинать как можно раньше, еще до развития нутриционных нарушений. Нельзя дожидаться развития белково-энергетической недостаточности, поскольку кахексию гораздо проще предупредить, чем лечить.
Оптимальность.
Искусственное питание необходимо проводить до стабилизации нутриционного статуса.
Адекватность.
Питание должно покрытать энергетические потребности организма и быть сбалансировано по составу питательных веществ и отвечать потребностям больного в них.
Оценка энергетических потребностей больного
При проведении нутриционной поддержки (энтерольного и парентнрального питания) необходимо правильно оценить энергетические потребности больного. Оценка энергетических потребностей у критического больного может осуществляться расчетными способами или с помощью непрямой калориметрии.
Наиболее просто оценить начальную энергетическую потребность у критического больного как 25 - 35 небелковых килокалорий на кг массы тела в день. Энергетические затраты обычно находятся в пределах 1500-3000 ккал.
Существуют более точные и сложные формулы расчета, такие какуравнение Харриса – Бенедикта.
Уравнение включает в себя рост, вес, возраст и пол больного с добавлением так называемого стрессорного фактора:
ЕОО (мужчины) = 66 + (13,7хМТ) + (5хР) - (6,8хВ)
ЕОО (женщины) = 655 + (9,6хМТ) + (1,8хР) - (4,7хВ)
где ЕОО - основной обмен (ккал)
МТ - масса тела (кг)
Р - рост (см)
В - возраст (лет).
Хирургическое вмешательство может добавить до 10%, тяжелая травма до 30%, сепсис от 20 до 50 % и тяжелые ожоги до 100% к расчетным показателям.
В среднем расчетные методы достаточно точно соответствуют реальному расходу энергии, но в каждом конкретном случае колебания могут быть от -30 до +50% и никогда нельзя точно предугадать окажется ли энергопотребность данного конкретного больного выше или ниже расчетного уровня. Таким образом, допустимо отклонение в расчетах у критических больных на 20-30%.
Для различных условий энергетическая потребность вычисляется путём умножения основного обмена на различные коэффициенты:
Состояние покоя на койке - 1,2.
Амбулаторные условия - 1,3.
Анаболические состояния - 1,5.
При стрессовых ситуациях интенсивность энергопотребления изменяется, и в зависимости от состояния больного суточная потребность в энергии предположительно может быть следующей:
После плановых абдоминальных операций - 30-40 ккал/кг.
После радикальных операций по поводу рака - 50-60 ккал/кг.
При тяжелых механических скелетных травмах - 50-70 ккал/кг.
При черепно-мозговых травмах - 60-80 ккал/кг.
Более точная оценка энергопотребностей проводится для каждого больного путем непрямой калориметрии в условиях основного обмена (по потреблению кислорода и выделению углекислоты). Существуют специальные блоки для аппаратов ИВЛ, позволяющие осуществлять эти измерения. Поскольку поддержание параметров основного обмена в течение всех суток может быть затруднительным, то в последнее время появились исследования, показывающие возможность измерения в течение 30 мин или 2 часов. Они довольно точно предсказывают суточные параметры, если исследование осуществляется между 11 и 15 часами и при параметрах АД, пульса и ЧД близких к среднесуточным. Подробнее: Оценка энергетических потребностей больного .
Энтеральное питание
Энтеральное питание (ЭП) – вид нутритивной терапии, при которой питательные вещества вводятся перорально или через желудочный (внутрикишечный) зонд.
Энтеральное питание относится к видам искусственного питания и, следовательно, не осуществляется через естественные пути. Для проведения энтерального питания необходим тот или иной доступ, а также специальные приспособления для введения питательных смесей.
Некоторые авторы относят к энтеральному питанию только методы, минующие ротовую полость. Другие включают сюда и пероральное питание смесями, отличными от обычной пищи. В таком случае выделяют два основных варианта: зондовое питание – введение энтеральных смесей в зонд или стому, и "сиппинг" (sipping, sip feeding) – пероральный прием специальной смеси для энтерального питания маленькими глотками (как правило, через трубочку).
Преимущества энтерального питания
Энтеральное питание имеет ряд преимуществ перед питанием парентеральным:
Энтеральное питание более физиологично.
Энтеральное питание более экономично.
Энтеральное питание практически не вызывает опасных для жизни осложнений, не требует соблюдения условий строгой стерильности.
Энтеральное питание позволяет в большей степени обеспечить организм необходимыми субстратами.
Энтеральное питание предотвращает развитие атрофических процессов в желудочно-кишечном тракте.
Показания к энтеральному питанию
Показаниями к проведению ЭП, являются практически все ситуации, когда пациенту с функционирующим желудочно-кишечным трактом невозможно обеспечить потребности в белке и энергии обычным, пероральным путем.
Общемировой тенденцией является применение энтерального питания во всех случаях когда это возможно хотя бы потому, что стоимость его значительно ниже, чем парентерального, а эффективность выше.
Впервые показания для энтерального питания были четко сформулированы A.Wretlind, A.Shenkin (1980):
Энтеральное питание показано, когда пациент не может есть пищу (отсутствие сознания, нарушения глотания и др.).
Энтеральное питание показано, когда пациент не должен есть пищу (острый панкреатит, желудочно-кишечное кровотечение и др.).
Энтеральное питание показано, когда пациент не хочет есть пищу (нервная анорексия, инфекции и др.).
Энтеральное питание показано, когда обычное питание не адекватно потребностям (травмы, ожоги, катаболизм).
Согласно "Инструкции по организации энтерального питания ..." МЗ РФ выделяют следующие нозологические показания к применению энтерального питания:
Белково-энергетическая недостаточность при невозможности обеспечения адекватного поступления нутриентов естественным пероральным путем.
Новообразования, особенно локализованные в области головы, шеи и желудка.
Расстройства центральной нервной системы: коматозные состояния, цереброваскулярные инсульты или болезнь Паркинсона, в результате которых развиваются нарушения пищевого статуса.
Лучевая и химиотерапия при онкологических заболеваниях.
Заболевания желудочно-кишечного тракта: болезнь Крона, синдром мальабсорбции, синдром короткой кишки, хронический панкреатит, язвенный колит, заболевания печени и желчных путей.
Питание в пред- и раннем послеоперационном периодах.
Травма, ожоги, острые отравления.
Осложнения послеоперационного периода (свищи желудочно-кишечного тракта, сепсис, несостоятельность швов анастомозов).
Инфекционные заболевания.
Психические расстройства: нервно-психическая анорексия, тяжелая депрессия.
Острые и хронические радиационные поражения.
Противопоказания к энтеральному питанию
Энтеральное питание является методикой, которая интенсивно исследуется и применяется у все более разнообразных групп больных. Происходит ломка стереотипов по поводу обязательного голодания у больных поле операций на желудочно-кишечном тракте, у больных непосредственно после выведения из состояния шока и даже у больных с панкреатитами. Вследствие этого нет единого мнения по поводу абсолютных противопоказаний для энтерального питания.
Абсолютные противопоказания к энтеральному питанию:
Клинически выраженный шок.
Ишемия кишечника.
Полная кишечная непроходимость (илеус).
Отказ больного или его опекуна от проведения энтерального питания.
Продолжающееся желудочно-кишечное кровотечение.
Относительные противопоказания к энтеральному питанию:
Частичная обструкция кишечника.
Тяжелая неукротимая диарея.
Наружные тонкокишечные свищи с отделяемым более 500 мл\сут.
Острый панкреатит и киста поджелудочной железы. Однако, есть указания, что энтеральное питание возможно даже у больных с острым панкреатитом при дистальном положении зонда и использовании элементных диет, хотя по этому вопросу и нет единого мнения.
Относительным противопоказанием также является наличие больших остаточных объемов пищевых (каловых) масс в кишечнике(по сути – парез кишечника).
Общие рекомендации по проведению энтерального питания
Сформулированы простые и ясные рекомендации проведения энтерального питания (Jane Standen и David Bihari):
Энтеральное питание следует проводить так рано, как это только возможно. Проводить питание через назогастральный зонд, если нет к этому противопоказаний.
Начинать энтеральное питание следует со скоростью 30 мл\час.
Необходимо определить остаточный объем как 3 мл\кг.
Необходимо аспирировать содержимое зонда каждые 4 часа и если остаточный объем не превышает 3 мл\час, то постепенно увеличить скорость питания до достижения рассчетной (25-35 ккал\кг\сут ).
В случаях, если остаточный объем превышает 3 мл\кг, то следует назначить лечение прокинетиками .
Если через 24-48 часов из-за высоких остаточных объемов еще нет возможности кормить больного адекватно, то следует провести зонд в подвздошную кишку слепым методом (эндоскопически или под контролем рентгена).
Следует внушить сестре, проводящей энтеральное питание, что если она не может осуществлять его должным образом, то это значит, что она вообще не может обеспечить больному надлежащий уход.
Обеспечение энтерального питания
Основа обеспечения энтерального питания - создание доступа к желудочно-кишечному тракту.
Выбор доступа для энтерального питания
Выбор точки приложения энтеральной поддержки (желудок, двенадцатиперстная кишка, тощая кишка) обусловливается в основном следующими факторами:
Технической возможностью осуществить доступ.
Риском аспирации желудочного содержимого.
Предполагаемой продолжительностью энтерального питания.
Существуют различные виды доступа в желудочно-кишечный тракт:
Доступ на уровне желудка.
Наиболее простой и физиологичный доступ на уровне желудка позволяет уменьшить риск неаспирационных осложнений (диарея, запор) и осуществить декомпрессию, но требует, чтобы пациент находился в сознании и не имел нарушений моторной функции желудка.
Доступ в проксимальные отделы тонкой кишки.
Доступ в проксимальные отделы тонкой кишки (двенадцатиперстную, тощую) снижает риск аспирации желудочного содержимого и питательной смеси, может применяться при нарушениях сознания, парезе желудка.
Назогастральный или назоеюнальный доступы
Для краткосрочного энтерального питания в сроки до 3 недель обычно используются назогастральный или назоеюнальный доступы.
Доступ через гастро-, дуоденостому.
При проведении нутриционной поддержки средней продолжительности (от 3 недель до 1 года) или длительной (более 1 года) принято использовать чрезкожную эндоскопическую гастро-, дуоденостомию или хирургическую гастро- или еюностомию.
Виды зондов для энтерального питания
Для введения питательных веществ используются назогастральные (назоэнтеральные) и перкутанные зонды. Как правило все зонды являются рентгеноконтрастными.
Назогастральные и назоэнтеральные зонды.
В настоящее время преимущественно используются тонкие пластиковые (силиконовые и полиуретановые) зонды. Они могут несколько различаться по конструкции: иметь разноуровневые отверстия, отводы, быть одно- или двух- или трехпросветными, снабжаться оливами или утяжелителями, которые способствуют их введению. При отсутствии промышленно выпускаемого зонда возможно использование пластиковой трубки соответствующего диаметра. Применение толстых упругих желудочных зондов оправдано лишь как временный доступ, поскольку эти зонды быстро вызывают развитие пролежней.
Перкутанные зонды.
Перкутанные зонды используются при доступах, создаваемых оперативным путем: фарингостомии, шейной эзофагостомии, гастростомии, еюностомии. Наиболее популярным и безопасным методом последние годы является перкутанная (чрескожная) эндоскопически контролируемая гастростомия. Она выполняется с помощью разовых хирургических наборов.
Способы введения питательных смесей в зонд
Существует два основных способа введения питательных смесей в зонд: пассивный (гравитационно-капельный) и активный (ручной или аппаратный).
При пассивном методе непрерывное вливание через зонд осуществляется через стандартные инфузионные системы (с разрушенным фильтром) и регулируется дозатором.
Ручной метод подразумевает дробное введение питательной смеси с помощью шприцев.
Наиболее эффективно введение смесей с помощью насосов-инфузоров, обеспечивающих автоматическую подачу смеси непрерывным, капельным или болюсным путем.
Когда начинать энтеральное питание
В литературе о упоминается о преимуществах “раннего” парентерального питания. Приводятся данные, что у больных с множественными травмами непосредственно сразу после стабилизации состояния, в первые 6 часов от поступления, начинали энтеральное питание. По сравнению с контрольной группой, когда питание начиналось после 24 часов от поступления, отмечено менее выраженное нарушение проницаемости кишечной стенки и менее выраженные полиорганные нарушения.
Во многих реанимационных центрах принята следующая тактика: энтеральное питание должно начинаться так рано, как только это возможно - не только с целью немедленно добиться восполнения энергозатрат пациента, а с целью предупредить изменения в кишечнике, что может быть достигнуто энтеральным питанием при сравнительно малых объемах вводимой пищи.
Теоретическое обоснование раннего энтерального питания.
|
Отсутствие энтерального питания
приводит к: |
|
|
Атрофии слизистой. |
Доказано в экспериментах на животных. |
|
Избыточной колонизации тонкой кишки. |
Энтеральное питание предотвращает это в эксперименте. |
|
Транслокации бактерий и эндотоксинов в портальный кровоток. |
У людей имеется нарушение проницаемости слизистой при ожогах, травме и в критических состояниях. |
Режимы энтерального питания
Выбор режима питания определяется состоянием больного, основной и сопутствующей патологией и возможностями лечебного учреждения. Выбор метода, объема и скорости ЭП определяются индивидуально для каждого больного.
Существуют следующие режимы проведения энтерального питания:
Питание с постоянной скоростью.
Питание через желудочный зонд начинают с изотонических смесей со скоростью 40–60 мл/ч. При хорошей переносимости скорость питания можно увеличивать на 25 мл/ч каждые 8–12 часов до достижения желаемой скорости. При питании через еюностомическую трубку начальная скорость введения смеси должна составлять 20–30 мл/ч, особенно в ближайшем послеоперационном периоде.
При тошноте, рвоте, судорогах или диарее требуется уменьшить скорость введения или концентрацию раствора. При этом следует избегать одновременного изменения скорости питания и концентрации питательной смеси.
Цикличное питание.
Непрерывное капельное введение постепенно "сжимают" до 10–12-часового ночного периода. Такое питание, удобное для больного, можно проводить через гастростому.
Периодическое, или сеансовое питание.
Питание сеансами по 4–6 часов проводят только при отсутствии в анамнезе диареи, синдрома мальабсорбции и операций на желудочно-кишечном тракте.
Болюсное питание.
Имитирует обычный прием пищи, поэтому обеспечивает более естественное функционирование гастроинтестинального тракта. Проводится только при чрезжелудочных доступах. Смесь вводят капельно или шприцем со скоростью не более 240 мл за 30 мин 3–5 раз в день. Первоначальный болюс не должен превышать 100 мл. При хорошей переносимости вводимый объем ежедневно увеличивают на 50 мл. На фоне болюсного кормления чаще развивается диарея.
Обычно если больной не получал питания в течение нескольких дней, постоянное капельное введение смесей предпочтительнее периодического. Непрерывное 24-часовое питание лучше применять и в случаях, когда есть сомнения относительно сохранности функций переваривания и всасывания.
Смеси для энтерального питания
Выбор смеси для энтерального питания зависит от множества факторов: заболевания и общего состояния больного, наличия нарушений пищеварительного тракта пациента, необходимого режима энтерального питания.
Общие требования, предъявляемые к энтеральным смесям.
Энтеральная смесь должна иметь достаточную энергетическую плотность (не менее 1 ккал/мл).
Энтеральная смесь не должна содержать лактозы и глютена.
Энтеральная смесь должна иметь низкую осмолярность (не более 300–340 мосм/л).
Энтеральная смесь должна иметь низкую вязкость.
Энтеральная смесь не должна вызывать избыточной стимуляции кишечной моторики.
Энтеральная смесь должна содержать достаточные данные о составе и производителе питательной смеси, а также указания на наличия генетической модификации нутриентов (белков).
Ни одна из смесей для полного ЭП не содержит достаточного количества свободной воды, необходимого для обеспечения суточной потребности больного в жидкости. Суточная потребность в жидкости обычно оценивается как 1 мл на 1 ккал. Большинство смесей с энергетической ценностью 1 ккал/мл содержат примерно 75% необходимой воды. Поэтому, при отсутствии показаний к ограничению жидкости, количество дополнительно потребляемой пациентом воды должно составлять примерно 25% от общего объема питания.
В настоящее время не используются для энтерального питания смеси, приготовленные из натуральных продуктов или рекомендуемые для детского питания ввиду их несбалансированности и неадекватности потребностям взрослых пациентов.
Для энтерального питания могут быть использованы как элементные (модульные) формулы, так и полимерные формулы, содержащие белки, жиры и углеводы в пропорциях, характерных для обычной диеты. Существуют и так называемые специальные формулы энтерального питания, разработанные для различных категорий больных. Подробнее: Фармакологическая группа - Средства для энтерального питания .
Контроль при проведении энтерального питания
С целью улучшить положение с энтеральным питанием и уменьшить количество осложнений был разработан инфузионный протокол. Он включает в себя стандартные врачебные назначения, обязанности сестры, предусматривает быстрое достижение расчетных потребностей и лимитирует показания к прекращению питания. Этот протокол, основанный на практических рекомендациях, позволил значительно улучшить положение с энтеральным питанием в отделениях интенсивной терапии.
Протокол проведения энтерального питания в отделениях интенсивной терапии
Не начинать энтеральное питание до уточнения положения зонда!
1. Ввести зонд.
2. Снимок брюшной полости для уточнения положения зонда.
1. После введения зонда.
2. Через каждые 3 дня.
3. По дополительным показаниям:__________.
3. Начать введение стандартной смеси для энтерального питания ( изотонической, плотностью 1 ккал\мл ) со скоростью 25 мл\час.
1. Увеличивать скорость каждые 8 часов до достижения рассчетной.
2. Рассчетная скорость (определяется индивидуально):__________.
3. Добавлять 100 мл воды каждые 8 часов в виде болюса.
4. Другие типы формулы:___________.
4. Обязанности сестры:
1. Строгий учет введенных и выделенных объемов.
2. Положение больного с приподнятым головным концом (если нет других противопоказаний).
3. Ежедневное взвешивание больного с отметкой в карте.
4. Отмечать в карте частоту и характер стула.
Не удалять интестинальный зонд без указания врача!
Согласно "Инструкции по организации энтерального питания ..." МЗ РФ при проведении ЭП должны оцениваться показатели состояния питания (нутриционного статуса) и отражаться в "Карте наблюдения больного, получающего энтеральное питание" (вкладыш в медицинскую карту стационарного больного, учетная форма № 003/У), приведенной в главе "Оценка состояния питания".
Приказом также оговаривается, что "контроль за эффективностью энтерального питания осуществляется лечащим врачом совместно с членом бригады нутритивной поддержки с помощью мониторинга ряда показателей состояния больного".
Необходим контроль следующих показателей:
Клинические данные: температура тела, пульс, артериальное давление, частота дыхания, метеоризм, стул, потери жидкости (диурез, перспирация, по зондам).
Соматометрические данные : масса тела, ИМТ, окружность плеча, толщина складки над трицепсом, окружность мышц плеча.
Лабораторные данные: общий анализ крови(гемоглобин, эритроциты, лейкоциты, лимфоциты, гематокрит);общий белок крови,альбумин,трансферрин,мочевина,креатинин,холестерин,глюкоза,калий,натрий,кальций,хлориды,АлАТ,АсАТ,билирубин, осмолярность;азот мочевины.
Осложнения энтерального питания
Профилактикой осложнений является строгое соблюдение правил проведения энтерального питания.
Высокая частота осложнений энтерального питания является одним из основных лимитирующих факторов его широкого применения у критических больных. Наличие осложнений ведет к частому прекращению энтерального питания. Для столь высокой частоты осложнений энтерального питания имеются вполне объективные причины.
Энтеральное питание проводится у тяжелой категории больных, с поражением всех органов и систем организма, в том числе жедудочно-кишечного тракта.
Энтеральное питание необходимо лишь тем больным, у которых уже есть интолерантность к естественному питанию по различным причинам.
Энтеральное питание - это не естественное питание, а искусственное, специально приготовленными смесями.
Классификация осложнений энтерального питания
Различают следующие виды осложнений энтерального питания:
Инфекционные осложнения (аспирационная пневмония, синуситы, отиты, инфекция ран при гасто- энтеростомиях).
Гастроинтестинальные осложнения (диарея, запоры, вздутие живота, регургитация).
Метаболические осложнения (гипергликемия, метаболический алкалоз, гипокалиэмия, гипофосфатэмия).
Данная классификация не включает в себя осложнения, связанные с техникой энтерального питания - самоизвлечение, миграция и закупорка зондов и трубок для питания. Кроме того, такое гастроинтестинальное осложнение как регургитация может совпадать с таким инфекционным осложнением как аспирационная пневмония. начная с наиболее частых и значимых.
В литературе указывается частота различных осложнений. Широкий разброс данных объясняется тем, что, не выработано единых диагностических критериев для определения того или иного осложнения и нет единого протокола ведения осложнений.
Высокие остаточные объемы - 25%-39%.
Запор - 15,7%. При длительном энтеральном питании частота запоров может увеличиваться до 59%.
Диарея - 14,7%-21% (от2 до 68%).
Вздутие живота - 13,2%-18,6%.
Рвота - 12,2%-17,8%.
Регургитация - 5,5%.
Аспирационная пневмония – 2%. По разным авторам частота аспирационных пневмоний указывается от 1 до 70 процентов.
Классификация осложнений энтерального питания
Различают следующие виды осложнений энтерального питания:
Инфекционные осложнения (аспирационная пневмония, синуситы, отиты, инфекция ран при гасто- энтеростомиях).
Гастроинтестинальные осложнения (диарея, запоры, вздутие живота, регургитация).
Метаболические осложнения (гипергликемия, метаболический алкалоз, гипокалиэмия, гипофосфатэмия).
Данная классификация не включает в себя осложнения, связанные с техникой энтерального питания - самоизвлечение, миграция и закупорка зондов и трубок для питания. Кроме того, такое гастроинтестинальное осложнение как регургитация может совпадать с таким инфекционным осложнением как аспирационная пневмония. начная с наиболее частых и значимых.
В литературе указывается частота различных осложнений. Широкий разброс данных объясняется тем, что, не выработано единых диагностических критериев для определения того или иного осложнения и нет единого протокола ведения осложнений.
Высокие остаточные объемы - 25%-39%.
Запор - 15,7%. При длительном энтеральном питании частота запоров может увеличиваться до 59%.
Диарея - 14,7%-21% (от2 до 68%).
Вздутие живота - 13,2%-18,6%.
Рвота - 12,2%-17,8%.
Регургитация - 5,5%.
Аспирационная пневмония – 2%. По разным авторам частота аспирационных пневмоний указывается от 1 до 70 процентов.
Остаточные объемы, рвота, регургитация и аспирация
Остаточный объем - это объем содержимого, которое остается в желудке (кишке) во время проведения энтерального питания. Остаточный объем используют как критерий толерантности к проводимому питанию. Он зависит главным образом от состояния моторики желудка (кишечника). У больных в критическом состоянии, с черепно-мозговой травмой, на ИВЛ, получающих седативные препараты, моторика желудка часто оказывается сниженной. Критический остаточный объем, при получении которого следует прекращать энтеральное питание, часто определяют как 200 мл или 3 мл\кг. Наличие остаточного объема в желудке у критического больного опасно возникновением рвоты, регургитации и аспирации. При наличии таких осаточных объемов некоторые авторы предлагают прекращать энтеральное питание и через 6 часов пытаться возобновить его, другие же предпочитают назначение прокинетиков.
Если не удается наладить питание в течение 24-48 часов через желудок, то рекомендуют устанавливать зонд за привратник или за трейцеву связку. При этом следует дренировать желудок.
Использование широких зондов для питания может способствовать регургитации из-за нарушения функции пищеводных сфинктеров.
При развитии аспирационной пневмонии смертность оценивается от 41 до 100% и зависит от количества аспирированного объема и степени вовлечения легочной ткани. Рентгенологическая картина аспирационной пневмонии полностью проявляется в течение первых 24 часов. Если аспирация диагностирована, то рекомендуют эвакуировть из трахеобронхиального дерева как можно больше аспирата, провести лаваж, санационную бронхоскопию, декомпрессию желудка с обязательным уточнением положения зонда. Необходимо помнить что рвота и регургитация могут возникать при миграции зонда из желудка. В качестве поддерживающей терапии при аспирационной пневмонии проводится ИВЛ.
В качестве мер профилактики регургитации и аспирации рекомендуют четкое соблюдение протокола, мониторинг остаточных объемов, правильную постановку зонда и контроль его положения, подъем изголовья кровати на 35-40°, избежание позиции ничком.
Диарея
Осложнение не столь опасное для больного, как аспирация. Понос - частое осложнение энтерального питания (от 2 до 68%). Диареей при проведении энтерального питания проедлагают считать не менее, чем пятикратный жидкий стул в течение 24 часов или жидкий стул объемом боле 2000 мл\день. Полуоформленный стул не следует считать диареей, даже если его частота 6-7 раз в день.
Причин диареи указывается много. Во-первых кишечная инфекция или интоксикация, так как смеси для энтерального питания являются хорошей средой для роста микроорганизмов, а отделения интенсивной терапии - хорошим поставщиком последних. Диарею может вызвать введение различных медикаментов. Многие суспензии для перорального применения (такие как ацетаминофен, витамины, кодеин, другие противокашлевые препараты) содержат сорбитол, способный вызвать диарею. Также диарею могут спровоцировать Н 2 -блокаторы, антациды, содержащие Мg, дигоксин, ингибиторы ангиотензин-конвертирующего фермента, гидралазин, а также прокинетики. Также причиной диареи могут стать антибиотики. Эритромицин из-за своих прокинетических свойств и все остальные как причина развития дисбактериоза.
Следующая группа причин диареи связана с особенностями смесей для энтерального питания и функциональным состоянием желудочно-кишечного тракта. Диарея может развиваться из-за высокой осмолярности смесей. В норме содержимое просвета желудочно-кишечного тракта изоосмолярно плазме крови. Считается, что диарею могут вызывать смеси с осмолярностью выше 400мосм\л. Если причина диареи в осмолярности, то переход с болюсного введения на постоянное, снижение скорости введения смеси или применение менее высоких концентраций могут ее остановить.
Причиной диареи также может быть отсутствие пищевых волокон в смесях.
У длительно голодавших больных может развиться атрофия желез с тотальной ферментной недостаточностью. В таком случае следует перейти на полуэлементные или элементные смеси и подумать о заместительной ферментной терапии.
У длительно голодавших больных наблюдается миграция бактерий толстого кишечника вверх по желудочно-кишечному тракту с накоплением в его просвете недопереваренных веществ, токсинов и т. д. При возобновлении питания и начале нормального функционирования желудочно-кишечного тракта происходит «сброс» этих токсических продуктов. Отсюда два вывода: при возникновении диареи не следует сразу же прекращать энтеральное питание, так как при его возобновлениии все проблемы могут проявиться с новой силой.
Не следует применять препараты, замедляющие пассаж по желудочно-кишечному тракту (имодиум).
Необходимо проводить профилактику дисбактериоза. Она заключается в своевременном начале энтерального питания, включении в диету пищевых волокон, применении биопрепаратов.
Вздутие живота
Вздутие живота определяется как видимое вздутие при ежедневном осмотре, тимпанит при перкуссии или отсутствие кишечных шумов. Вздутие живота может быть обусловлено парезом кишечника и тогда энтеральное питание прекращается до выяснения причин пареза и до его устранения. В таком случае вздутие сочетается с высокими остаточными объемами и отсутствием перистальтики. Причины пареза, как правило, внешние, не связанные непосредственно с проведением энтерального питания.
Однако иногда вздутие наблюдается на фоне активной перистальтики и при низких остаточных объемах. Причиной повышенного газообразования может быть лактазная недостаточность, неадекватный подбор смеси (например введение натуральных продуктов в подвздошную кишку), дисбактериоз. Ведение больных со вздутием кишечника при низких остаточных объемах не разработано. Может помочь коррекция темпа введения и изменение качественного состава питательной смеси, заместительная ферментная терапия, лечение дисбактериоза, а также применение симптоматических средств - активированного угля или эспумизана. Эти препараты не всасываются из просвета кишечника и не оказывают какого-либо неблагоприятного воздействия на организм. Применение их оправдано, так как пеногашение может улучшить процесс пищеварения и наряду с другими мерами привести к его полной нормализации, не говоря уже о благоприятном влиянии уменьшения вздутия на вентиляцию и микроциркуляцию в кишечнике.
Запоры
Запор определяется как отсутствие самостоятельного стула в течение 2-3 дней или необходимость применения дополнительных средств для его получения. Частота запоров значительно увеличивается при хроническом энтеральном питании. Обычно смеси для энтерального питания являются рафинированными продуктами, не содержащими пищевых волокон, необходимых для нормального функционирования толстой кишки. Для хронического энтерального питания рекомендуются файбер-содержащие смеси. Запоры также могут быть обусловлены малоподвижностью больного и недостаточным введением жидкости. Борьба с запорами - коррекция диеты, применение слабительных препаратов или БАД к пище, обогащенных ПВ и клизмы.
Метаболические осложнения
Большинство из метаболических осложнений связано с несбалансированностью вводимых смесей. В литературе перечисляются следующие метаболические осложнения:
Гипергликемия.
Гиперкалиемия.
Гипокалемия.
Гипофосфатэмия.
Дефициты микроэлементов.
Дефициты витаминов.
Дефициты эссенциальных жирных кислот.
Электролитные нарушения у больных реанимационного профиля достаточно легко выявляются при адекватном лабораторном контроле. При хроническом энтеральном питании могут проявиться недостаточности витаминов и микроэлементов. При использовании сбалансированных смесей таких осложнений наблюдаться не должно. Гипергликемия может возникнуть у тяжелого больного в связи с относительной недостаточностью инсулярного аппарата. Она легко поддается мониторированию и может быть скоррегирована введением инсулина извне при необходимости.
В литературе описан «синдром возобновления питания». «Синдром возобновления питания» («refeeding syndrom») проявляется у гиперметаболических или сильно истощенных больных при возобновлении питания и выражается в гипокалиемии и гипофосфатемии, которые развиваются в связи с возникновением повышенной потребности в этих электролитах. Впервые синдром возобновления питания был описан при интенсивном питании заключенных, вернувшихся со второй мировой войны. Развивалось патологическое состояние с летаргией, диареей, слабостью и разнообразными электролитными нарушениями, иногда с летальным исходом.
Миграция, закупорка зондов и трубок
Проведение питательных зондов за привратник - процедура, требующая определенных навыков, временных и технических затрат. Поэтому случаи случайного извлечения зонда всегда являются досадным осложнением. Их частота оценивается от 58 до 100%. Причина - чаще всего самоизвлечение зонда больным из-за ощущаемого дискомфорта, недостаточного осознания важности процедуры, неадекватности, нарушений сознания. Повторная постановка зонда неприятна не только из-за затраты сил и средств, но и тем, что на какое-то время (иногда достаточно продолжительное) энтеральное питание оказывается прерванным. Способы предупреждения самоизвлечения предлагаются как вполне традиционные - фиксация и седация неадекватного больного , так и достаточно оригинальные - фиксация зонда с помощью специальной «уздечки».
Возможно, что затрата времени на беседу с больным о важности энтерального питания избавит врача от затрат времени на перестановку зонда. Орошение ротоглатки раствором лидокаина или смазывание зонда дикаиновой мазью может снять на время неприятные ощущения, но может и нарушить защитные рефлексы, увеличив опасность аспирации.
Достаточно высока частота осложнений при проведении еюнальной трубки через гастростому (до 70%) - окклюзия, дислокация, перегиб, разрыв еюнальной трубки, ретроградная миграция. При чем при хроническом энтеральном питании с течением времени на передний план выходят осложнения, связанные с питательной трубкой. Некоторые авторы высокую частоту самоизвлечения, миграции зондов и трубок рассматривают как аргумент в пользу еюностомии.
Наблюдается также закупорка правильно и надежно поставленного хорошего зонда, так как примерно в 33% случаев ее не удается устранить ни промыванием, ни введением проводника и требуется перестановка зонда (питательной трубки). В отделениях интенсивной терапии частота закупорки зондов примерно 25%. Для предотвращения закупорки зондов питательной смесью существуют различные схемы. Один из стандартных протоколов - промывание зонда каждые 4 часа 50 мл воды или после болюсных введений. Часто закупорка зондов связана с введением через них медикаментов. Существуют медикаменты, не имеющие парентерального аналога, при применении готовых суспензий частота окклюзий несколько ниже чем при дроблении таблеток. Тем не менее, таблетированные формы дробятся для введения в зонд. Не должны дробиться сублингвальные, буккальные формы, а также формы со сложным покрытием, предназначенные для всасывания в различных отделах желудочно- кишечного тракта. Хорошо раздробленные таблетки растворяются в не менее чем 10 мл воды. Желатиновые капсулы могут быть раскрыты и содержимое растворено в воде или же капсула целиком растворяется в теплой воде. Существуют таблицы химической несовместимости медикаментов. Тем не менее, все сочетания, при чем еще и включая питательную формулу, предвидеть нельзя. Поэтому рекомендуется дискретное введение медикаментов разнесенное по времени, с предварительным и последующим промыванием 50 мл воды. Частота окклюзий при нахождении зонда в желудке выше (44%) чем при положении в двенадцатиперстной кишке (15%) что связывают с кислотностью содержимого.
Прочие осложнения
К «прочим» отнесены осложнения в основном связанные с техникой энтерального питания.
При длительном нахождении зонда в пищеварительном тракте могут возникнуть эрозии слизистой оболочки носа, глотки и пищевода. Они более вероятны при использовании поливинилхлоридных зондов, которые через 7-10 дней становятся жесткими. Полиуретановые и силиконовые зонды могут находиться в пищеварительном тракте до 6-8 недель без образования пролежней. При использовании зонда из красной резины пролежень может возникнуть уже через 24 часа.
Синуситы и отиты достаточно часто возникают у больных с назогастральными зондами и с нарушениями сознания. При постановке диагноза зонд извлекается, назначаются солевые капли, вазаконстрикторы и антибиотики в течение 3-4 дней.
Описываются такие осложнения слепых методов введения зондов как перфорация трахеи и бронхов, напряженный пневмоторакс, перфорация слизистой ротоглотки, пищевода, двенадцатиперстной кишки и даже - интракраниальная миграция зонда. Это связано с использованием жестких проводников-мандренов для введения тонких зондов.
Существует возможность возникновения сердечных аритмий при манипуляциях в области рефлексогенных зон рото- и носоглотки.
При использовании хирургических методов для создания доступа для энтерального питания возникает и группа соответствующих осложнений. Это пневмоперитонеум, инфекция вокруг раны, внутрибрюшной абсцесс, гранулемы, кровотечения, миграция пищевой трубки по желудочно-кишечному тракту с развитием кишечной непроходимости и т. д.
О стерильности при энтеральном питании
В качестве одного из преимуществ энтерального питания перед парентеральным называют не обязательность его стерильности. Однако необходимо помнить, что с одной стороны, смеси для энтерального питания являются идеальной средой для размножения микроорганизмов и, с другой стороны, в отделениях интенсивной терапии есть все условия для бактериальной агрессии. Опасность представляет как возможность заражение больного микроорганизмами из питательной смеси, так и отравление образовавшимся эндотоксином. Необходимо принимать во внимание, что энтеральное питание всегда проводится в обход бактерицидного барьера ротоглотки и, как правило, энтеральные смеси не подвергаются обработке желудочным соком, который обладает выраженными бактерицидные свойства. В качестве других сопутствующих развитию инфекции факторов называют антибактериальную терапию, угнетение иммунитета, сопутствующие инфекционные осложнения и др.
Обычными рекомендациями по предотвращению бактериальной контаминации являются: использование объемов приготовленной на месте смеси не более 500 мл. И использование их в течение не более чем 8 часов (для стерильных заводских растворов - 24 часов). Практически в литературе нет экспериментально обоснованных рекомендаций по частоте замены зондов, мешков, капельниц. Представляется обоснованным, что для капельниц и мешков это должно быть не реже чем раз в 24 часа.
Парентеральное питание
Парентеральное питание (ПП) - это особый вид заместительной терапии, при котором питательные вещества для восполнения энергетических, пластических затрат и поддержания нормального уровня обменных процессов вводят в организм, минуя желудочно-кишечный тракт непосредственно во внутренние среды организма (как правило, в сосудистое русло).
Сущность парентерального питания состоит в обеспечении организма всеми необходимыми для нормальной жизнедеятельности субстратами, участвующими в регуляции белкового, углеводного, жирового, водно-электролитного, витаминного обмена и кислотно-щелочного равновесия.
Классификация парентерального питания
Полное (тотальное) парентеральное питание.
Полное (тотальное) парентеральное питание обеспечивает весь объём суточной потребности организма в пластических и энергетических субстратах, а также поддержание необходимого уровня обменных процессов.
Неполное (частичное) парентеральное питание.
Неполное (частичное) парентеральное питание является вспомогательным и направлено на избирательное восполнение дефицита тех ингредиентов, поступление или усвоение которых не обеспечивается энтеральным путем. Неполное парентеральное питание рассматривают как дополнительное питание, если оно применяется в сочетании с зондовым или пероральным введением пищевых веществ.
Смешанное искусственное питание.
Смешанное искусственное питание представляет собой сочетание энтерального и парентерального питания в случаях, когда ни одно из них не является преобладающим.
Основные задачи парентерального питания
Восстановление и поддержание водно-электролитного и кислотно-основного равновесия.
Обеспечение организма энергетическими и пластическими субстратами.
Обеспечение организма всеми необходимыми витаминами, макро- и микроэлементами.
Концепции парентерального питания
Разработаны две основные концепции ПП.
1. "Американская концепция" – система гипералиментации по S. Dudrick (1966) – подразумевает раздельное введение растворов углеводов с электролитами и источников азота.
2. "Европейская концепция", созданная A. Wretlind (1957), подразумевает раздельное введение пластических, углеводных и жировых субстратов. Ее более поздним вариантом является концепция "три в одном" (Solasson С, Joyeux H.; 1974), согласно которой все необходимые компоненты питания (аминокислоты, моносахариды, жировые эмульсии, электролиты и витамины) смешиваются перед введением в едином контейнере в асептических условиях.
В последние годы во многих странах начали применять методику парентерального питания "все в одном" с использованием 3-х литровых контейнеров для смешивания в одном пластиковом мешке всех ингредиентов. При невозможности смешивания растворов "три в одном", инфузия пластических и энергетических субстратов должна проводиться параллельно (желательно через V-образный переходник).
В последние годы выпускаются уже готовые смеси аминокислот и жировых эмульсий. Преимущества этого метода сводятся к минимуму манипуляций с ёмкостями, содержащими питательные вещества, уменьшается их инфицированность, снижается риск гипегликемии и гиперосмолярной некетоновой комы. Недостатки: склеивание жировых частиц и образование больших глобул, могущих быть опасными для больного, не решена проблема окклюзии катетера, не известно, как долго эта смесь может безопасно находиться в холодильнике.
Основные принципы парентерального питания
Своевременное начало проведения парентерального питания.
Оптимальность срока проведения парентерального питания (до восстановления нормального трофического статуса).
Адекватность (сбалансированность) парентерального питания по количеству вводимых питательных веществ и степени их усвоения.
Правила проведения парентерального питания
Нутриенты должны вводится в форме адекватной метаболическим потребностям клеток, то есть аналогичной поступлению нутриентов в кровяное русло после прохождения энтерального барьера. Соответственно: белки в виде аминокислот, жиры – жировых эмульсий, углеводы – моносахаридов.
Необходимо строгое соблюдение соответствующей скорости введения питательных субстратов.
Пластические и энергетические субстраты должны вводиться одновременно. Обязательно применение всех незаменимых нутриентов.
Инфузия высокоосмолярных растворов (в особенности превышающих 900 мосмоль/л) должна проводиться только в центральные вены.
Инфузионные системы для ПП меняются каждые 24 часа.
При проведении полного ПП включение в состав смеси концентратов глюкозы является обязательным.
Потребность в жидкости составляет для стабильного больного 1 мл/ ккал или 30 мл/кг массы тела. При патологических состояниях потребность в воде возрастает.
Показания к проведению парентерального питания
При проведении парентерального питания важно учитывать, что в условиях прекращения или ограничения поступления питательных веществ экзогенным путём вступает в действие важнейший приспособительный механизм: расходование мобильных запасов углеводов, жиров организма и интенсивное расщепление белка до аминокислот с последующим превращением их в углеводы. Такая метаболическая активность, будучи вначале целесообразной, призванной обеспечить жизнедеятельность, в последующем весьма отрицательно сказывается на течении всех жизненных процессов. Поэтому целесообразно покрыть потребности организма не за счёт распада собственных тканей, а за счёт экзогенного поступления питательных веществ.
Главным объективным критерием для применения парентерального питания является выраженный отрицательный азотистый баланс, который не удаётся корригировать энтеральным путём. Средняя суточная потеря азота у больных реанимационного профиля составляет от 15 до 32 г, что соответствует потерям 94-200 г тканевого белка или 375-800 г мышечной ткани.
Основные показания к проведению ПП можно разделить на несколько групп:
Невозможность перорального или энтерального приема пищи в течение не менее 7 дней у стабильного больного, или в более короткие сроки у пациента истощенного (эта группа показаний обычно связана с нарушениями функции желудочно-кишечного тракта).
Выраженный гиперметаболизм или значительные потери белка, когда только энтеральное питание не позволяет справиться с дефицитом нутриентов (классическим примером является ожоговая болезнь).
Необходимость временного исключения кишечного пищеварения "режим отдыха кишечника" (например, при язвенном колите).
Показания к проведению полного парентерального питания
Полное парентеральное питание показано во всех случаях, когда невозможно принятие пищи естественным путём или через зонд, что сопровождается усилением катаболических и угнетением анаболических процессов, а также отрицательным азотистым балансом:
В предоперационном периоде у больных с явлениями полного или частичного голодания при заболеваниях ЖКТ в случаях функционального или органического поражения его с нарушением пищеварения и резорбции.
В послеоперационном периоде после обширных операций на органах брюшной полости или осложнённом его течении (несостоятельность анастомозов, свищи, перитонит, сепсис).
В посттравматическом периоде (тяжёлые ожоги, множественные травмы).
При усиленном распаде белка или нарушении его синтеза (гипертермия, недостаточность функций печени, почек и др.).
Реанимационным больным, когда больной длительное время не приходит в сознание или резко нарушена деятельность ЖКТ (поражения ЦНС, столбняк, острые отравления, коматозные состояния др.).
При инфекционных заболеваниях (холера, дизентерия).
При нервно-психических заболеваниях в случаях анорексии, рвоты, отказа от пищи.
Противопоказания к проведению парентерального питания
Абсолютные противопоказания к проведению ПП
Период шока, гиповолемии, электролитных нарушений.
Возможность адекватного энтерального и перорального питания.
Аллергические реакции на компоненты парентерального питания.
Отказ больного (или его опекуна).
Случаи, в которых ПП не улучшает прогноз заболевания.
В некоторых перечисленных ситуациях элементы ПП могут использоваться в ходе комплексной интенсивной терапии пациентов.
Противопоказания к применению отдельных препаратов для парентерального питания
Противопоказания к применению отдельных препаратов для парентерального питания определяют патологические изменения в организме, обусловленные основным и сопутствующими заболеваниями.
При печёночной или почечной недостаточности противопоказаны аминокислотные смеси и жировые эмульсии.
При гиперлипидемии, липоидном нефрозе, признаках посттравматической жировой эмболии, остром инфаркте миокарда, отёке головного мозга, сахарном диабете, в первые 5-6 суток постреанимационного периода и при нарушении коагулирующих свойств крови противопоказаны жировые эмульсии.
Необходимо соблюдать осторожность у больных с аллергическими заболеваниями.
Обеспечение парентерального питания
Инфузионная техника
Основным способом парентерального питания является введение энергетических, пластических субстратов и других ингредиентов в сосудистое русло: в периферические вены; в центральные вены; в реканализованую пупочную вену; через шунты; внутриартериально.
При проведении парентерального питания спользуют инфузионные насосы, электронные регуляторы капель. Инфузия должна проводится в течение 24 часов с определенной скоростью, но не более 30-40 капель в минуту. При такой скорости введения не происходит перегрузки ферментных систем азотсодержащими веществами.
Доступ
В настоящее время используются следующие варианты доступов:
Через периферическую вену (с помощью канюли или катетера) применяется обычно при инициализации парентерального питания в сроки до 1 сут или при дополнительном ПП.
Через центральную вену с помощью временных центральных катетеров. Среди центральных вен предпочтение отдается подключичной вене. Реже используется внутренняя яремная и бедренная вена.
Через центральную вену с помощью постоянных центральных катетеров.
Через альтернативные сосудистые доступы и внесосудистые доступы (например, перитонеальную полость).
Режимы парентерального питания
Круглосуточное введение питательных сред.
Продленная инфузия (в течение 18–20 часов).
Циклический режим (инфузия в течение 8–12 часов).
Препараты для парентерального питания
Основные требования, предъявляемые к средствам для парентерального питания
Исходя из принципов парентерального питания, средства для парентерального питания должны соответствовать нескольким основным требованиям:
Обладать питательным действием, то есть иметь в своем составе все необходимые для организма вещества в достаточном количестве и надлежащих соотношениях друг с другом.
Пополнять организм жидкостью, так как многие состояния сопровождаются обезвоживанием организма.
Крайне желательно наличие дезинтоксикационного и стимулирующего действия у применяемых средств.
Желательно заместительное и противошоковое действие применяемых средств.
Необходимо убедиться в безвредности применяемых средств.
Важная составляющая - удобство применения.
Характеристики средств для парентерального питания
Для грамотного применения питательных растворов для парентерального питания необходимо оценить некоторые их характеристики:
Осмолярность растворов для парентерального питания.
Энергетическая ценность растворов.
Границы максимальных инфузий – темп или скорость инфузии.
При планировании парентерального питания необходимые дозы энергетических субстратов, минералов и витаминов рассчитывают, исходя из их суточной потребности и уровня потребления энергии.
Компоненты парентерального питания
Основные составляющие парентерального питания принято разделять на две группы: донаторы энергии (растворы углеводов - моносахариды и спирты и жировые эмульсии) и донаторы пластического материала (растворы аминокислот). Средства для парентерального питания состоят из следующих компонентов:
Углеводы и спирты - являются основными источниками энергии при парентеральном питании.
Сорбит (20%) и ксилит используются как дополнительные источники энергии с глюкозой и жировыми эмульсиями.
Жиры являются наиболее эффективным энергетическим субстратом. Вводятся в виде жировых эмульсий.
Белки - являются важнейшей составной частью для построения тканей, крови, синтеза протеогормонов, ферментов.
Солевые растворы: простые и сложные, вводятся для нормализации водно-электролитного и кислотно-щелочного равновесия.
Витамины, микроэлементы, анаболические гормоны также включают в комплекс парентерального питания.
Подробнее: Фармакологическая группа - Средства для парентерального питания .
Оценка состояния пациента при необходимости проведения парентерального питания
При проведении парентерального питания необходимо учитывать индивидуальные особенности больного, характер заболевания, обмена веществ, а также энергетические потребности организма.
Оценка питания и контроль адекватности парентерального питания.
Целью является определение типа и степени нарушения питания, а также потребности в питательной поддержке.
Состояние питания в последние годы оценивается на основании определения трофического или трофологического статуса, который рассматривается как показатель физического развития и здоровья. Трофическая недостаточность устанавливается на основании анамнеза, соматометрических, лабораторных и клинико-функциональных показателей.
Соматометрические показатели являются наиболее доступными и включают в себя измерение массы тела, окружности плеча, толщины кожно-жировой складки и вычисление индекса массы тела.
Лабораторные тесты.
Сывороточный альбумин. При снижении его ниже 35 г/л число осложнений увеличивается в 4 раза, летальность в 6 раз.
Сывороточный трансферрин. Снижение его свидетельствует об истощении висцерального белка (норма 2г/л и более).
Экскреция креатинина, мочевины, 3-метилгистидина(3-МГ) с мочой. Уменьшение содержания креатинина и 3-МГ экскретируемых с мочой, указывает на дефицит мышечного белка. Соотношение 3-МГ/креатинин отражает направление обменных процессов в сторону анаболизма или катаболизма и эффективность парентерального питания по коррекции белковой недостаточности (выделение с мочой 4,2 мкМ 3-МГ соответствует распаду 1 г мышечного белка).
Контроль концентрации глюкозы в крови и в моче: появление сахара в моче и повышение концентрации глюкозы в крови более 2 г/л требует не столько увеличения дозы инсулина, сколько уменьшения количества вводимой глюкозы.
Клинико-функциональные показатели: снижение тургора тканей, наличие трещин, отёков и др.
Энергетические потребности организма.
Контроль за проведением парентерального питания
Параметры мониторинга показателей гомеостаза при проведении полного ПП были определены в Амстердаме в 1981 г.
Контроль ведется за состоянием метаболизма, наличием инфекционных осложнений и эффективностью питания. Такие показатели, как температура тела, частота пульса, артериальное давление и частота дыхания определяются у пациентов ежедневно. Определение основных лабораторных показателей у нестабильных пациентов в основном проводится 1–3 раза в сутки, при питании в до- и послеоперационном периоде 1–3 раза в неделю, при длительном ПП – 1 раз в неделю.
Особое значение придается показателям, характеризующим адекватность питания – белкового (азот мочевины,альбумин сывороткиипротромбиновое время), углеводного (глюкоза кровииглюкоза мочи), липидного (триглицериды сыворотки).
Осложнения парентерального питания
Выделяют технические, метаболические, органопатологические и септические осложнения. Профилактикой всех видов осложнений является строгое соблюдение всех правил введения парентеральных растворов и мониторирование показателей гомеостаза.
Технические осложнения
Технические осложнения обычно связаны с созданием доступа к сосудистой системе: пневмоторакс и гидроторакс, эмболия, надрыв катетернесущей вены и др. Их профилактика связана с соблюдением техники установки и эксплуатации внутривенного питающего тракта.
На границе технических и инфекционных осложнений стоят тромбозы (и тромбофлебиты) катетера, центральной и периферической вен.
Метаболические осложнения
Метаболические осложнения обычно связаны с неразумным введением питательных субстратов. К метаболическим осложнениям относят гипо- и гиперсостояния: гипер- и гипогликемии, дизэлектремии (гипер- и гипокалиемия, натриемия, хлоремия, фосфатемия и т.д.), гипертриглицеридемии и др. Также могут развиваться нарушения осмолярности (гиперосмолярная кома). К метаболическим осложнениям также относят расстройства кислотно-щелочного состояния: гиперхлоремический ацидоз и др.
Наиболее часто метаболические нарушения связаны с введением углеводных растворов. Применение глюкозы небезопасно, в особенности при интенсивной терапии критических состояний. Ее избыточное введение или недостаточное инсулиновое прикрытие могут привести к гипергликемии и глюкозурии с развитием гиперосмолярного синдрома.
Высокий темп введения аминокислотных растворов может вызывать азотемию. Повышение уровня азота требует изменить режим инфузии.
ПП в течение длительного времени может приводить к развитию гиповитаминоза и гипомикроэлементоза. Наиболее характерен дефицит витамина К, проявляющийся нарушением коагуляции.
К метаболическим близки органопатологические осложнения, обусловленные нарушением функции органов в условиях искусственного питания.
Органопатологические осложнения
Дыхательные осложнения - гиперкапния при введении избытка моносахаридов, особенно в виде концентрированных растворов. У истощенных больных при введении смеси рост образования СО 2 может не сопровождаться увеличением минутного объема дыхания, что приводит к дыхательным нарушениям.
Введение углеводных растворов приводит к активации липонеогенеза с формированием жировой инфильтрации печени. При развитии стеатогепатита необходимо уменьшать общую калорийность питания, либо увеличивать пропорцию жировой эмульсии.
Синдром реабилитации - при форсированном использовании моносахаридов, на фоне анаболизма калий, магний и фосфат перемещаются во внутриклеточное пространство.
При избыточном введении белка стимулируется вентиляция пациентов с хроническими обструктивными заболеваниями легких, в связи с чем может развиться легочная дисфункция.
В случаях, когда стандартные аминокислотные растворы вводятся больным с нарушениями функции печени, можно ожидать ухудшение состояния психики, связанное с печеночной энцефалопатией.
При длительном, преимущественно полном ПП, возникает ряд органопатологических осложнений: заболевания желчного пузыря, связанные с изменениями в составе желчи и снижением сократительной активности желчного пузыря; нарушения в костной ткани, обусловленные изменением метаболизма витамина D.
Септические осложнения
Септические осложнения чаще всего связаны с нарушением правил асептики и антисептики. Инфекционным осложнением являются катетерные инфекции с развитием ангиогенного сепсиса.
Профилактика инфекционных осложнений заключается в соблюдении правил асептики, уходе за катетерами, использовании силиконированных венозных катетеров и защитных пленок.
Осложнения, связанным с введением жировых эмульсий
Наиболее частым нарушением при введении жировых эмульсий является развитие гипертриглицеридемии, вызванное высоким темпом введения эмульсий и нарушениями метаболизма липидов. Для профилактики гипертриглицеридемии добавляют гепарин в расчете 1–10 ЕД на 1 мл эмульсии, что улучшает клиренс триглицеридов через механизм стимуляции липазы липопротеинов.
Различают ранние и поздние осложнения, связанным с введением жировых эмульсий.
Ранние осложнения обусловлены острыми реакциями на инфузию (одышка, цианоз, аллергии, тошнота, рвота, головная боль, боль в пояснице, лихорадка, головокружение, потоотделение, воспаление в месте инфузии) и реакциями гиперчувствительности.
Поздние осложнения (синдром перегрузки жирами) проявляются гепатомегалией с холестазом и гематологическими нарушениями (спленомегалия, тромбоцито- и лейкопения).
Энтеральное или парентеральное питание?
Нутриционная поддержка, то есть обеспечение организма необходимым количеством энергии и строительных субстратов для его жизнедеятельности, является абсолютно необходимой частью интенсивной терапии. Осуществление ее через желудочно-кишечный тракт является наилучшим и наиболее безопасным методом. Если нет значительных потерь жидкости через кишечник, пареза и массивного гастродуоденального кровотечения, то в любом случае следует проверить насколько пищеварительный тракт пригоден для энтерального питания.
Альтернативное - парентеральное питание используют только при невозможности проведения энтерального (кишечные свищи со значительным отделяемым, синдром короткой кишки или мальабсорбции, кишечная непроходимость и др.).
Парентеральное питание по стоимости в несколько раз превосходит энтеральное. При его проведении требуется строгое соблюдение стерильности и скорости введения ингредиентов, что сопряжено с определенными техническими трудностями. Парентеральное питание дает достаточное количество осложнений. Есть указания на то, что парентеральное питание может угнетать собственный иммунитет.
В любом случае при проведении полного парентерального питания наступает атрофия кишечника – атрофия от бездеятельности. Атрофия слизистой ведет к ее изъязвлению, атрофия секретирующих желез ведет к возникновению в последующем ферментной недостаточности, происходит застой желчи, неконтролируемый рост и изменение состава кишечной микрофлоры, атрофия ассоциированной с кишечником лимфоидной ткани.
Энтеральное питание более физиологично. Оно не требует стерильности. Смеси для энтерального питания содержат все необходимые компоненты. Расчет потебности в энтеральном питании и методика его проведения значительно проще, чем при парентеральном питании. Энтеральное питание позволяет поддерживать желудочно-кишечный тракт в нормальном физиологическом состоянии и предотвращать многие осложнения, возникающие у больных в критическом состоянии. Энтеральное питание ведет к улучшению кровообращения в кишечнике и способствует нормальному заживлению анастомозов после операций на кишечнике. Таким образом, во всех случаях, когда это возможно, выбор способа нутриционной поддержки должен склоняться в сторону энтерального питания.
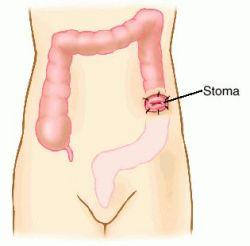
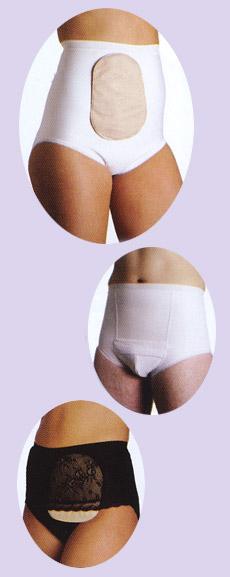
Пластина стома Coloplast 6764 (Дания)
А дгезивные
пластины Coloplast 6764 предназначены для
пациентов с коло- и илеостомой. Не
вызывают раздражения кожи, изготовлены
из мягкого, не пропускающего запах
материала. Имеют размер фланцевого
соединения: 60 мм.Особенности:
дгезивные
пластины Coloplast 6764 предназначены для
пациентов с коло- и илеостомой. Не
вызывают раздражения кожи, изготовлены
из мягкого, не пропускающего запах
материала. Имеют размер фланцевого
соединения: 60 мм.Особенности:
Не вызывает раздражения кожи
Эластичная и гибкая
Из мягкого, не пропускающего запах материала
Имеет фильтр с активированным углем
Мягкая и гибкая пластина. Пластина сделана из мягкого и гибкого материала, который следует за движениями кожи и мешка. Уникальная конструкция пластины позволяет проникнуть пальцами под фланцевое соединение пластины и правильно закрепить на ней мешок. Она также обеспечивает оптимальную защиту стомы. Эффективный фильтр. Закрытые мешки и Мини Кап мешки имеют встроенный автоматический фильтр, устраняющий неприятные запахи при прохождении газов через активированный уголь. Автоматический газовый клапан регулирует давление в мешке, предотвращая его надувание. Емкость фильтра может быть увеличена путем прокалывания иглой дополнительных отверстий в нем. Двойной клеевой слой, не вызывающий раздражения кожи. Пластина позволяет быстро и часто менять мешки, не повреждая кожу. Внутреннее гибкое кольцо из адгезива Curagard (Курагард) абсорбирует влагу и активно защищает кожу. Наружное кольцо из микропористой пленки обеспечивает полную безопасность и позволяет коже дышать. Мягкий, не пропускающий запах материал. Мешки сделаны из бесшумного мягкого материала, не пропускающего газы и запахи. Мягкая задняя поверхность мешка, соприкасающаяся с кожей, покрыта мягким нетканым материалом, 100% полиэстером. Это не только создает дополнительное удобство при ношении мешка, но и позволяет коже дышать. Технические характеристики:
Размер фланцевого соединения, мм: 60
Размер отверстия, мм: 35 -55
Свищи
(fistulae; синоним фистулы)
патологические ходы, выстланные грануляционной тканью или эпителием, соединяющие патологический очаг в мягких тканях или костях, полый орган либо полость организма с окружающей средой или между собой.
В зависимости от этиологического фактора различают С. врожденные и приобретенные, по отношению к окружающей среде — наружные (сообщающиеся с окружающей средой) и внутренние (не сообщающиеся с поверхностью тела). По характеру отделяемого выделяют С. слизистые, гнойные, слюнные (см. Слюнные свищи), с истечением цереброспинальной жидкости, молочные, желчные (см. Желчные свищи (Жёлчные свищи)), каловые, мочевые; иногда наблюдаются смешанные свищи. С. обозначают также по органу, с патологией которого связано образование свища, например желудочные, пищеводные, Кишечные свищи, бронхиальные свищи (Бронхиальный свищ), Мочевые свищи.
Врожденные С. являются следствием пороков развития. Они выстланы эпителием (эпителизированные С.). Наиболее распространены срединные и боковые С. шеи (Шея) и С. пупка (см. Пупочная область). Срединные С. шеи чаще связаны с аномалиями развития щитовидной железы (Щитовидная железа). Боковые (бранхиогенные) С. шеи возникают при нарушении облитерации протоков вилочковой железы из сохранившихся остатков эмбриональных жаберных щелей или в результате вскрытия нагноившейся бранхиогениой кисты. Пупочные С. развиваются в результате незаращения эмбрионального пупочно-кишечного хода или мочевого протока.
Приобретенные С. возникают при наличии воспалительного очага и новообразования, в результате травмы и оперативного вмешательства. Воспалительные очаги в мягких тканях, костях, суставах, органах (см. Абсцесс, Остеомиелит, Флегмона) могут прорываться наружу, образуя, если не происходит полного отхождения некротизированных тканей, наружные С. (гнойные, желчные и др.). Гнойники, прорываясь в окружающие ткани и органы, формируют внутренние С. — между очагами в мягких тканях, между очагом в мягких тканях и полым органом.
Возникновение С. при новообразованиях объясняется распадом проросшей в соседние органы и ткани злокачественной опухоли. В этих случаях могут наблюдаться маточно-пузырные, влагалищно-прямокишечные, межкишечные, бронхоплевральные и другие С.
При травме и операциях образование С. может быть обусловлено повреждением полого органа или некрозом его стенки вследствие нарушения кровообращения, возникновением и прорывом гнойного очага наружу, несостоятельностью швов стенки полого органа или оставленным в тканях инфицированным инородным телом — марлевой салфеткой, лигатурой (так называемый лигатурный свищ, рис. 1) и др.
По строению С. могут быть гранулирующими и эпителизированными. Типичный гранулирующий, так называемый трубчатый, свищ представляет собой относительно длинный, узкий, извитой, иногда с многими ответвлениями ход, имеющий одно внутреннее и одно или несколько наружных отверстий. С морфологической точки зрения подобный С. является незавершенным, несформированным, поскольку стенки его покрыты не эпителием, а грануляционной тканью (Грануляционная ткань) (рис. 2). Заживлению гранулирующих С. препятствуют механическое воздействие на ткани непрерывного тока отделяемого, разрушающее действие на грануляции химически активных веществ (например, пищеварительных ферментов), разрушение грануляций и угнетение репаративных процессов в окружающих С. тканях микробными токсинами. Эти же факторы при значительной длине С. препятствуют эпителизации его стенок, т.е. превращению гранулирующего С. в эпителизированный. Самостоятельное заживление гранулирующего С. возможно при устранении патологического очага (при отхождении или удалении секвестра или инородного тела), стойком прекращении тока содержимого из полого органа.
Эпителизированные С. не имеют выраженного свищевого канала. В морфологическом отношении они являются завершенными, сформированными и самостоятельно не закрываются. Вариантом эпителизированного С. служит губовидный С. (рис. 3), в котором слизистая оболочка полого органа, например кишки, непосредственно срастается с кожей (по типу губы).
Наружные С. проявляются возникновением наружного отверстия и выделением из него в различных количествах и разного характера жидкого содержимого. При длительном существовании С. его отделяемое раздражает окружающую кожу, вызывая Дерматиты (рис. 4). Особенно выраженные изменения кожи наблюдаются вокруг желудочного С., свища двенадцатиперстной или тощей кишки в связи с разъедающим действием пищеварительных соков, вокруг мочевых С. Для С. туберкулезной этиологии, С. при Актиномикозе характерны бледность и отечность грануляций вокруг свищевого отверстия, специфический характер отделяемого. Общее состояние больных с наружными С. нарушается в связи с основным заболеванием, обусловившим появление С. (туберкулезом, злокачественной опухолью, длительным гнойным процессом и др.), и с обильным истечением через С. отделяемого. Так, при С. желудка и особенно тощей кишки большая потеря пищеварительных соков, белков, электролитов, воды приводит к резкому нарушению всех видов обмена, кислотно-щелочного равновесия, снижению массы тела; при обильном истечении желчи нарушаются процессы переваривания пищи, свертываемость крови и др.
Выраженные клинические проявления наблюдаются при внутренних, межорганных С. Большую опасность представляют те свищи, при которых в орган через свищ проникает несвойственное ему содержимое. Так, при бронхопищеводном С. пища, попадающая в бронхи, может вызвать острую асфиксию (Асфиксия), а в последующем аспирационную пневмонию (Пневмония); при кишечно-мочепузырном С. кишечное содержимое, попадая в мочевой пузырь, может привести к развитию уросепсиса (см. Сепсис) и т.п.
Диагноз наружных С. основывается на жалобах больного, данных анамнеза, наличии наружного отверстия С. и характерного отделяемого Для уточнения направления свищевого хода, его длины, ширины, количества и характера ответвлений, связей с патологическим очагом применяют зондирование (рис. 5), контрастную рентгенографию (см. Фистулография). Отделяемое исследуют на присутствие соляной кислоты (при подозрении на желудочный С.), мочекислых солей (при подозрении на мочевой С.) и т.п. Появление окрашенной мокроты при введении красителя (например, метиленового синего) в плевральную полость свидетельствует о бронхоплевральном С.; введение красителя в С. области заднего прохода позволяет по окрашиванию содержимого прямой кишки установить наличие сообщения С. с просветом кишки.
Диагноз внутренних С. основан на данных клинического и лабораторного исследований функций соответствующих органов, а также данных рентгенологического исследования. С появлением фиброэндоскопов малого диаметра возросло значение фистулоскопии (см. Эндоскопия).
Лечение определяется формой и стадией формирования С. Оно может быть консервативным, оперативным, чаще комбинированным. При лечении гранулирующих С. ликвидацию очага воспаления в глубине тканей осуществляют консервативными методами (антибактериальные средства, физиотерапия и др.). При каждой перевязке кожу, окружающую С., очищают и смазывают стерильным вазелином, синтомициновой эмульсией или пастой Лассара. Необходимо наладить сбор выделений, чтобы они как можно меньше раздражали окружающую кожу и не пачкали белье. Для этого при С. полых органов применяют Дренирование с отведением желчи, мочи и др. в бутыль, а для сбора кишечного содержимого приспосабливают калоприемник. Кожу вокруг С., через которые отделяется желудочный или панкреатический сок, защищают мазями или липкими пленками. При оперативном вмешательстве удаляют секвестры кости, мертвые мягкие ткани, инородные тела создают хороший отток отделяемого, минуя свищевой ход. Желчные С. после установления естественного оттока желчи в двенадцатиперстную кишку, С. мочевого пузыря при восстановлении нормального мочеиспускания заживают самостоятельно. Гранулирующие кишечные С. часто закрывают оперативным путем. При некоторых гранулирующих С., образовавшихся после оперативных вмешательств (например, в результате несостоятельности швов культи бронха, желудочно-кишечного анастомоза), определенное значение имеют эндоскопические лечебные процедуры (удаление лигатур, грануляций, пломбировка дефекта медицинским клеем, временная эндобронхиальная окклюзия поролоновой губкой и т.д.), нередко позволяющие избежать травматичной операции.
Лечение эпителизированных С. оперативное, оно состоит в ликвидации патологического очага, обусловившего возникновение С., и в радикальном иссечении свищевого хода вместе с покрывающим его эпителием.
Искусственные свищи образуют особую группу С., создаваемых преднамеренно оперативным путем с целью восстановления проходимости полого органа, отведения в нужном направлении его содержимого или секрета, а также для обеспечения через него питания организма. Искусственный наружный С. полого органа принято называть стомой (рис. 6), искусственно созданный внутренний межорганный С. — соустьем, анастомозом, а операции по их созданию — стомией. К операциям по образованию стомы относятся гастростомия, колостомия, пиелостомия, трахеостомия, холецистостомия, энтеростомия и др.; к операциям по созданию анастомоза — гастроэнтеростомия, холецистогастростомия, энтероэнтеростомия и др. В зависимости от показаний создают временные и постоянные (необходимые в течение длительного времени) стомы.
Библиогр.: Ванцян Э.И. и др. Наружные и внутренние свищи в хирургической клинике, М., 1982; Чухриенко Д.П. и Белый И.С. Наружные кишечные свищи, Киев, 1975.
Рис. 4. Неполный губовидный тонкокишечный свищ. Кожа передней брюшной стенки вокруг свища с явлениями мацерации и дерматита.
Рис. 6. Больная с одноствольной концевой сигмостомой, сформированной после удаления опухоли прямой кишки (операция Гартмана). В отдаленном послеоперационном периоде произошло выпадение сигмовидной кишки через колостому.
Рис. 3б). Схематическое изображение губовидного свища — полный губовидный свищ: 1 — просвет приводящего отдела тонкой кишки; 2 — передняя брюшная стенка; 3 — слизистая оболочка тонкой кишки; 4 — «шпора»; 5 — просвет отводящего отдела тонкой кишки; 6 — брыжейка тонкой кишки.
Рис. 5. Больная острым гангренозным холецеститом с некрозом стенки пузыря, прорывом на переднюю брюшную стенку и образованием наружного желчного свища. При зондировании и ревизии свища извлечены конкременты желчного пузыря.
Рис. 1. Лигатурные свищи в области послеоперационного рубца передней брюшной стенки.
Рис. 2. Схематическое изображение трубчатого гранулирующего свища: 1 — просвет тонкой кишки; 2 — мышцы передней брюшной стенки; 3 — кожа передней брюшной стенки; 4 — просвет трубчатого свища; 5 — стенка тонкой кишки.
Рис. 3а). Схематическое изображение губовидного свища — неполный эпителизированный свищ: 1 — просвет приводящего отдела тонкой кишки; 2 — передняя брюшная стенка; 3 — слизистая оболочка тонкой кишки; 4 — просвет отводящего отдела тонкой кишки; 5 — брыжейка тонкой кишки.
свищи душа через нос! — ( иноск. шут.) спи! Ср. Заснули мертвецким сном... Свищи душа через нос! сказал Куренев, в роде приветствия первому знакомому своему, и принялся за дело. Даль. Степнячок. См. спать как убитый. … (Большой толково-фразеологический словарь Михельсона)
Свищи душа через нос! — Свищи душа черезъ носъ! ( иноск. шут.) спи! Ср. Заснули мертвецкимъ сномъ... Свищи душа черезъ носъ! сказалъ Куреневъ, въ родѣ привѣтствія первому знакомому своему, и принялся за дѣло. Даль. Степнячокъ. См. Спать как убитый.… (Большой толково-фразеологический словарь Михельсона (оригинальная орфография))
ищи свищи — разг. you can whistle for it… (Большой англо-русский и русско-английский словарь)
Ищи-свищи — ИСКАТЬ, ищу, ищешь; несов.… (Толковый словарь Ожегова)
Свищеватый — прил. 1. Имеющий свищи… (Современный толковый словарь русского языка Ефремовой)
ветер — муж. wid; breeze (легкий) встречный порыв ветра couterblast гонимый ветром blow наполняться ветром to bag, to belly (out) (о парусах) неистовый порыв ветра borasca, borasco, borasque очень крепкий ветер мор. fresh gale сильный порыв ветра… (Большой англо-русский и русско-английский словарь)
|
| |
|
Send to a Friend Больные со стомой | |
|
|
|
|
Больные со стомой – это лица, которые в результате болезни или операции вынуждены осуществлять отправление естественных потребностей искусственным путем при помощи трубки-вывода, отходящей от прямой кишки или мочевого пузыря и выходящей наружу через стенки брюшной полости.
Стомированным больным сразу же после операции трудно смириться с мыслью о ведении нормальной повседневной жизни в новых условиях с образованной стомой. Со временем, постепенно следует привыкание и адаптация. Чтобы вести нормальный образ жизни, нужно научится быстро и правильно ухаживать за стомой и преодолеть психологический барьер - в чем, несомненно, помогут Вам близкие люди. Спустя некоторое время, когда уже привыкнете к ежедневному опорожнению и смене мешочков, Вы не будете так много думать об этом, а после реабилитации и возвращения на работу Вы даже забудете.
В соответствии с критериями Института Национального Страхования в Израиле, люди со стомой имеют право на 80%-ную медицинскую инвалидность в Израиле. Все то, что указывается в проспекте в отношении прав и льгот, относится в равной мере и к лицам со стомой, после определения процента медицинской инвалидности медицинской комиссией в Израиле. Цель организации людей со стомой в Израиле, являющейся частью Ассоциации по борьбе с раковыми заболеваниями в Израиле, заключается в предоставлении консультаций людям со стомой до и после операции.
Организация в Израиле связана с медицинскими сестрами, работающими со стомами в больницах, которые консультируют больных и ухаживают за ними.
МЕДИЦИНСКИЕ СЕСТЕРЫ, РАБОТАЮЩИХ СО СТОМОЙ Далия Кешет
Амбулаторное отделение (03-5302478/9 – кабинет глав. Медсестры) В кабинете: 03-5303181, 03-5303030 попросить 735. В амбулаторном отделении по средам.
Имея стому, Вы можете заниматься многими видами спорта без больших физических нагрузок. Вы можете путешествовать без ограничения. Перед поездкой возьмите достаточное количество средств по уходу за стомой. Вы можете плавать в естественных водоемах и в бассейне. Посещайте театры, кино, выставки.
Врожденная атрезия анального отверстия Лечение детей в Израиле | |
|
|
|
Стома
Как известно, многие современные познания в медицине восходят еще к эпохам Древней Греции и Древнего Рима. Правда, в технологиях лечения за долгие века произошло немало изменений, а вот что касается терминологии — зачастую даже суперсовременная медицина оперирует теми же понятиями, которыми пользовались наши греко-римские предки. Вот, например, такое слово как «стома». В древнегреческом языке этим словом обозначалось круглое отверстие, устье. В современной хирургии стомой тоже называют искусственно созданное отверстие, с помощью которого полостной орган соединяется с окружающей средой. При поражениях кишечника на брюшную стенку выводят колостому или илеостому, при поражениях мочевого пузыря — уростому. При некоторых заболеваниях дыхательных путей необходимо наложение трахеостомы. В современном греческом языке «стома» означает также круглое отверстие, в том числе и рот, который, по большому счету, является ни чем иным, как отверстием на лицевой части черепа. От этого корня произошло и название науки о строении ротовой полости и, в частности, строении зубов, ее заболеваниях и способах их лечения — стоматологии. Почему именно греческое слово стало основой термина? Скорее всего потому, что именно древнегреческий врач Гиппократ одним из первых дал некоторые описания заболеваний полости рта. Правда, подобные описания встречаются и в древнеиндийских трактатах, но греки и по географическому положению, и по произносимости слов все-таки явно ближе европейцам.
Так что слова «стома» и родственное ему «стоматология», позаимствованные у древних греков, с успехом используются в медицинской терминологии целого ряда европейских стран, в частности и России. Кстати, стоит отметить, что помимо стоматологии, стоматолога и стоматита — воспалительного заболевания слизистой рта — слово «стома» применительно к ротовой полости больше нигде не используется. С чем это связано, точно сказать затруднительно, хотя можно предположить, что Гиппократ, давший описание некоторых стоматологических заболеваний, все же не внес существенного вклада в науку об их лечении. Гораздо большего в этом направлении добились итальянские, а особенно французские стоматологи, вследствие чего и терминология пополнилась словами, заимствованными из романских языков — но это уже совсем другая история. В русском языке стоматологию в течение некоторого времени называли «зубоврачеванием», однако это слово отошло в разряд архаизмов, а вот более древний термин «стоматология» живет и здравствует на протяжении многих веков.
