
Organicheskaya_khimia
.pdf

 O [O]
O [O]
HOOC(CH2)4COOH
адипиновая кислота
nHOOC(CH2)4COOH + n NH2(CH2)6NH2 
гексаметилендиамин
O H
*


 N
N


 N
N  n* O H
n* O H
найлон-6
2. Реакция циклогексанона с гидроксиламином приводит к оксиму циклогексанона. Последний под действием серной кислоты претерпевает перегруппировку Бекмана, превращаясь в капролактам, который гидролизуют, получая ε-аминокапроновую кислоту. Поликонденсация аминокапроновой кислоты приводит к капрону.
O |
NH2OH |
NOH H2SO4 |
||
|
||||
|
|
оксим циклогексанона |
||
|
|
H2O, H+ |
H2N(CH2)5COOH |
|
|
|
O |
||
|
N |
|
||
|
H |
|
ε-аминокапроновая |
|
капролактам |
||||
кислота |
||||
|
|
|
||
n H2N(CH2)5COOH |
O |
N n* |
||
* |
||||
|
|
O |
H |
|
капрон
Из непредельных соединений алициклического ряда следует отметить одно вещество – циклопентадиен-1,3. Это вещество будет рассмотрено в разделе ароматические углеводороды. Здесь следует отметить следующее:
•циклопентадиен существует в виде димера, который образуется в результате реакции Дильса-Альдера. Для получения самого циклопентадиена димер перегоняют.
101
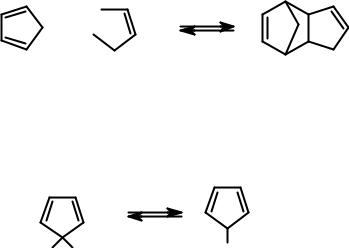
+ 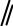
диен |
диенофил |
аддукт |
•циклопентадиен очень легко отдает протон (проявляет высокую кислотность), что совершенно не характерно для углеводородов (причины этого будут рассмотрены в следующем разделе).
+ H+
-
H H H
102
3.2.Ароматические углеводороды
•Бензол и его гомологи. Изомерия, номенклатура. Молекулярная структура бензола. Формула Кекуле. Современные представления о строении бензола. Ароматичность и комплекс свойств, характеризующих ее. Энергия делокализации. Правило Хюккеля, небензоидные ароматические системы. Физические свойства и спектральные характеристики бензола и его гомологов.
•Синтетические методы получения: тримеризация ацетиленовых углеводородов, дегидрирование алициклических углеводородов, реакции алкилирования (по Фриделю-Крафтсу, Вюрцу-Фиттигу, ВюрцуГриньяру). Природные источники ароматических углеводородов (ароматизация нефти и коксование угля).
3.2.1.Бензол и его гомологи
Существует большое количество органических соединений, имеющих простейшую эмпирическую формулу СН. Среди них вещества самых разных классов, обладающие широким спектром химических свойств. К таким веществам относятся и ароматические соединения. Наиболее известное ароматическое соединение – бензол. Термин «ароматический» не означает хороший запах. Нюхать их категорически запрещено, так как они очень токсичны. Сам бензол – нервный, кроветворный (печеночный) и плацентарный яд. В России федеральным законом женщинам запрещено работать с бензолом.
Бензол был получен в 1825 г. М. Фарадеем и синтезирован из бензойной кислоты Э.Митчерлихом в 1834 г. Молекулярная формула С6Н6 была определена очень быстро. Строение молекулы бензола долго оставалась загадкой. Только в 1865 г. А.Кекуле предложил циклогексатриеновую структурную формулу бензола, которую используют и в настоящее время, вкладывая в нее другой смысл.
бензол формула Кекуле
Предложенная Кекуле структурная формула уже в XIX веке противоречила имевшимся экспериментальным фактам.
В соответствии с формулой Кекуле 1,2-дизамещенные бензолы должны существовать в виде двух изомеров. Однако известен единственный орто- дихлорбензол.
103

Cl
Cl |
Cl |
Cl
изомерные дизамещенные циклогексатриены-1,3,5
Для объяснения этого факта была выдвинута теория осцилляции (перемещения) двойных связей (показано стрелками обратимости). Т.е. двойные связи так быстро меняются местами, что мы фиксируем только один изомер.
Молекулярная формула указывает на значительную непредельность бензола. Однако было быстро установлено, что в реакции, характерные для непредельных соединений, бензол не вступает. Классические реакции алкенов, диенов и их циклических аналогов: галогенирование, гидроксилирование, гидратация и др. неосуществимы в ароматическом ряду. Бензол, вступая в реакцию с бромом (в присутствии катализатора), образует не продукт присоединения, а продукт замещения водорода. Вообще для большинства ароматических соединений характерны реакции замещения. Реакции присоединения являются исключением и не характерны для бензола и его гомологов.
Br2 
 Br
Br
Br
Br
Br2
Br
Br
Br2
FeBr3
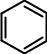
Еще один экспериментальный факт. Энергию непредельных соединений очень часто оценивают по теплоте гидрирования – количеству тепла, выделяющегося при присоединении к двойной связи молекулы водорода. При гидрировании циклогексена выделяется 28,6 ккал/моль. Следовательно, при гидрировании циклогексадиена и циклогексатриена следует ожидать 57,2 и 85,8 ккал/моль соответственно.
104
85,8
H
циклогексадиен
бензол
57,2
49,6
28,6
циклогексен |
циклогексатриен |
|
|
|
Кекуле |
Рис. 26. Теплоты гидрирования циклоенов и бензола
Из рис. 26 ясно, что бензол значительно более устойчив, чем гипотетический циклогексатриен Кекуле. Длины всех углерод-углеродных связей в бензоле одинаковы и равны 1,39 Å. Т.е. бензольное кольцо – правильный шестиугольник, все атомы лежат в одной плоскости, нет ни простых, ни двойных связей.
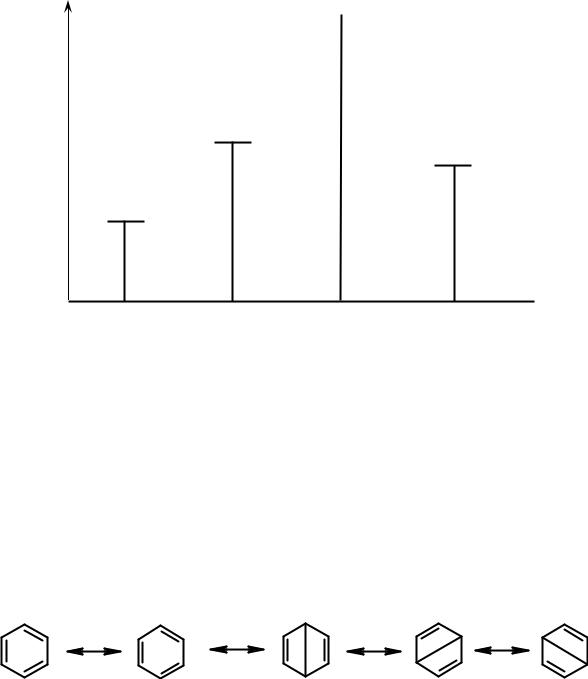
Строение бензола стало понятным только в 30-х года XX века, после появления теории резонанса Л. Полинга (см. раздел «Диены»). Бензол нельзя описать одной структурной формулой, поэтому используется набор граничных структур:
структуры Кекуле |
структуры Дьюара |
Граничные структуры не физически существуют. Они показывают возможное, но не действительное, расположение π-электронов. Реальная молекула – суперпозиция (наложение) граничных структур.
В бензоле атомы углерода находятся в sp2-гибридизованном состоянии. Все они лежат в одной плоскости. Каждый из атомов С имеет одну негибридизованную р-орбиталь, состоящую из двух одинаковых долей, одна из которых находится над плоскостью, а другая – под плоскостью кольца. р- Орбитали каждого атома перекрываются с р-орбиталями соседей. Образуются два торообразных электронных облака (над и под плоскостью цикла). Это
105
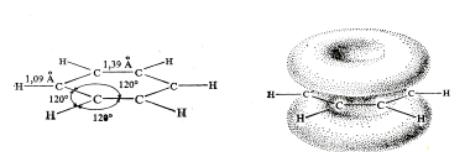
система из 6 делокализованных π-электронов. Важно, что в случае бензола невозможно сказать, какая пара электронов принадлежит каким двум атомам углерода. В бензоле 6 π-электронов делокализованы, т.е. принадлежат в равной степени всем шести атомам углерода кольца. На рис 27 показаны длины связей, валентные углы и форма π-электронных облаков в молекуле бензола.
а |
б |
Рис. 27. Форма и размеры (а) и форма π-электронных облаков (б) молекулы бензола
Показанное строение бензола прекрасно объясняет приведенные выше свойства. Делокализация всегда рассматривается как стабилизирующий фактор. Благодаря равномерному распределению π-электронов бензол на 36 ккал/моль устойчивее гипотетического циклогексатриена. Реакции присоединения нарушают делокализацию π-электронов, что энергетически невыгодно (см. рис. 26). В реакциях замещения сопряжение сохраняется. Разница в энергии между несопряженной молекулой и системой с делокализованными электронами называется энергией делокализации (сопряжения, резонанса). Это энергия, которую необходимо затратить на разрушение системы сопряженных связей. Чем больше энергия делокализации, тем больше выигрыш в энергии.
Бензол - первый и простейший пример соединений ароматического ряда. Часто в органической химии говорят о веществах, проявляющих ароматический характер. Очень важно понимать, что такое ароматичность и на основании каких структурных и других требований вещество может быть отнесено к этой группе.
Единодушно принятого определения ароматичности не существует. Собственно понятие «ароматичность» означает совокупность структурных, энергетических свойств и реакционной способности циклических структур с системой сопряженных связей. Одно из наиболее современных определений ароматичности: ненасыщенная циклическая или полициклическая молекула или ион может рассматриваться как ароматическая, если все атомы цикла входят в полностью сопряженную систему таким образом, что в основном состоянии все π-электроны располагаются только на связывающих молекулярных орбиталях замкнутой оболочки (Реутов, Курц, Бутин, ОХ, т.2).
106
Структурные критерии ароматичности:
•циклическая молекула;
•плоская молекула;
•непрерывная цепь сопряжения;
•в моноциклической системе число участвующих в сопряжении π- электронов равно 4n + 2, где n=0,1,2… (правило Э. Хюккеля, т.е. 2, 6, 10, 14 и т.д. электронов).
Следует понимать, что склонность к реакциям замещения – признак ароматичности, а не критерий.
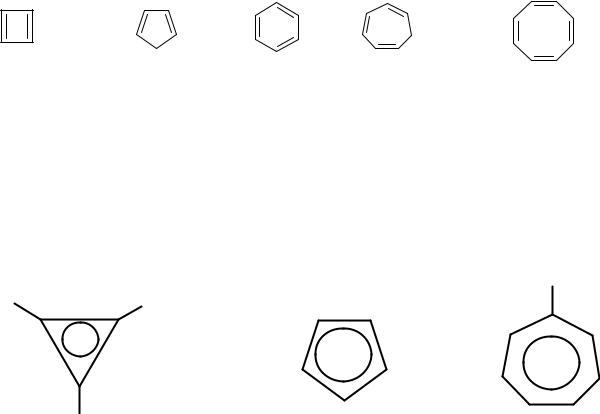
Из приведенных ниже веществ только бензол удовлетворяет всем структурным критериям.
циклобутадиен циклопентадиен |
бензол |
циклогептатриен циклооктатетраен |
В молекулах циклопентадиена и циклогептатриена есть разрыв в цепи сопряжения (имеется sp3-углерод). В молекулах циклобутадиена и циклооктатетраена число π-электронов не соответствует правилу Хюккеля.
Структурные критерии не ограничивают ароматические соединения бензолом и его производными. Известны небензоидные ароматические соединения. Например:
|
|
|
OH |
C6H5 |
C6H5 |
|
|
|
+ |
- |
|
|
|
+ |
|
|
C6H5 |
|
|
трифенилциклопропенилий |
циклопентадиенилий |
тропилий |
|
|
катион |
анион |
катион |
Существует огромное количество полициклических соединений, обладающих ароматическими свойствами:
107
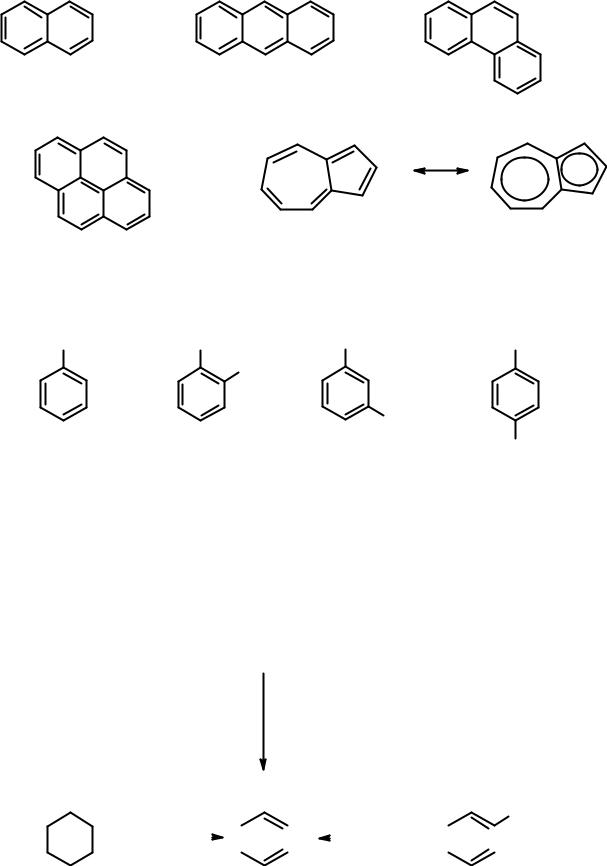
нафталин |
антрацен |
фенантрен |
-
+
пирен |
азулен |
Бензол существует в виде единственного изомера. Дизамещенные бензолы – в виде трех изомеров: орто-, мета- и пара-.
CH3 |
CH3 |
CH3 |
CH3 |
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
CH3 |
толуол |
орто-ксилол |
мета-ксилол |
пара-ксилол |
Основные промышленные источники бензола и его гомологов – каменноугольная смола и нефть.
Синтетически бензол может быть получен дегидрированием циклогексана, тримеризацией ацетилена и декарбоксилированием бензойной кислоты.
3 HC CH
CH
акт C 400o
3H2, Pt, to |
|
|
|
Ca(OH)2, to |
|
|
COOH |
||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гомологи бензола могут быть получены алкилированием бензола по реакциям Фриделя-Крафтса (будет рассмотрена далее), Вюрца-Фиттига (аналог реакции Вюрца в алканах) и Вюрца-Гриньяра.
108
X |
|
Alk |
|
X |
|
|
Zn |
абс. эф. |
+ |
Alk-X |
+ Alk-MgX |
Х- галоген
•Реакция ароматического электрофильного замещения (SEAr). Механизм, понятие о π- и σ-комплексах. Энергетические характеристики реакций
SEAr. Экспериментальные доказательства механизма. Примеры SE реакций: нитрование, галогенирование, алкилирование и ацилирование по Фриделю-Крафтсу, сульфирование. Особенности этих реакций.
Реакции ароматического электрофильного замещения
Как было отмечено выше для бензола характерны реакции замещения. Поскольку над и под плоскостью бензольного цикла есть две тороидальные области повышенной электронной плосности, бензольное кольцо может быть атаковано частицей, имеющей недостаток электронов - электрофилом. Такие реакции обозначают - SEAr – ароматического электрофильного замещения (сокращение читается справа налево).
Реакция SEAr состоит из следующих стадий:
•образование π-комплекса - диполь-дипольное взаимодействие электрофила с ароматической системой;
•образование σ-комплекса - электрофил вытягивает из ароматической системы пару электронов, образуя сигма-связь с атомом углерода;
•реароматизация – отщепление протона с образованием замещенной ароматической молекулы.
109
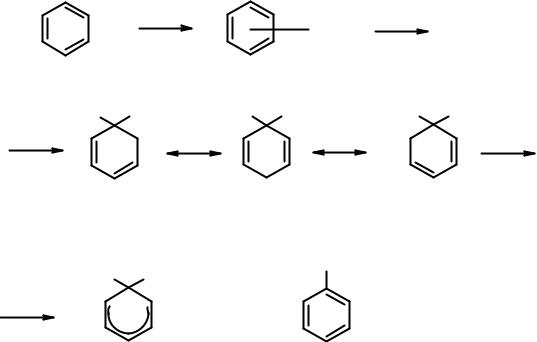
E+
 E+
E+
|
π-комплекс |
|
H E |
H E |
H E |
+ |
|
+ |
+
σ-комплекс (граничные структуры)
E
H E
+  - H+
- H+
σ-комплекс
Строение σ-комплекса может быть показано тремя граничными структурами с различным расположением π-электронов и карбокатионного центра. Реальный σ-комплекс – суперпозиция граничных структур, в котором атом углерода, участвующий в реакции, находится в sp3-гибридизованном состоянии, а остальные - в sp2. Положительный заряд делокализован (распределен) по пяти sp2-углеродным атомам. Следует уяснить, что положительный заряд в ионе возникает вследствие недостатка электронов, а не из-за наличия частицы с положительным зарядом. Следовательно, делокализованный положительный заряд – делокализация четырех электронов по пяти углеродным атомам. Формально можно рассчитать так:
5(углеродов) минус 4 (электрона) = +1 (заряд σ-комплекса).
Впоказанных выше граничных структурах на трех углеродных атомах есть плюс. Это означает, что в σ-комплексе нет идеальной выровненности π- электронной плотности, как в молекуле бензола. На тех атомах, у которых в граничных структурах положительный заряд, электронная плотность ниже, чем
удвух других.
Последняя стадия реакции – реароматизация. Как уже отмечалось, ароматические системы характеризуются высокой устойчивостью (низким содержанием энергии), благодаря делокализации π-электронов (см. энергию сопряжения). Нарушение ароматической системы ведет к увеличению энергии, возврат к ароматическому циклу – к уменьшению. Именно поэтому происходит отщепление протона, а не присоединение к σ-комплексу какой-либо нуклеофильной частицы.
110
