
Organicheskaya_khimia
.pdf
H2C |
|
CH2 |
KMnO4, H2O |
H2C |
|
|
CH2 |
|
|
|
|||||
|
- MnO2 |
|
|
||||
|
|
||||||
|
|
|
OH OH |
||||
|
|
|
|
||||
Реакция легко контролируется визуально, поскольку при образовании гликоля исчезает розовая окраска перманганата и образуется осадок оксида марганца. Поэтому реакция Вагнера может быть использована как качественная реакция на наличие в молекуле кратной связи. Гидроксилирование под действием перманганат-иона протекает стереоселективно и приводит к син- присоединению двух гидроксильных групп. Аналогично протекает гидроксилирование при окислении оксидом осмия OsO4.
Реакция Вагнера - наиболее простой метод получения 1,2-диолов и именно его следует применять при решении задач.
• Алкены. Реакции радикального замещения (аллильное галогенирование).
Полимеризация олефинов и ее разновидности (цепная, ступенчатая, катионная, анионная, радикальная). Стереоспецифическая полимеризация. Полиэтилен, полипропилен.
Реакции замещения в алкильных группах алкенов
Наличие алкильных групп в молекулах алкенов предполагает их способность участвовать в реакциях свободнорадикального замещения. Классической реакцией такого типа является галогенирование. Алканы реагируют с галогенами в газовой фазе при высокой температуре или освещении. Алкены присоединяют галогены в темноте, при низкой температуре и в жидкой фазе. Такие различия в условиях проведения реакции могут быть использованы для подбора условий, позволяющих проводить ионное присоединение или свободнорадикальное замещение.
При высокой температуре (> 300 oС) пропилен вступает в реакцию с хлором с образованием аллилхлорида.
|
Cl |
, 300o |
|
|
2 |
|
Cl |
H2C CH3 |
|
||
|
H C |
||
|
|
2 |
|
sp3-Гибридизованный атом углерода, находящийся по соседству с углеродом двойной связи, называется аллильным. Замещение водорода у аллильного атома – аллильное замещение. Эта реакция - общая для всех алкенов. Аллильное бромирование обычно приводят с использованием N- бромсукцинимида.
61

|
|
|
O |
|
Br |
O |
|
|
|
|
|
|
|
H3C |
CH3 |
+ |
N Br |
H3C |
+ |
NH |
CH3 |
|
|||||
|
|
|
O |
|
|
O |
N-Бромсукцинимид создает постоянную низкую концентрацию атомов брома в реакционной смеси, что благоприятствует течению свободнорадикального замещения.
Следует отметить, что аллильный радикал легче образуется и обладает меньшей энергией, чем алкильные радикалы (причины таких свойств будут рассмотрены в следующих разделах). Как было показано в разделе алканы, свободнорадикальное замещение протекает через образование наиболее стабильного свободного радикала. Это объясняет региоселективность реакции аллильного замещения.
Полимеризация алкенов
Одной из наиболее важных реакций органических соединений, содержащих двойные углерод-углеродные связи, является реакция полимеризации. В настоящее время высокомолекулярные соединения (ВМС, полимеры) проникли во все области человеческой деятельности.
Полимером называют макромолекулу, построенную из большого числа повторяющихся звеньев (фрагментов) низкомолекулярного вещества - мономера. ВМС, состоящее из одинаковых фрагментов, называют гомополимером (чаще просто полимером), построенное из различных фрагментов – гетерополимером (чаще – сополимером).
Полимеризация – процесс получения ВМС, при котором молекулы полимера образуются за счет последовательного присоединения мономера к растущей цепи макромолекулы. Если в процессе участвуют два и более мономера, такую реакцию обычно называют сополимеризацией.
Следует отличать реакции полимеризации от реакций поликонденсации. В полимеризации все атомы мономера входят в молекулу ВМС. В поликонденсации также образуются ВМС, но на каждую образующуюся между молекулами мономера связь выделяется молекула низкомолекулярного вещества (вода, аммиак или галогеноводород).
Простейший пример полимеризации:
nH C |
|
CH |
|
|
|
|
|
CH |
|
CH |
|
|
|
|
|
|
* |
|
|
|
|
|
* |
||||||
2 |
|
|
2 |
|
|
|
2 |
|
2 |
n |
||||
В этой реакции мономером является простейший алкен – этилен. Концевые группировки полимерной цепи отличаются от всех остальных, но их
62
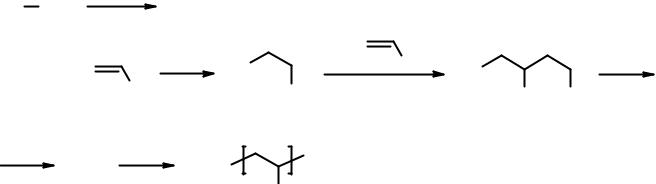
количество и влияние на свойства макромолекулы очень мало. Индекс n - степень полимеризации - указывает число мономерных звеньев в молекуле полимера Название полимера образуется добавлением к названию мономера приставки поли-. В приведенном выше примере, мономером является этилен, а продуктом полимеризации – полиэтилен.
Реакции полимеризации подразделяют на два типа – ступенчатую и цепную. Ступенчатая протекает таким образом, что образующиеся на каждой стадии олигомеры могут быть выделены. Как правило, таким способом получают ди-, три- и тетрамеры. Ступенчатая полимеризация значительно меньше распространена, чем цепная.
Цепная полимеризация сразу приводит к образованию высокомолекулярного соединения. В ходе этого процесса невозможно выделение олигомерных продуктов. Этот тип полимеризации очень распространен, в нем выделяют четыре механизма протекания. Механизм цепной полимеризации зависит от того, каким инициатором пользуются для начала реакции. Различают свободнорадикальную (часто – радикальную), катионную, анионную и координационную полимеризации (последняя будет рассмотрена в разделе «Диены»). Как у всех цепных процессов, в реакции полимеризации выделяют стадии: инициирования, роста и обрыва цепи.
Радикальная полимеризация
В качестве инициаторов используют вещества, способные в условиях реакции (нагревание или фотолиз) образовывать свободные радикалы. Чаще всего используют органические пероксиды.
Реакция начинается с образования свободных радикалов. Радикал взаимодействует с алкеном, образуя алкильный радикал, который присоединяется к следующей молекуле алкена и т.д. Этот процесс продолжается до стадии обрыва цепи, которая может произойти разными способами, например, путем рекомбинации двух свободных алкильных радикалов.
.
R' |
R' |
2R' |
|
|
|
|
|
.R' |
+ |
|
R' |
. |
R |
R' |
. |
|
|
|
|||||
|
R |
|
|
R |
|
|
R R |
|
... |
* |
|
n* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
63
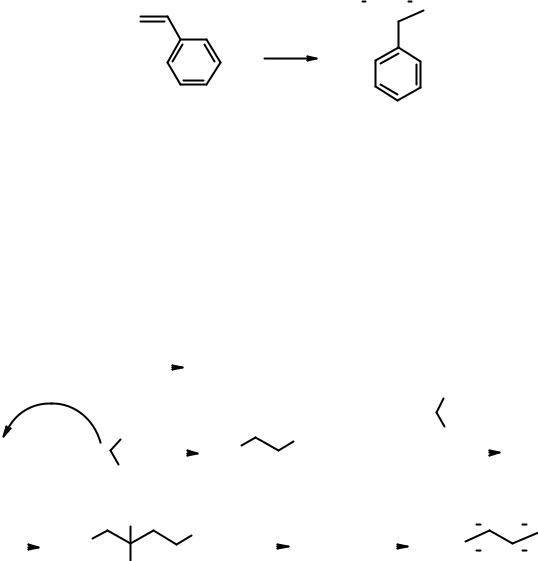
Так как даже следы некоторых веществ могут ингибировать цепной процесс, необходимо использовать очень чистые мономеры. Поэтому мономеры для полимеризации - одни из наиболее чистых органических веществ, производимых в больших масштабах в промышленности.
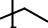
Чаще всего в радикальной полимеризации используются мономеры, у которых образующийся алкильный радикал стабилизирован за счет электронного влияния заместителей. Хорошим примером такого мономера является стирол.
*
 n*
n*
n
стирол полистирол
Катионная полимеризация.
Этот тип полимеризации характерен для алкенов с терминальной двойной связью и двумя донорными группировками, образующими при взаимодействии с электрофилами стабильные третичные катионы. Реакция протекает по цепному ионному механизму под действием минеральных кислот или кислот Льюиса.
Классическим примером катионной полимеризации является получение полиизобутилена, изученное еще А.М. Бутлеровым.
H2O + AlCl3 |
|
|
|
|
|
|
H+[AlCl (OH)]- |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
H+ + |
|
|
CH3 |
|
|
|
H |
+ CH3 |
|
|
|
CH3 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
+ CH3 |
|
|
|
|
|
|
|
|
|
CH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3* |
|||||||
|
H |
|
|
|
|
|
|
|
... |
|
|
* |
|
|
|
|
n |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
CH3 |
|
CH3 |
|
|
|
|
|
|
|
|
|
CH3 |
||||||
полиизобутилен
Анионная полимеризация
В этом варианте реакцию инициируют анионные реагенты (NH2-, RO-, металлорганические соединения). Следует помнить, что для этиленовых углеводородов характерны реакции электрофильного присоединения. В случае анионной полимеризации инициатор – нуклеофил. Поэтому взаимодействовать с нуклеофильным инициатором могут только алкены, несущие
64

электроноакцепторные заместители, снижающие электронную плотность π- связи.
Классический пример анионной полимеризации – получение полиакрилонитрила.
|
|
|
|
|
N |
NH2- |
N |
|
|
|
H2C |
+ H2C |
|
H2N |
- |
N |
|
|
... |
* |
n* |
|
|
|
|
|
|
 N
N
Физико-химические и механические свойства полимеров обусловлены химическим строением, степенью полимеризации, расположением структурных звеньев в пространстве. Чем ближе друг к другу расположены полимерные цепи, тем сильнее Ван-дер-Ваальсово взаимодействие.
Рассмотрим строение полипропилена. Если основная полимерная цепь расположена в плоскости изображения, то метильные группы могут быть расположены тремя способами:
•беспорядочно;
•по одну сторону от плоскости основной цепи;
•попеременно по одну и другую сторону основной цепи. Соответственно различают:
•атактический;
•изотактический;
•синдиотактический полимеры.
|
|
H C |
|
|
|
|
|
|
|
H3C |
|
|
||
H CH3 H |
3 |
|
H |
H CH3 H CH3 |
H |
CH3 |
|
H |
H CH |
|||||
|
|
CH3 |
|
|
|
|
|
|
|
|
|
3 |
||
|
|
|
атактический полипропилен |
|
|
|
|
|||||||
H CH H |
CH |
H |
CH |
H |
CH H |
CH |
H CH |
H |
CH |
H CH |
||||
|
3 |
3 |
3 |
|
3 |
3 |
|
|
|
3 |
3 |
3 |
||
|
|
изотактический полипропилен |
|
|
|
|
||||||||
H |
H3C |
H |
H |
H3C |
|
H |
H |
H3C |
H |
|
|
H3C |
||
CH3 |
CH3 |
|
CH3 |
|
H |
CH3 |
|
|||||||
|
|
|
|
|
|
|
|
|||||||
синдиотактический полипропилен
65
Названия от греческого taktikos – упорядоченный, Isos – равный, одинаковый, sin – вместе, dio – два.
В атактическом полипропилене из-за беспорядочного расположения заместителей цепи находятся далеко друг от друга. Полимер аморфный, мягкий (Тпл. 80о), получают радикальной полимеризацией. В изотактическом полипропилене цепи могут располагаться намного ближе друг к другу. Полимер кристаллический, намного более прочный. Его Тпл. около 170о, что позволяет производить из него различные медицинские приборы, т.к. его можно легко стерилизовать (Тпл. значительно выше 100о).
Аналогичная ситуация и в случаях получения других ВМС (полистирола, полиметилметакрилата, синтетического каучука и др.).
Стереонаправленный синтез полимеров возможен в результате координационной полимеризации (К.Циглер, Дж. Натта) и будет рассмотрен в разделе алкадиены.
66
•Алкины. Гомологический ряд, номенклатура, изомерия. Молекулярная структура ацетилена: sp-гибридизация, параметры связей С≡С и С-Н
(энергия, полярность, поляризуемость). Физические свойства алкинов, способы их идентификации и спектральные характеристики.
•Методы получения: промышленные методы получения ацетилена, из дигалогеналканов или винилгалогенидов, из ацетилена и галогеналканов.
•СН-кислотность алкинов. Реакции, протекающие без разрыва тройной связи: получение ацетиленидов, взаимодействие ацетиленидов с галогеналканами, карбонильными соединениями.
2.3. Алкины (ацетиленовые углеводороды)
Алкины – непредельные углеводороды, два атома углерода которых связаны тройной (одной σ- и двумя π-) связью. Формула гомологического ряда алкинов СnH2n-2. Простейший представитель алкинов – ацетилен С2Н2, поэтому их часто называют ацетиленовыми углеводородами.
Тройная связь образована углеродами, находящимися в sp- гибридизованном состоянии. Строение тройной связи, ее геометрические и энергетические параметры подробно рассмотрены ранее.
Изомерия и номенклатура алкинов
Поскольку тройная связь образована линеарногибридизованными атомами углерода, в алкинах отсутствует геометрическая изомерия, характерная для алкенов. Изомерия алкинов связана только с различиями в углеродном скелете молекулы и положении тройной связи. Возможна межклассовая изомерия (алкины и алкадиены).
CH3 |
CH3 |
|
CH3 |
|
H3C |
|
CH3 |
||
H3C |
H3C |
|
||
гексин-2 |
гексин-3 |
4-метилпентин-2 |
||
метилпропилацетилен |
диэтилацетилен |
метилизопропилацетилен |
||
Простейший представитель ряда – ацетилен. По номенклатуре IUPAC названия алкинов образуют также, как алкенов, только используют окончание –ин вместо –ен. Низшие члены гомологического ряда, имеющие простое строение, часто называют как производные ацетилена, у которого один или оба атома водорода замещены на алкильные группы.
Методы получения
Одно из наиболее важных в химическом отношении органических соединений – ацетилен. Его основной промышленный способ получения базируется на методе, открытом в 1862 г. Ф. Вёлером. Отличительная
67

особенность этого синтеза – использование дешевого и доступного сырья (уголь, известняк и вода) и простых в препаративном отношении реакций.
Уголь  Кокс
Кокс
2000o |
H2O |
|
|
|
|
||
|
CaC2 |
|
H |
|
|
|
H |
|
|
|
|
|
|||
|
|
|
|
|
|||
ацетилен
Известняк  CaO
CaO
Оксид кальция и кокс в электрических печах превращают в карбид кальция, гидролиз которого дает ацетилен.
В другом, менее распространенном способе исходят из природного газа. Частичное окисление метана при высокой температуре приводит к ацетилену.
2 CH4 |
1500o |
HC CH |
В органической химии есть два основных подхода к синтезу:
•в соединении с целевым углеродным скелетом создают необходимую функциональную группу;
•на основе вещества с нужной функцией строят соединение с заданной углеродной структурой.
Оба этих подхода могут быть успешно использованы при синтезе гомологов ацетилена.
Дегидрогалогенирование дигалогенопроизводных. В этом методе возможно использование как вицинальных, так и геминальных алкилдигалогенидов.
Отщепление галогеноводорода от вицинальных производных имеет очень важное значение, т.к. исходные дигалогенопроизводные могут легко быть получены присоединением галогена к соответствующему алкену. Суммарно это метод превращения алкенов в алкины:
H H |
|
KOH спирт |
|
|
|
|
H |
KNH2 |
или KOHтв |
|||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
X |
|
|
|
|
||
|
|
|
|
|
|
|
|
|||||
X X |
|
|
|
|
|
|||||||
В результате первой стадии элиминирования образуются ненасыщенные галогенопроизводные – винилгалогениды. Галоген в этих соединения инертен, в том числе и в реакциях элиминирования. Отщепление галогеноводорода от винилгалогенидов требует применения более жестких условий синтеза – использование сильных оснований, например, твердых щелочей при высокой температуре и повышенном давлении или амидов.
68
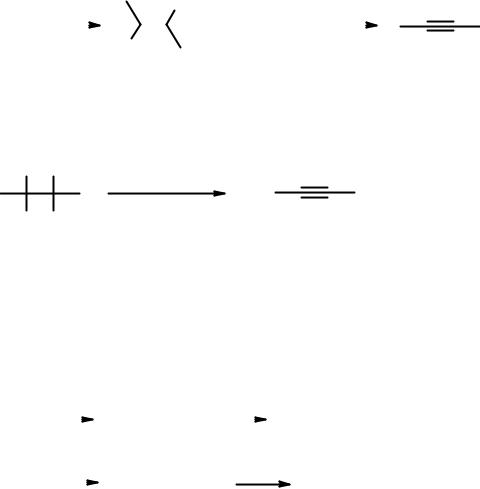
Двухстадийное элиминирование геминальных дигалогенопроизводных приводит к аналогичным результатам.
X |
H |
|
KOH спирт |
|
|
|
|
H KNH2 или KOHтв |
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
|||||
X |
H |
|
|
|
||||||||
Дегалогенирование тетрагалогенопроизводных. Этот метод синтеза алкинов используют очень редко, т.к. сами тетрагалогениды получают из алкинов.
X X
2 Zn
X X
Такое превращение может быть использовано для защиты тройной связи. Сначала алкин превращают в тетрагалогенопроизводное. Затем проводят реакции в другом реакционном центре молекулы, после чего регенерируют тройную связь.
Алкилирование ацетиленидов. Это метод, позволяющий удлинить углеродную цепь алкина:
HC |
|
CH |
|
Na |
|
HC |
|
C |
|
Na+ |
|
R-X |
HC |
|
|
|
R |
||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||
|
|
Na |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||
R |
|
|
CH |
|
|
Na+ C |
|
|
|
R |
R'-X R' |
|
|
|
|
R |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
Вреакции могут быть использованы как сам ацетилен, так и его гомологи
стерминальной тройной связью. Наилучшие результаты дают реакции с первичными галогеноалканами, т.к. вторичные и третичные производные вступают в конкурирующую реакцию элиминирования.
Химические свойства алкинов
Кислотные свойства, образование ацетиленидов
По Бренстеду-Лоури кислота – соединение, способное отдать протон (Н+), а кислотность – мера склонности кислоты к такому процессу. Высокая кислотность характерна для веществ, в которых водород связан с сильно электроотрицательным атомом, чаще всего с кислородом, галогеном, серой, азотом. В этом случае электронная плотность связи сильно сдвинута в сторону гетероатома, что приводит к легкому отщеплению протона. Кроме того, электроотрицательный элемент после отщепления протона лучше удерживает пару электронов, что приводит к увеличению стабильности образующегося аниона и, следовательно, к большей кислотности. При рассмотрении электроотрицательности в ряду F > O > N > C не вызывает удивления, что HF -
69
достаточно сильная кислота, H2O значительно слабее, NH3 чрезвычайно слабая, а СН4 вообще не считают кислотой, поскольку нет оснований, способных оторвать протон от алкана.
Как сам ацетилен, так и его гомологи с концевой тройной углеродуглеродной связью являются слабыми СН-кислотами, способными быть донорами протона при взаимодействии с сильными основаниями. Например, в реакции ацетилена с металлическим натрием или амидом натрия образуется ацетиленид натрия.
Na
HC CH |
HC C Na+ |
NaNH2
ацетиленид
натрия
Алкины проявляют кислые свойства только в апротонных безводных растворителях. Это объясняется тем, что кислые свойства ацетиленовых углеводородов с концевой тройной связью выражены значительно слабее, чем у воды, а связь углерод-металл ближе к ионной, чем к ковалентной. Вода мгновенно гидролизует ацетилениды щелочных металлов.
HC C Na+ + H OH
C Na+ + H OH  HC
HC CH + NaOH
CH + NaOH
Связь С-Н в алкинах образована за счет перекрывания 1s электрона атома водорода и орбитали углерода, находящегося в sp-гибридизованном состоянии. Такой углеродный атом проявляет большую электронную акцепторность, чем sp2- и sp3-гибридизованные атомы и лучше удерживает электроны. В сравнении с sp3-орбиталью, sp-орбиталь обладает более выраженным s характером: она меньше по размеру (см. выше) и электрон лучше удерживается атомом. В результате ацетиленид-анион, пара электронов которого находится на sp- орбитали, обладает большей относительной устойчивостью (имеет меньшую энергию), чем винильный или алкильный катион.
sp3 |
sp2 |
sp |
||||||
H3C |
|
CH3 |
H2C |
|
CH2 |
HC |
|
CH |
|
|
|||||||
|
|
|
||||||
|
||||||||
электроотрицательность, кислотность атома углерода и
стабильность аниона возрастают
sp3 |
sp2 |
|
sp |
|||||||
|
|
|
|
H2C |
|
CH |
|
HC |
|
C |
|
|
|
|
|
|
|||||
H3C |
|
CH |
2 |
|
|
|
||||
|
|
|
||||||||
|
|
|
|
|||||||
|
||||||||||
70
