
Organicheskaya_khimia
.pdf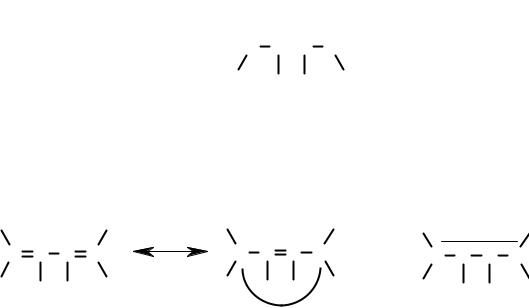
При написании граничных структур следует выполнять следующие требования:
•геометрия ядерных конфигураций граничных структур должна быть одинаковой. Это означает, что при написании канонических структур может изменять только расположение электронов π-, но не σ- связей;
•все канонические структуры должны быть «структурами Льюиса», т.е., например, углерод не может быть пятиковалентным;
•все атомы, участвующие в сопряжении, должны лежать в одной плоскости или близко к одной плоскости. Условие копланарности вызвано необходимостью максимального перекрывания p-орбиталей;
•все граничные структуры должны иметь одинаковое количество неспаренных электронов. Поэтому бирадикальная формула Г бутадиена не является канонической.
 .
.
 .
.
C C C C
C C
Г
Ниже представлены граничные структуры бутадиена (А и Б) и их суперпозиция. Пунктирная линия на указывает делокализацию π-электронов, т.е. на тот факт что в реальной молекуле π-электронная плотность находится не только между 1 и 2, 3 и 4 атомами углерода, но и между 2 и 3 атомами.
C C C C |
C C C C |
C C C C |
A |
Б |
суперпозиционная |
формула |
Чем стабильнее каноническая структура, тем больше ее вклад в реальную молекулу. Следует усвоить тот факт, что граничные структуры – фикция, отражающая возможное, но не реальное расположение π-электронов. Следовательно, «стабильность граничной структуры» - стабильность фикции, а не молекулы, существующей в реальности.
Несмотря на то, что граничные структуры не являются отражением объективной реальности, их использование оказывается весьма полезно для понимания строения и свойств. “Вклад” граничных структур в реальное сопряжение π-электронов пропорционален их стабильности. Такая оценка облегчается при использовании следующих правил:
1)чем в большей степени разделены заряды, тем меньше устойчивость структуры;
81
2)структуры, несущие разделенные заряды, менее устойчивы, чем нейтральные;
3)структуры, имеющие более 2 зарядов, обычно не вносят никакого вклада в сопряжение;
4)самые неэффективные структуры те, которые несут одинаковые заряды на соседних атомах;
5)чем выше электроотрицательность атома, несущего отрицательный заряд, тем более устойчива структура;
6)нарушение длин связей и валентных углов приводит к снижению стабильности структуры (см. структуру Б, указанную выше);
7)большей устойчивостью обладает граничная структура, имеющая больше связей.
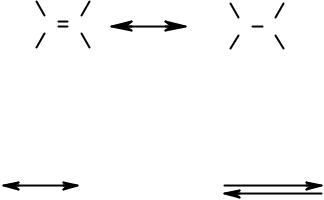
Использование этих правил позволяет утверждать, что хотя формально молекула этилена может быть описана двумя граничными структурами М и Н (см. ниже), вклад структуры Н с разделенными зарядами столь ничтожен, что ее можно исключить из рассмотрения.
C C |
+ C C - |
М |
H |
Следует особо обратить внимание на использованную для перехода между граничными структурами обоюдоострую, т.н. «резонансную» стрелку. Такой знак указывает на фиктивность изображенных структур.
сопряжение |
обратимая |
|
реакция |
Грубейшей ошибкой является использование при описании граничных структур двух однонаправленных в разные стороны стрелок, указывающих на протекание обратимой реакции. Столь же грубой ошибкой является и использование при описании равновесного процесса, т.е. реально существующих молекул, «резонансной» стрелки.
Таким образом, в молекуле бутадиена за счет сопряжения р-орбиталей четырех атомов углерода наблюдается повышение π-электронной плотности между вторым и третьим атомами углерода. Это приводит к некоторой двоесвязанности С-2 и С-3, что выражается в уменьшении длины связи до 0,147 нм, по сравнению с длиной простой связи в 0,154 нм.
Для характеристики связи в органической химии часто используют понятие «порядок связи», который определяется как число ковалентных связей между атомами. Порядок связи может быть рассчитан по разным методикам,
82
одной из которых является определение расстояния между атомами и сравнение его с длинами связей этана (порядок углерод-углеродной связи равен 1), этилена (порядок связи 2) и ацетилена (порядок связи 3). В бутадиене-1,3 связь С2-С3 имеет порядок 1,2. Такое значение указывает, что эта связь ближе к ординарной, однако некоторая двоесвязанность присутствует. Порядок связей С1-С2 и С3-С4 равен 1,8. Кроме того, именно сопряжением следует объяснить высокую стабильность бутадиена, что выражается в низком значении теплоты гидрирования (разница в 15 кдж/моль – энергия сопряжения).
В органической химии сопряжение (делокализация) всегда
рассматривается как стабилизирующий, т.е. понижающий энергию молекулы, фактор.
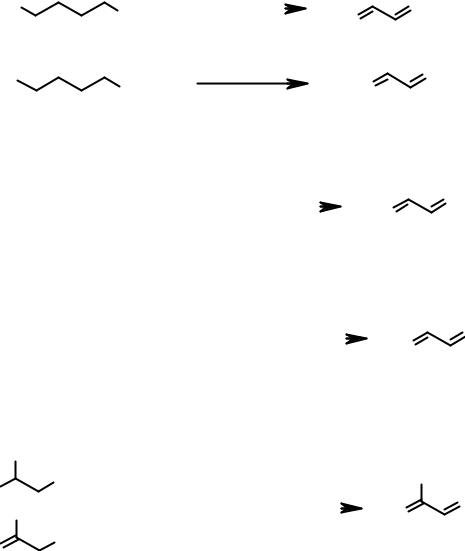
Методы получения сопряженных диенов
Вцелом методы получения сопряженных диенов похожи на аналогичные
вряду алкенов. Некоторые приведены ниже:
HO |
|
|
|
|
|
H+, to |
|
CH2 |
|||
|
|
OH |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||||
|
|
|
|
-2H |
2 |
O |
H2C |
||||
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
KOHспирт. |
|
CH2 |
|||
|
|
Cl |
|
|
|
|
|
|
|||
|
|
|
|
-2HCl |
H2C |
||||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
Метод С.В. Лебедева |
|
|
|||||
|
|
|
|
|
MgO, ZnO, 400-500 oC |
||||||
|
2 C2H5OH |
|
|
|
|
|
|
|
CH2 |
||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
Дегидрирование бутан-бутеновой фракции |
||||||||||
|
|
|
Cr2O3, Al2O3, Cu2+, 560 oC |
||||||||
CH3CH2CH2CH3 |
|
|
|
|
|
|
|
CH2 |
|||
CH CH CH=CH |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
H2C |
|||||
3 |
2 |
2 |
|
|
|
|
|
|
|
|
|
Дегидрирование изопентан-изопентеновой фракции
|
CH3 |
|
|
CH3 |
||||
H C |
|
|
CH3 Cr2O3, Al2O3, Cu2+, 560 oC |
|
|
|||
3 |
|
CH3 |
|
|
|
|
CH2 |
|
|
|
|
H |
C |
||||
|
|
|
|
|||||
|
|
|
CH3 |
2 |
|
|
||
H2C |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
83
•Химические свойства 1,3-диенов. Гидрирование (каталитическое и щелочными металлами в присутствии источников протонов). Реакции электрофильного присоединения галогенов и галогеноводородов (1,2- и 1,4-присоединение). Энергетический профиль реакции, кинетический и термодинамический контроль. Диеновый синтез. Полимеризация сопряженных диенов. Натуральный и синтетический каучук. Вулканизация каучука и получение резины.
Химические свойства сопряженных диенов
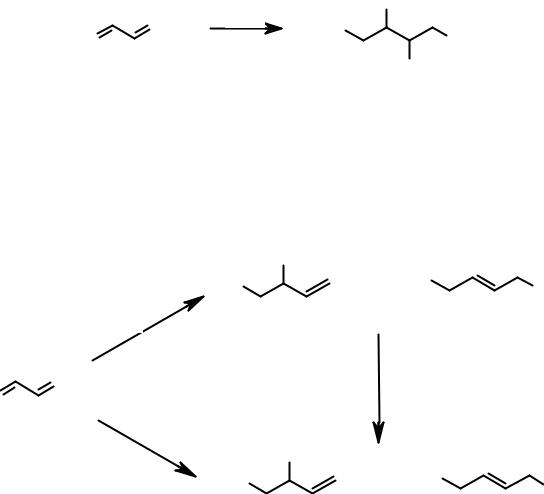
Для всех типов диенов, как и для всех алифатических непредельных углеводородов, характерны реакции электрофильного присоединения, механизм которых был рассмотрен в разделе алкены. Сопряженные диены демонстрируют некоторые особенности протекания реакций AE.
Например, бромирование бутадиена в присутствии двух- и более кратного избытка брома приводит к присоединению четырех атомов галогена с образование 1,2,3,4-тетрабромбутана.
|
2Br2 |
Br |
|
CH2 |
Br |
||
|
|||
H2C |
|
Br |
Br
В условиях моноприсоединения (эквимолярная смесь бутадиена и брома) образуется не только 3,4-дибромбутен-1, но и 1,4-бутен-2. Соотношение изомеров зависит от температуры проведения реакции. При проведении реакции при -80оС основным продуктом реакции является 3,4-дибромбутен-1, а при +40оС – 1,4-дибромбутен-2. Причем, если смесь, полученную при низкой температуре, выдержать при +40оС, результат будет точно таким же, как если бы реакцию изначально проводили при +40оС.
|
Br |
|
Br |
|
|
Br |
+ |
||
|
|
|
Br |
|
Br2 |
80 % |
|
20 % |
|
|
|
|||
-80 oC |
|
|
|
|
CH2 |
|
|
+40 oC |
|
H2C |
|
|
|
|
Br2 |
|
|
|
|
+40 oC |
Br |
|
|
|
Br |
+ |
Br |
||
|
||||
|
|
|
Br |
|
|
20 % |
|
80 % |
Исследования реакций присоединения многочисленных реагентов с самыми разными сопряженными диенами показали, что такое поведение
84
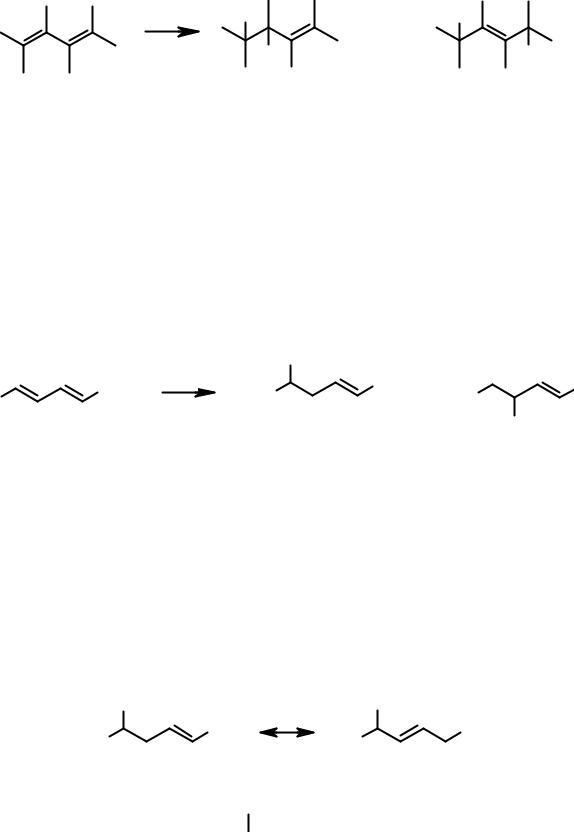
вообще характерно для сопряженных диенов, т.е. реагент может присоединяться не только к соседним углеродным атомам диенового фрагмента
– 1,2-присоединение, но и концевым углеродам – 1,4-присоединение.
XZ |
X |
X |
|
z |
z |
1 2 3 4 |
1,2-присоединение |
1,4-присоединение |
Для понимания химического поведения сопряженных диенов необходимо рассмотреть особенности механизма реакций электрофильного присоединения в этом гомологическом ряду.
Рассмотрим механизм присоединения хлористого водорода к гексадиену- 2,4. Как было показано выше, реакции AE протекают как двухстадийный процесс, в котором первая стадия представляет собой присоединение электрофильной частицы с образованием наиболее стабильного карбокатиона.
Атака протона по π-электронам диенового фрагмента теоретически может привести к двум карбокатионам А и Б.
|
|
|
H+ |
H |
|
+ |
|
CH |
|
|
CH3 |
CH3 |
|
H3C |
|
H3C |
+ |
|||
|
3 |
|
H3C |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
A |
|
Б |
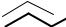
Оба катиона являются вторичными и, основываясь только на этой характеристике, нельзя предсказать какой из них будет более устойчивым. Однако при внимательном рассмотрении структуры катионов можно заметить, что в катионе А вакантная орбиталь позитивированного атома углерода находится в сопряжении с электронами π-связи. Формула, приведенная выше, не отражает реального строения образующегося катиона. При атаке электрофила по концевому атому диенового фрагмента образуется катион, строение которого следует отображать с помощью набора граничных структур.
H |
H |
CH3 |
CH3 |
H3C |
H3C |
+ |
+ |
A1 |
A2 |
H+
H3C
 CH3
CH3
A
85
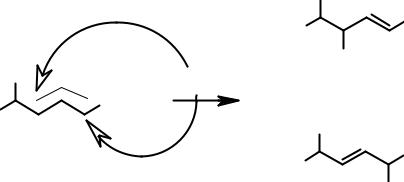
Реально образующийся карбокатион может быть отображен с помощью структуры А, в которой положительный заряд распределен между тремя атомами углерода, что приводит к уменьшению энергии (увеличению стабильности) промежуточного продукта. Таким образом, хотя катионы А и Б и являются вторичными, катион А более устойчив вследствие делокализации (так называемый аллильный карбокатион) и именно он образуется в результате взаимодействия с электрофилом. Далее анион хлора может присоединиться ко второму или четвертому углеродному атому диенового фрагмента с образованием соответственно 4-хлорбутена-2 и 2-хлорбутена-3.
1,2-присоединение |
|
H |
|
|
|
CH3 |
|
|
|
H3C |
|
|
|
|
|
H + |
|
Cl |
1,2- |
Cl- |
|
||
+ |
|
||
CH3 |
|
|
|
H3C |
|
H |
|
A |
|
H3C |
CH3 |
1,4-присоединение |
|
||
|
Cl |
||
|
|
|
|
|
|
|
1,4- |
Как было показано выше, соотношение изомеров в реакции бромирования бутадиена зависит от температуры проведения реакции. Каждый из изомеров устойчив при низкой температуре, но продолжительная выдержка любого из них при +40оС приводит к образованию смеси, содержащей 20% продукта 1,2- и 80 % продукта 1,4-присоединения. Имеющиеся данные позволяют сделать вывод, что получаемая при повышенной температуре смесь является равновесной смесью продуктов 1,2- и 1,4-присоединения, а повышенное содержание в ней 1,4-дибромбутена-2 должно быть объяснено большей устойчивостью промежуточно образующегося аллильного карбокатиона.
В целом 1,2- и 1,4-присоединение к сопряженным диенам является классическим случаем общего для органической химии явления – протекания параллельных реакций, одна из которых (1,2-присоединение) идет в условиях кинетического, а другая (1,4-присоединение) – термодинамического контроля (см. выше). Все реакции электрофильного присоединения одной молекулы реагента к сопряженным диенам протекают подобным образом, отличаясь лишь температурными интервалами и соотношением продуктов 1,2- и 1,4- присоединения.
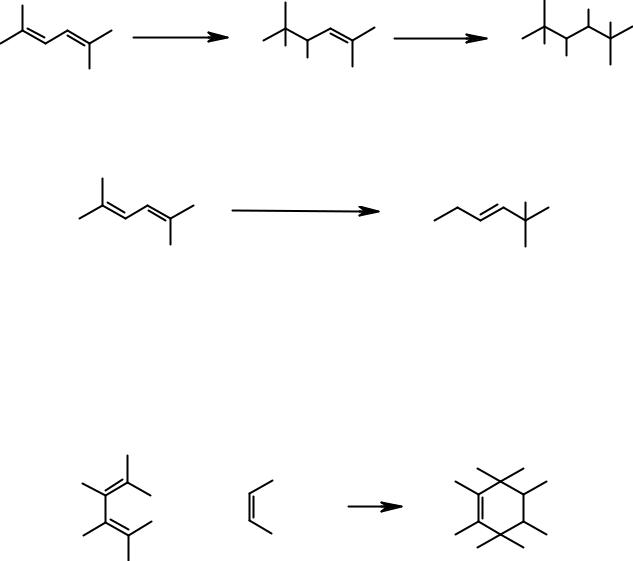
Результат гидрирования сопряженных диенов зависит от условий проведения реакции. Каталитическое гидрирование всегда протекает как 1,2- процесс, приводя в конце концов к алкану.
86
Н2, кат |
Н |
, кат |
H H |
|
2 |
|
|
H H |
|
|
H H |
Гидрирование натрием в этаноле или в жидком аммиаке всегда протекает как 1,4-присоединение водорода.
C2H5OH + Na |
|
H |
|
||
|
|
|
H
Поскольку алкены в этих условиях не вступают в реакцию гидрирования, образование алканов не происходит.
В1928 г. О. Дильс и К. Альдер (Нобелевская премия 1950 г.) открыли реакцию своего имени или «реакцию диенового синтеза».
Вреакции Дильса-Альдера взаимодействие сопряженного диена с диенофилом (соединением с активированной кратной связью) приводит к образованию шестичленного циклического алкена (аддукта).
+
диен |
диенофил |
аддукт |
Диены и диенофилы, не имеющие заместителей, вступают в реакцию с большим трудом. Бутадиен-1,3 реагирует с этиленом с низким выходом только при температуре более 200оС и давлении около 400 атм. В случаях, когда диен несет электронодонорные, а диенофил – электроноакцепторные заместители, реакция обычно протекает при комнатной температуре или незначительном нагревании с количественным выходом.
Эта реакция очень важна для препаративной органической химии, поскольку позволяет в одну стадию из простых исходных веществ получить сложные циклические соединения.
Реакция Дильса-Альдера классифицируют как [4+2]-циклоприсоедине- ние. Это один из вариантов так называемых перициклических реакций, составляющих самостоятельный раздел органической химии.
В течение долгого времени реакцию Дильса-Альдера относили к так называемым «реакциям без механизма», поскольку никаких промежуточных
87

продуктов в этом превращении не удавалось и до настоящего времени не удалось зафиксировать.
Несмотря на то, что, как видно из схемы, реакция представляет собой сложный процесс, в котором суммарно происходит разрыв трех π-связей и образование двух σ- и одной π-связи, процесс является одностадийным, проходящим через единственное переходное состояние.
+
В циклическом переходном состоянии происходит согласованный процесс перераспределения электронной плотности. Атомы С-1 и С-4 диена, а также углероды кратной связи диенофила изменяют тригональную гибридизацию на тетраэдрическую, с образованием двух σ-связей. Второй и третий атомы диена сохраняют начальную гибридизацию с образованием двойной связи. Так как σ-связи энергетически выгоднее, чем π-связи, реакция протекает с выделением тепла.
Поскольку в сопряженных диенах связь С2-С3 имеет частично двоесвязанный характер благодаря сопряжению π-электронов, свободное вращение относительно этой связи затруднено. Сопряженные диены могут существовать в двух устойчивых s-цис- и s-транс-конформациях (s – от ангийского single).
s-цис-конформация s-транс-конформация бутадиена-1,3
Согласованный процесс перераспределения электронной плотности в реакции Дильса-Альдера осуществляется только в том случае, если диен находится в s-цис-конформации.
В реакцию наряду с производными бутадиена-1,3 могут вступать циклические, гетероциклические диены, а также гетеродиены. Некоторые возможные структуры приведены ниже:
88

O  N
N
O
В качестве диенофилов наиболее часто используют малеиновый ангидрид, тетрацианэтилен, акриловую кислоту и ее производные – нитрил и эфиры.
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NC |
|
CN |
|
|
|
|
COOH |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
NC |
|
CN |
|
|
CH2 |
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
малеиновый |
|
|
тетрацианэтилен |
|
|
акриловая |
||||||
ангидрид |
|
|
|
|
|
|
|
кислота |
||||
|
|
|
|
|
COOCH3 |
|
|
|
|
CN |
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
CH2 |
|
|
CH2 |
|||||
|
|
метилакрилат |
|
акрилонитрил |
||||||||
Кроме олефинов, в реакции Дильса-Альдера могут быть использованы алкины и соединения, имеющие двойную связь углерод-гетероатом. Например, следующие группировки:
 O N
O N O S
O S O
O
Полимеризация сопряженных диенов
Как и этиленовые углеводороды, сопряженные диены способны вступать в реакцию полимеризации с образованием ВМС. В зависимости от механизма полимеризации процесс может протекать как 1,2- или 1,4-присоединение мономерных фрагментов. В случае радикального механизма образуется полимер с беспорядочным расположением 1,2- и 1,4-фрагментов.
89
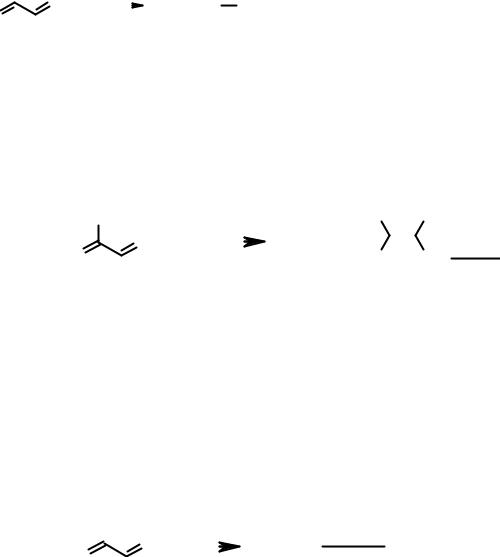
n |
CH2 |
|
|
|
|
|
CH2 |
CH |
|
CH |
|
CH |
|
|
|
|
|
|
|
|
CH |
|
CH |
|
|
|
|
|||
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
H2C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
CH |
|
|
CH2 |
|
n |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
бутадиен-1,3 |
|
|
|
|
1,4-полимеризация |
|
1,2-полимеризация |
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
Сопряженные диены играют очень важную роль при получении высокомолекулярных соединений, поскольку из 2-метилбутадиеновых (изопреновых) звеньев построены молекулы натурального каучука.
|
|
CH3 |
|
|
|
|
|
H3C |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|||||||||
n H2C |
|
|
CH2 |
|
|
|
|
|
H2C |
|
|
|
CH2 |
n |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
изопрен |
|
|
натуральный каучук |
||||||||||||
(2-метилбутадиен-1,3) |
|
|
|
(цис-полиизопрен) |
|||||||||||
Впервой трети ХХ века в СССР, США и Германии велись интенсивные исследования по получению синтетического каучука.
В1930 г. в СССР впервые в мировой практике был осуществлен синтез полибутадиенового каучука по методу С.В. Лебедева. В 1932 г. в США был получен неопрен (хлоропреновый каучук).
|
Cl |
|
|
|
|
|
|
Cl |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
n |
|
CH2 |
|
|
|
|
|
CH2 |
|
|
|
|
CH |
|
CH |
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
2 |
|
|||||||||||
|
H2C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
хлоропрен |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Улучшение свойств полибутадиенов достигали с помощью сополимеризации. Так, сополимер, состоящий из одной части стирола (С6Н5СН=СН2) и трех частей бутадиена – бутадиенстирольный каучук, – широко применяли во время второй мировой войны для замены недоступного натурального каучука.
90
