
Organicheskaya_khimia
.pdf
Рис. 16. Конформации этана и их относительные энергии
Номенклатура
В соответствии с номенклатурой IUPAC для первых четырех алканов используют тривиальные названия, для последующих - греческие числительные с добавлением окончания –ан. Названия некоторых алканов нормального строения приведены в таблице. Нормальными называют алканы, имеющие неразветвленную углеродную цепь.
31

Названия некоторых алканов
Формула |
Название |
Формула |
Название |
CH4 |
Метан |
C8H18 |
Октан |
C2H6 |
Этан |
C9H20 |
Нонан |
C3H8 |
Пропан |
C10H22 |
Декан |
C4H10 |
Бутан |
C11H24 |
Ундекан |
C5H12 |
Пентан |
C12H26 |
Додекан |
C6H14 |
Гексан |
C16H34 |
Гексадекан |
C7H16 |
Гептан |
C20H42 |
Эйкозан |
Названия группировок, постоянно встречающихся как структурные единицы в органических молекулах, образуют исходя из названия исходного алкана. Так, остатки, условно образующиеся отщеплением от алкана одного атома водорода, вместо окончания –ан имеют окончание –ил. Например, CH3- называют метил, C2H5- этил и т.д. Весь массив таких остатков называют
алкильными группами.
H3C |
|
|
|
|
|
|
|
|
H3C |
|
CH |
|
|
|
|
H3C CH |
|
|
|
|
H3C CH3 |
|||||||||
|
|
|
|
|
2 |
|
2 |
|
|
|||||||||||||||||||||
метил |
|
|
|
|
|
|
|
этил |
|
|
|
|
пропил-1 |
|
|
пропил-2 |
||||||||||||||
|
|
|
CH |
|
|
|
|
|
|
H3C |
|
|
CH3 |
|
H C |
|
|
|
CH |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
H C |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бутил-1 |
|
|
|
|
|
|
|
|
|
бутил-1 |
|
|
|
|
CH3 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
2-метилпропил-1 |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
CH3 |
|||
H3C |
|
CH |
|
|
H3C |
|
|
2 |
|
C |
|
|
||||||||||||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
CH3 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
пентил-1 |
|
|
|
|
|
2-метилбутил-1 |
3-метилбутил-1 |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
CH3 |
H |
C |
|
|
|
CH3 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
H C |
|
CH |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
3 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
CH3 |
|
|
|
|
|
CH3 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
пентил-2 |
|
|
|
|
|
|
3-метилбутил-2 |
|
2-метилбутил-2 |
|||||||||||||||||||||
Основы номенклатурных правил IUPAC были изложены ранее.
32
Примеры названий алканов:
6 |
5 |
4 |
3 |
2 |
1 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
|
H3C |
|
|
|
|
CH3 |
H C |
|
|
|
CH |
|||
|
|
|
|
|
|
|
3 |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
H3C |
CH3 |
||
|
|
|
|
CH |
3 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2-метилгексан |
|
|
2,2-диметилгептан |
|
|||||||||
H3C
 CH3 H3C
CH3 H3C CH3
CH3
H C |
|
CH3 |
H C |
CH3 |
|
3 |
H C |
CH3 |
|
3 |
|
|
3 |
|
|
CH3 |
CH3 |
|
|
|
|
||
3,3,7-триметил-6-этилдекан 4-(пропил-2)-5,5-диэтилдекан
По номенклатуре IUPAC названия всех классов открытоцепных веществ имеют в основе названия алканов. Поэтому необходимо помнить названия, по крайней мере, первых десяти алканов и легко называть их производные. Зная названия алканов и алкильных групп легко понять, как образуются названия непредельных углеводородов, спиртов, галогенопроизводных и др.
Атомы углерода в алкане классифицируют, исходя из числа его углеродуглеродных связей.
1o |
1o |
|
1o |
|
CH |
|
CH3 |
||
H C |
|
|||
|
3 |
|
||
3 |
|
|
|
|
H C |
4o |
|
3o CH |
|
3 |
o |
|
2o |
3 |
|
||||
|
1 |
|
|
1o |
Первичный (1о) атом углерода связан с одним углеродным атомом, вторичный (2о) - с двумя, третичный (3о) – с тремя, а четвертичный (4о) - с четырьмя атомами углерода.
33

•Химические свойства алканов. Реакции свободнорадикального замещения (галогенирование, нитрование, сульфохлорирование и сульфоокисление). Понятие о цепных реакциях (стадии, квантовый выход). Селективность свободнорадикальных реакций и относительная стабильность свободных радикалов. Термические превращения алканов: изомеризация, крекинг. Окисление алканов. Применение алканов в органическом синтезе и в качестве моторного топлива. Детонационные и антидетонационные свойства топлива.
Химические свойства алканов
Старое название алканов - парафины. Этот термин происходит от латинского parum affinis (малое сродство) и говорит о низкой реакционной способности этого класса углеводородов. В обычных условиях на алканы не действуют концентрированные кислоты и щелочи, они инертны по отношению к сильным окислителям и восстановителям.
Как было отмечено ранее, в алканах все атомы углерода связаны с четыремя другими атомами. Отсутствие в молекулах этого класса веществ кратных связей не позволяет рассчитывать на возможность протекания реакций присоединения.
Для соединений этого класса характерны реакции замещения. Характерным примером такого типа реакций являются хлорирование и бромирование алканов.
Рассмотрим хлорирование метана. Реакция протекает при нагревании или облучении смеси ультрафиолетовым светом. При этом атом хлора замещает атом водорода в метане, а второй атом хлора связывает атом водорода.
|
|
H |
|
|
|
|
|
|
H |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
to или ην |
|
+ |
H |
|
Cl |
|||||
H |
|
C |
|
H |
+ Cl |
|
Cl |
|
H |
|
C |
|
Cl |
|
|||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
H |
|
|
|
|
|
|
H |
|
|
|
|
||||||
метан |
хлор |
|
хлорметан |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
(хлористый метил) |
|
|
|
||||||
Образующийся в ходе реакции хлорметан в свою очередь вступает в реакцию с хлором с образованием дихлорметана (хлористого метилена). Далее реакция может продолжаться с образованием CHCl3 (хлороформа) и, в конце концов, четыреххлористого углерода (CCl4).
CH |
|
Cl2, hν |
CH Cl |
Cl2, hν |
CH |
Cl |
|
Cl2, hν |
CHCl |
|
Cl2, hν |
CCl4 |
||||
|
|
|
|
|
|
|
|
3 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
4 |
- HCl |
3 |
- HCl |
2 |
|
2 |
- HCl |
|
- HCl |
|
|||||
34

Таким образом в реакции может образоваться четыре продукта. Можно ли процесс остановить на требуемой стадии?
Реакция непосредственного галогенирования используется только для получения моноили пер-галогеноалканов. Для проведения однозначной реакции используют большой избыток одного из реагентов. Для проведения реакции монохлорирования используют большой избыток метана. Основным продуктом реакции будет хлористый метил. Большое различие в температурах кипения между метаном и хлорметаном (> 130о С) позволяет легко отделить непрореагировавший метан и использовать его повторно. Аналогично проводят реакцию получения тетрахлорметана, используя большой избыток молекулярного хлора. В этом процессе разделение продукта и непрореагировавшего реагента еще проще, т.к. при комнатной температуре хлор находится в газообразном состоянии, а четыреххлористый углерод – жидкость.
Бром взаимодействует с метаном при высокой температуре или освещении ультрафиолетовым светом с образованием соответствующих производных (от монодо тетрабромметана).
CH |
|
Br2, hν |
CH |
Br |
Br2, hν |
CH Br |
|
Br2, hν |
CHBr |
|
Br2, hν |
CBr4 |
||||
|
|
|
|
|
|
|
|
3 |
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||||
|
4 |
- HCl |
3 |
|
- HCl |
2 |
2 |
- HCl |
|
- HCl |
|
|||||
Реакция метана с йодом не идет, а с фтором протекает со взрывом даже в темноте и при комнатной температуре. Обычно для получения насыщенных фтор- и йодпроизводных используют другие методы синтеза.
Таким образом, реакционная способность галогенов в реакции с метаном уменьшается в следующем порядке: F2 > Cl2 > Br2 (> I2)
В реакциях галогенов с другими алканами порядок изменения их реакционной способности не меняется.
Термин «реакционная способность» очень распространен в органической химии. Как правило, при сравнении реакционной способности сравнивают скорость или легкость протекания реакции. Если утверждается, что хлор по отношению к метану, более реакционноспособен, чем бром, это означает, что в идентичных условиях хлорирование метана происходит быстрее, чем бромирование. Чтобы реакция с бромом протекала с такой же скоростью, как с хлором, ее надо проводить в более жестких условиях (при более высокой температуре или при больших концентрациях).
Механизм реакции галогенирования алканов
Поскольку хлорирование и бромирование метана и других алканов протекает по одному механизму, его знание обеспечит понимание всех реакций галогенирования алканов. Как уже было отмечено выше, механизм реакции
35

должен объяснять известные экспериментальные факты. В реакции хлорирования метана механизм не должен противоречить следующим фактам:
•смесь метана и хлора не реагирует в темноте при комнатной температуре;
•реакция протекает в темноте при температурах выше 250о С;
•реакция протекает при комнатной температуре при обучении реакционной смеси ультрафиолетовым светом;
•реакция может протекать в темноте при комнатной температуре или незначительном нагревании в присутствии соединений, способных в этих условиях генерировать свободные радикалы (например, Pb(C2H5)4);
•если реакция протекает при ультрафиолетовом облучении, то она имеет высокий квантовый выход (на каждый поглощенный системой фотон образуется несколько тысяч молекул хлористого метила);
•присутствие в реакционной смеси кислорода замедляет реакцию. Длительность периода замедления зависит от количества кислорода в смеси.
Следующий механизм свободнорадикального замещения полностью объясняет приведенные выше факты:
|
|
|
|
|
to или ην |
|
|
|
|
. |
|
|||||||||||
1 |
Cl |
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
2Cl |
инициирование |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
2a |
CH4 |
+ |
Cl. |
|
|
|
|
|
|
|
CH3. + HCl |
рост цепи |
||||||||||
|
|
|
|
|
||||||||||||||||||
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|||
2b |
CH |
+ |
Cl |
2 |
|
|
|
|
|
|
|
|
|
|
CH Cl |
|
+ Cl |
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|||
3a |
Cl. + Cl. |
|
|
|
|
|
|
|
Cl |
|
|
Cl |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
3b |
CH3. + Cl. |
|
|
|
|
|
CH3Cl |
обрыв цепи |
||||||||||||||
|
|
|
||||||||||||||||||||
3c |
CH3. + CH.3 |
|
|
|
H3C |
|
CH3 |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
На первой стадии реакции (инициирование) под действием ультрафиолетового облучения или нагрева происходит гомолитический разрыв связи в молекуле хлора. Энергия этой связи - 58 ккал/моль (242,83 кДж/моль) - наименьшая среди участвующих в реакции молекул. В результате разрыва связи в молекуле галогена образуется атомарный хлор, имеющий неспаренный электрон и обладающий очень высокой реакционной способностью.
Столкновение атома хлора с молекулой метана приводит к отрыву от последней атома водорода и образованию метильного радикала (стадия 2а). Образовавшийся свободный метильный радикал имеет лишь семь электронов и, стремясь к электронному октету и уменьшению энергии за счет образования связи, проявляет очень высокую реакционную способность.
36
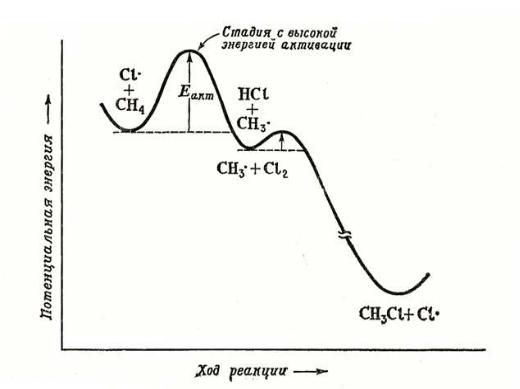
Далее метильный радикал отрывает от молекулы хлора атом со связывающим электроном, образуя хлористый метил (стадия 2b). В реакционной массе вновь генерируется свободный атом хлора.
Рис 17. Энергетическая диаграмма хлорирования метана
Рассмотренная реакция является не просто реакцией свободнорадикального замещения (SR), а цепным процессом. Цепной называется реакция, которая включает ряд стадий, на каждой из которых образуется частица, вызывающая следующую стадию. Единственную отечественную Нобелевскую премию по химии за исследования цепных реакций получил академик Н.Н. Семенов (1956 г.).
Стадии роста цепи (2a и 2b) не могут продолжаться бесконечно. Стадии, в которых радикальные частицы не генерируются, называются стадиями обрыва цепи (рекомбинация свободных радикалов) и показаны выше на схеме (3a-c).
Данный механизм объясняет все приведенные выше экспериментальные факты.
Галогенирование высших алканов протекает по тому же механизму, что и галогенирование метана. Реакция осложняется тем, что, начиная с пропана, возможно образование изомерных галогенопроизводных.
Рассмотрим бромирование метилбутана (см. схему). В этой реакции возможно образование четырех монобромпроизводных I-IV. Соединения I и IV являются первичными бромопроизводными, II – третичными, а III – вторичными. Учитывая, что в молекуле метилбутана 1 третичный, 2 вторичных и 9 первичных атомов водорода, то при одинаковых скоростях реакций по этим
37
положениям следует ожидать соотношение изомеров I и IV : III : II = 9 : 2 : 1. Однако в опыте образуется смесь с другим соотношением изомеров. В результате бромирования получено более 95 % соединения II, около 5 % соединения III и следы соединений I и IV.
|
|
|
|
|
CH3 |
|
|
CH |
||||||
|
|
|
|
Br |
|
|
|
CH3 |
|
|
|
3 |
||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
CH |
||
|
CH3 |
|
|
|
|
|
|
H3C |
|
|
3 |
|||
|
Br2, hν |
|
|
I |
|
Br |
||||||||
|
|
CH3 |
|
|
|
|
|
|
|
|
II |
|||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||||
H3C |
|
|
|
CH3 |
|
|
|
|
|
CH3 |
||||
метилбутан |
|
|
CH3 |
|
|
|||||||||
|
H3C |
|
H3C |
|
|
|
|
Br |
||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
Br |
|
|
|
|
|
|
||
|
|
|
|
|
|
III |
|
|
|
|
|
|
IV |
|
Такой результат реакции позволяет сделать вывод, что бромирование по третичному атому происходит быстрее, чем по вторичному, а по вторичному, в свою очередь, быстрее, чем по первичному. Поскольку стадией, определяющей скорость галогенирования, является образование алкильного радикала (см. рис. 17), легкость образования свободных радикалов уменьшается в ряду:
третичный > вторичный > первичный > метильный
В той же последовательности снижается и стабильность радикальных частиц. Общая закономерность органической химии: чем устойчивее частица, тем легче она образуется. Этот вывод относится к свободным радикалам, катионам и анионам.
Причина указанного выше изменения стабильности свободных радикалов заключается в делокализации неспаренного электрона, находящегося на p- орбитали и состоящего в сопряжении с электронами σ-связей. Чем больше разветвлена углеродная цепь у атома, несущего неспаренный электрон, тем выше стабильность радикала и, следовательно, тем легче и быстрее он образуется.
Относительные скорости бромирования по третичному, вторичному и первичному атомам углерода относятся как 1600 : 82 : 1. В реакции хлорирования та же закономерность. Однако хлор значительно более реакционноспособный, следовательно, менее избирательный (селективный) реагент, поэтому разница в скоростях не столь значительна и составляет 5,0 : 3,8 : 1,0 соответственно. Поэтому реакция хлорирования всегда приводит к сложным смесям продуктов монохлорирования. Поэтому, если в ходе решения задачи нужно получить моногалогенопроизводное прямым галогенированием алкана, следует проводить реакцию бромирования.
Как уже было отмечено выше, реакционная способность алканов низка. Наряду с хлорированием и бромированием можно отметить еще лишь
38
несколько реакций. В 1888 г. М.И. Коновалов описал реакцию жидкофазного нитрования алканов. Реакция Коновалова протекает при 100-150оС под действием 10-15 % азотной кислоты.
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
H |
|
|
NO2 |
. |
||||
|
|
|
|
- HNO2 |
|||||||
|
|
|
|
|
|
|
|
. |
|||
|
|
|
|
|
|
|
|
|
|
|
|
HNO2 |
+ |
HNO3 |
|
|
|
H2O + 2 NO2 |
|||||
|
|
|
|||||||||
. |
+ |
NO |
|
|
|
|
|
NO |
2 |
||
|
|
|
|
|
|||||||
|
|
|
|||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
Жидкофазное нитрование протекает с низким выходом и в 1934 г. было модифицировано Г.Б. Хаасом, который предложил проводить нитрование в паровой фазе (реакция Коновалова-Хааса).
|
|
|
|
NO2 |
|
60% HNO , 450-500o |
CH3CH3CH2NO2 |
CH3CH3CH3 |
|
|
32% |
33% |
||
3 |
|
|||
CH3CH3CH3 |
|
|
CH3CH3NO2 |
CH3NO2 |
|
||||
|
|
|
||
|
|
|
26% |
9% |
Реакция протекает по радикальному механизму. Хотя легкость замещения водорода при нитровании изменяется в обычной последовательности третичный > вторичный > первичный > метильный, реакция сопровождается деструкцией с образованием всех возможных мононитропроизводных.
Среди функционализированных алканов важное место занимают сульфопроизводные, которые используют в качестве СМС. Концентрированная серная кислота действует на низшие алканы как окислитель и прямое сульфирование возможно лишь в случае высших производных. Для введения в
молекулу предельного углеводорода сульфогруппы обычно используют обходной путь, применяя реакцию сульфохлорирования (действие SO2 + Cl2) или сульфоокисление (SO2 + O2).
При освещении ультрафиолетовым светом парафины вступают в реакцию замещения со смесью хлора и оксида серы (IV) с образованием сульфохлоридов.
39

|
|
|
Cl2 |
|
|
|
hν |
|
2Cl. |
|
|
|
|
|
||||||||
|
|
|
|
|
|
Cl. |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|||||
C |
H |
2n+2 |
|
|
|
|
|
|
CnH2n+1 |
|||||||||||||
|
|
|
|
|
|
|||||||||||||||||
|
n |
|
|
|
|
-HCl |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
CnH2n+1. |
|
|
SO2 |
|
|
|
|
O |
||||||||||||||
|
|
|
|
|
|
S. |
||||||||||||||||
|
|
CnH2n+1 |
|
|||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||
|
|
|
|
|
|
O |
|
|
|
Cl2 . |
|
|
|
O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
S . |
|
|
|
|
|
|
|
|
|||||||||
C |
H |
|
|
|
|
|
|
|
|
S |
|
Cl |
||||||||||
|
|
|
|
|
|
CnH2n+1 |
|
|||||||||||||||
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
- Cl |
|
|
|
|
|
||||||||
n |
|
|
2n+1 |
|
|
|
|
|
|
|
|
O |
||||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|||||||
сульфохлорид
Реакция протекает по цепному механизму. Стадия инициирования – гомолитическое расщеплении молекулы хлора.
Одним из наиболее важных направлений использования алканов является применение их в качестве топлива. Пламенное окисление алканов в присутствии кислорода воздуха приводит к их полному сгоранию до углекислого газа и воды с выделением большого количества тепла.
2CnH2n+2 + (6n+2)O2  2nCO2 + (2n+2)H2O
2nCO2 + (2n+2)H2O
Механизм этой реакции до конца не установлен, несмотря на наличие большого числа математических моделей. Нет сомнений, что это свободнорадикальная цепная реакция.
При сжатии смеси паров бензина, состоящего из алканов, с воздухом образуются перекисные соединения, вызывающие так называемую «детонацию». Легче всего образуют перекиси алканы нормального строения, из которых состоит так называемый «бензин прямой гонки». Значительно лучшие антидетонационные свойства имеют алканы, в структуре которых есть четвертичный атом углерода. В основу условной шкалы оценки моторных топлив был положен изооктан (2,2,3-триметилпентан), которому было приписано октановое число 100, а н-гептану, обладающему сильными детонационными свойствами, - 0. Следует отметить, что имеются топлива, имеющие октановое число и больше 100. Бензин марки АИ-95 имеет точно такие же антидетонационные свойства, как смесь 95% изооктана и 5% н- гептана.
CH3 CH3
H3C CH3 CH3
2,2,4-триметилпентан (изооктан)
40
