
Organicheskaya_khimia
.pdf
Кроме ацетиленидов щелочных металлов в синтезе часто используют магниевые производные, получаемые реакцией алкинов с реактивами Гриньяра (реактивы Ж.Иоцича).
R CH + R'MgX - R'H
CH + R'MgX - R'H R
R MgX
MgX
Во многих случаях реактивы Иоцича более удобны в синтезе, чем ацетилениды щелочных металлов. Обладая высокой реакционной способностью, они заметно более устойчивы, с ними проще проводить реакции.
Алкины с концевой тройной связью могут реагировать с ионами тяжелых металлов с образованием соответствующих ацетиленидов. Так, ацетилен и его гомологи реагируют с аммиачным раствором оксида серебра или хлорида одновалентной меди с образованием соответствующих ацетиленидов.
2[Ag(NH3)2]+OH-
HC CH
CH  Ag
Ag Ag бесцветный
Ag бесцветный
R CH [Ag(NH3)2]+OH- R
CH [Ag(NH3)2]+OH- R Ag
Ag  бесцветный
бесцветный
2[Cu(NH3)2]+OH-
HC CH
CH  Cu
Cu Cu вишнево-бурый
Cu вишнево-бурый
R |
|
|
|
CH |
[Cu(NH ) ]+OH- |
|
|
|
|
|
|
||||
|
|
|
3 2 |
|
R |
|
|
|
Cu |
желто-бурый |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
R |
[Cu(NH ) |
]+OH- |
не реагирует |
|
||||
|
|
|
|
|
|
3 2 |
|
|
|||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||
В ацетиленидах тяжелых металлов связь металл-углерод намного менее полярна, чем в производных щелочных металлов. Эти соединения в водных растворах выпадают в осадок. Образование осадка ацетиденида серебра или меди часто используют как качественную реакцию на концевую тройную связь. Если тройная связь находится в глубине цепи, образования ацетиленида (выпадение осадка) не происходит. При работе с ацетиленидами тяжелых металлов следует соблюдать особые меры предосторожности, поскольку эти вещества взрывоопасны.
Реакция с карбонильными соединениями. Ацетилен, как и алкины с концевой тройной связью, в присутствии щелочей реагируют с карбонильными соединениями (альдегидами и кетонами) с образованием ацетиленовых спиртов. Взаимодействие ацетилена с ацетоном (реакция Фаворского):
R |
|
|
|
KOH |
R' |
||||||
|
|
|
|
|
|
||||||
|
|
O + HC |
|
|
R" |
|
|
|
|
||
|
|
|
|
|
R |
|
|
|
CR" |
||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
R' |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
OH |
||||||
|
|
|
|
|
|
|
|
||||
71
•Химические свойства алкинов. Каталитическое гидрирование (полное и частичное). Реакции электрофильного присоединения: взаимодействие с галогенами, галогеноводородами. Реакции нуклеофильного присоединения: взаимодействие со спиртами, карбоновыми кислотами, циановодородом, восстановление натрием в аммиаке, реакции с аминами
иамидами. Гидратация алкинов (реакция Кучерова) и понятие о кетоенольной таутомерии. Окисление. Полимеризация алкинов.
•Особенности тройной углерод-углеродной связи в сравнении с двойной.
Реакции присоединения
Химические свойства алкинов определяются наличием в молекуле тройной углеродуглеродной связи. Наиболее характерны для алкинов, как и для алкенов, реакции присоединения, которые проходят ступенчато.
Гидрирование
Гидрирование алкинов на гетерогенном катализаторе (см. раздел «Алкены») происходит аналогично реакции алкенов и приводит всегда к насыщенным производным, т.е. тройная связь восстанавливается до одинарной.
|
|
|
|
|
H2, кат |
H H |
||||
|
|
|
|
|
|
|
|
|
||
R |
|
|
|
R' |
|
R |
|
|
|
R' |
|
|
|
||||||||
|
|
|
||||||||
|
|
|
|
|
|
|
H H |
|||
Присоединение двух молекул водорода происходит последовательно, однако промежуточно образующийся алкен невозможно выделить в условиях реакции, т.к. его гидрирование происходит быстрее, чем гидрирование исходного алкина.
Получение алкенов гидрированим ацетиленовых углеводородов может быть проведено при восстановлении алкинов натрием в жидком аммиаке или водородом над катализатором Линдлара (специальным образом приготовленный палладиевый катализатор).
H R'
транс-
Na, NH3 (ж) |
R H |
R R'
R'
H2, Pd/Pb
H H
цис-
R R'
72
Парциальное гидрирование протекает стереоспецифично. Гидрирование в жидком аммиаке всегда приводит к транс-, а на катализаторе Линдлара – к цис- производным.
Реакции электрофильного присоединения. Тройная углерод-углеродная связь состоит из одной σ- и двух π-связей. π-Электронная плотность в пространстве между двумя sp-гибридизованными атомами углерода выше, чем в алкенах. Учитывая известные свойства алкенов (см. выше), может быть сделано предположение, что алкины в реакциях электрофильного присоединения будут более реакционоспособны, чем алкены. Однако экспериментальные данные показывают, что в большинстве случаев тройная связь менее активна в реакциях электрофильного присоединения, чем двойная. Этот факт может быть объяснен следующим образом:
1)π-электроны тройной связи в значительно большей степени, чем в алкенах, втянуты в пространство между ядрами углерода и прочнее удерживаются ими. Электрофилу сложнее атаковать π-электроны алкина, чем алкена;
2)взаимодействие алкина с электрофилом приводит к образованию не
алкильного, а винильного карбокатиона. Положительный заряд последнего сосредоточен на sp2-гибридизованном атоме углерода. Электроотрицательность sp2-углерода выше, чем у sp3, что дестабилизирует промежуточно образующийся карбокатион, затрудняя реакцию.
Присоединение галогенов. Хлор и бром последовательно, в две стадии, присоединяются к тройной связи с образованием сначала дигалогеноалкена, а затем тетрагалогеноалкана. Тщательный подбор условий позволяет либо остановить реакцию на стадии непредельного дигалогенопроизводного (эквимолярное соотношение реагентов и низкая температура), либо получать тетрагалогеноалканы (избыток галогена и повышенная температура).
|
|
|
|
|
|
R |
|
|
|
X |
X2 |
|
X |
X |
|||
R |
|
|
|
R' |
X2 |
|
|
|
R' |
R |
|
|
|
|
R' |
||
|
|
|
|
X |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
X |
X |
|||||
транс-
Первая стадия присоединения протекает преимущественно как анти- присоединение, приводя к транс-алкенам. Реакция с бромом может быть использована как качественная реакция на тройную связь, поскольку в ходе присоединения происходит обесцвечивание бромной воды.
Присоединение галогеноводородов. Присоединение галогеноводородов к алкинам протекает в две стадии. На первой присоединение к тройной связи идет значительно медленнее, чем аналогичное присоединение галогенов. Причины такого поведения алкинов были объяснены ранее. Реакции
73
значительно ускоряются при использовании в качестве катализатора солей двухвалентной ртути или одновалентной меди.
|
|
|
|
HBr |
Br |
HBr |
|
Br |
|||||
H3C |
|
|
CH |
|
|
H3C |
|
|
CH3 |
||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
H3C CH2 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
Br |
||||
пропин |
|
|
2-бромпропен |
|
|
2,2-дибромпропан |
|||||||
Обе реакции, как и в ряду алкенов, протекают через наиболее устойчивый промежуточный карбокатион. Поэтому в результате образуются гем- дигалогенопроизводные алканов.
Гидратация алкинов (реакция М.Г. Кучерова, 1881 г.). Присоединение воды к ацетиленам разительно отличается от аналогичной реакции в этиленовом ряду. Взаимодействие протекает только в водном растворе кислоты в присутствии солей двухвалентной ртути и приводит к образованию карбонильного соединения, а не соответствующего спирта. Так, гидратация ацетилена приводит к ацетальдегиду.
|
|
|
|
|
|
H2O, H+,Hg2+ |
|
|
|
|
|
|
|
|
|
H3C |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
H |
|
|
|
|
H |
|
|
H2C |
|
C |
|
OH |
|
|
|
|
|||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
H |
||
ацетилен |
|
|
виниловый спирт |
|
ацетальдегид |
||||||||||||||
Механизм реакции Кучерова:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.. |
+ |
|
|
|
|
|||||||||
|
|
|
|
|
2+ |
|
|
|
|
|
+ |
|
|
|
|
|
|
OH2 |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
Hg |
|
|
|
|
|
|
HC |
|
CH |
|
H2O |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
HC |
|
CH |
|
|
|
|
|
HC |
|
CH |
|
|
|
|
|
|
|
|
HC |
|
CH |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Hg2+ |
|
|
|
|
Hg+ |
|
|
|
|
|
Hg+ |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
OH |
|
|
+ H+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
O |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
HC |
|
|
CH |
|
|
H2C |
|
C |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
-H+ |
|
+ |
|
|
|
- Hg2+ |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|||||||||||
|
|
|
|
|
Hg |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
1)ион двухвалентной ртути взаимодействует с тройной связью, оттягивает к себе часть π-электронов, уменьшая электронную плотность в пространстве между sp-гибридизованными атомами углерода и создавая возможность атаки тройной связи нуклеофильным реагентом – водой.
2)вода атакует позитивированную ртутью тройную связь, образуя связь С- О за счет одной из своих свободных пар электронов, с образование оксониевого катиона.
74
3)протон отщепляется от катионного центра и происходит превращение ртутного производного в непредельный спирт.
4)таутомерное превращение непредельного (винилового) спирта в карбонильное соединение.
Промежуточно образующиеся в ходе гидратации алкинов виниловые спирты имеют общее название – енолы (ен- указывает на наличие двойной связи, ол- - на гидроксильную группу спирта).
|
O |
|
OH |
|
H H |
енол |
карбонильное |
|
соединение |
Енол и карбонильное соединение – изомеры, отличающиеся расположением пары π-электронов, атома водорода и находящиеся в равновесии. Такие изомеры называются таутомерами, а само явление –
таутомерией.
Образующийся в ходе гидратации алкина енол не удается выделить, поскольку таутомерное равновесие всегда сильно сдвинуто в стороны кетоформы.
Перегруппировка енола в кето-форму протекает вследствие высокой полярности связи О-Н, что приводит к легкому отщеплению протона гидроксильной группы.
-
O
OH |
O + H+ |
H H
Далее протон может присоединиться либо обратно к кислороду енолятаниона, либо к углероду. Если он присоединится к углеродному атому, то образуется менее кислое соединение, в котором протон не демонстрирует выраженное стремление к диссоциации. Так в реакционной смеси накапливается кето-форма.
Есть единственный случай, когда в реакции Кучерова образуется альдегид – гидратация самого ацетилена. Во всех других реакциях получаются кетоны.
|
|
|
|
H2O, H+,Hg2+ |
|
|
|
|
|
|
|
|
|
|
H C |
|
|
CH |
|
|
|
|
|
H3C |
|
|
CH2 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
H3C |
|
|
CH |
|
|
|
|
|
|
|
|
3 |
|
|
3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
пропин |
|
|
|
|
|
|
|
|
|
|
|
|
ацетон |
||||||
Гидратация пропина приводит к ацетону, а не к пропионовому альдегиду.
75

Реакции нуклеофильного присоединения. Алкины способны в присутствии катализатора присоединять нуклеофильные реагенты. В результате образуются винильные производные разных классов. Эти реакции называют реакциями винилирования.
|
|
|
|
|
HCN |
R |
|
|
|
|
|
|
CH |
нитрилы |
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
CN |
|
||||
|
|
|
|
|
R'OH |
R |
|
|
|
|
|
|
|
CH2 |
простые эфиры |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||||||||
R |
|
|
CH |
|
R'COOH |
|
|
|
|
|
OR' |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
CH2 |
сложные эфиры |
||||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
R'NH2 |
|
|
|
|
|
OOCR' |
енамины |
|||||
|
|
|
|
|
R |
|
|
|
|
|
|
CH2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
NHR' |
|
|||||
Некоторые реакции нуклеофильного присоединения к алкинам показаны выше. Они часто используются для получения соединений, служащих мономерами в синтезе ВМС. Например, реакция ацетилена с н-бутанолом приводит к бутилвиниловому эфиру, полимеризацией которого получают винилин (бальзам Шостаковского) - ценное лекарственное средство.
KOH, 140o, p HC CH + CH3CH2CH2CH2OH
CH + CH3CH2CH2CH2OH 
ацетилен н-бутанол
H2C CH-O-CH2CH2CH2CH3
CH-O-CH2CH2CH2CH3
бутилвиниловый эфир |
|
|
|
|
|
|||||||||
полимеризация |
|
|
C |
|
H |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||||||
|
* |
|
|
|
C |
|
|
|
|
|
* |
|||
|
|
|
|
|
|
|
n |
|
||||||
|
|
|
|
H2 |
|
OCH CH CH |
|
CH |
||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
||||||||||
|
|
2 |
2 |
2 |
3 |
|
||||||||
поливинилбутиловый эфир (винилин)
Окисление. Как все органические соединения, содержащие кратные углерод-углеродные связи, алкины легко подвергаются окислению самыми различными окислителями, например перманганатом или дихроматом калия. Реакция протекает с полным разрывом тройной связи и образованием карбоновых кислот (алкины с концевой тройной связью образуют карбоновую кислоту и углекислый газ).
76

R |
|
|
|
|
|
|
R' |
|
[O] |
|
|
||
|
|
|
|
|
|
|
|
|
RCOOH |
+ |
R'COOH |
||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||||
R |
|
|
|
CH |
|
[O] |
|
|
|||||
|
|
|
|
|
|
RCOOH |
+ |
CO2 |
|||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|||||||||
Эти реакции могут быть использованы для определения строения алкинов.
Некоторые окислители, например диоксид селена, позволяют проводить селективное окисление алкинов, в ходе которого происходит расщепление только π-связей. При этом дизамещенные алкины превращаются в α-дикетоны, а монозамещенные - в α-кетокислоты.
Полимеризация алкинов. В ряду алкинов наибольший интерес представляют реакции ди-, тримеризациии, а также циклотри- и циклотетрамеризации.
Линейные ди- и тримеры ацетилена, имеющие большое промышленное значение, могут быть получены в присутствии солей одновалентной меди.
2 HC |
|
|
|
CH |
CuCl |
H |
C |
|
|
|
|
CH |
|||
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
винилацетилен |
|||||||||
3 HC |
|
CH |
CuCl |
H |
C |
|
|
|
|
|
|
|
CH |
||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
дивинилацетилен
Винилацетилен является исходным соединением для синтеза хлоропрена (2-хлорбутадиена-1,3), полимеризацией которого получают хлоропреновый каучук.
Циклотримеризация ацетилена, приводящая к бензолу, была открыта в 1866 г. М.Бертло и модифицирована Н.Д. Зелинским и Б.А. Казанским (1922 г.).
C акт., 400о
3 HC CH
CH
Циклотетрамеризация открыта В. Реппе (1949 г.).
Ni(CN)2, 15 атм., 60о
4 HC CH
CH
циклооктатетраен-1,3,5,7
77
•Алкадиены. Классификация, номенклатура, типы диенов. Строение 1,3- диенов: сопряжение π-связей, понятие о делокализованных связях,
использование предельных структур для описания строения бутадиена, качественные критерии их относительного вклада, энергия сопряжения. Физические свойства сопряженных алкадиенов, их спектральные характеристики и способы идентификации.
•Методы получения сопряженных диенов: метод Лебедева, дегидратацией спиртов, из бутан-бутеновой фракции нефти.
2.4. Алкадиены
Диены - соединения, содержащие в молекуле две двойные углеродуглеродные связи. Общая формула гомологического ряда CnH2n-2.
В зависимости от расположения двойных углерод-углеродных связей, диены делят на три группы:
1)диены с кумулированными (примыкающими) двойными связями, например, СН2=С=СН2 (пропадиен, аллен);
2)диены с сопряженными двойными связями, например, СН2=СН-СН=СН2 (бутадиен-1,3);
3)диены с изолированными двойными связями, например, СН2=СН-СН2-СН=СН2 (пентадиен-1,4).
Диены с кумулированными двойными связями являются изомерами алкинов (например, пропин и пропадиен), в которые они превращаются при нагревании в присутствии щелочей.
H3C |
|
|
CH |
H2C |
|
|
|
CH2 |
|
|
|||||||
|
|
|
|
|
||||
|
|
|
|
|
||||
пропин |
пропадиен |
|||||||
Диены с изолированными связями по своему строению и химическим свойствам практически не отличаются от алкенов. Для них характерны реакции электрофильного присоединения, которые могут проходить ступенчато.
Наибольшее теоретическое и прикладное значение имеют сопряженные диены.
Вообще, в органической химии системами с сопряженными связями называют такие молекулы, в которых кратные связи разделены одной простой (σ−) связью. Простейшая из сопряженных систем - бутадиен-1,3 или С4Н6. Исходя из изложенных ранее представлений о строении одинарной, двойной и тройной связи, строение бутадиена не выглядит сложным. Четыре атома углерода находятся в sp2-гибридизованном состоянии и связаны с тремя соседними атомами σ-связями. Кроме того, перекрывание негибридизованных 2р-орбиталей между С-1 и С-2, а также между С-3 и С-4 атомами углерода приводит к образованию двух сопряженных π-связей.
78
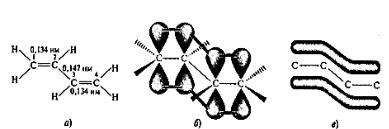
Однако строение молекулы бутадиена значительно сложнее. Установлено, что все атомы углерода и водорода лежат в одной плоскости, в которой находятся также все σ-связи. Негибридизованные π-орбитали перпендикулярны этой плоскости. Расстояние между углеродами С-1 и С-2, как и между атомами С-3 и С-4, равно 0,134 нм, что немного больше длины двойной связи в этилене (0,133 нм), а расстояние между атомами С-2 и С-3, равное 0,147 нм, - значительно меньше σ-связи в алканах (0,154 нм).
Рис. 19. Длина связей (а), перекрывание р-орбиталей (б) и делокализованная МО (в) молекулы бутадиена-1,3
Экспериментальные данные показали, что бутадиен-1,3 устойчивее, чем ожидалось. Энергию непредельных соединений часто оценивают по теплоте гидрирования. Присоединение молекулы водорода к двойной углерод-углерод- ной связи, т.е. превращение непредельного соединения в насыщенное, сопровождается выделением тепла. При гидрировании изолированной двойной связи выделяется около 127 кДж/моль. Следовательно, при гидрировании двух двойных связей следует ожидать выделения 254 кДж/моль. Именно столько тепла выделяется при гидрировании пентадиена-1,4 – соединения с изолированными двойными связями. Гидрирование же бутадиена-1,3 дало неожиданный результат. Теплота гидрирования оказалась всего 239 кДж/моль, что на 15 кДж/моль меньше ожидаемой. Это означает, что бутадиен содержит меньше энергии (более устойчив), чем ожидалось.
Экспериментальные факты могут быть объяснены только особенностями строения бутадиена и других сопряженных диенов.
Алканы, алкены и алкины построены за счет локализованных связей. Такая связь образуется при перекрывании двух атомных орбиталей (АО), а образующаяся связывающая молекулярная орбиталь (МО) является двухцентровой и охватывает два ядра.
В некоторых веществах перекрывание р-орбиталей нескольких атомов образует несколько МО, охватывающих более двух атомов. В этом случае говорят о делокализованных связях, которые характерны как раз для сопряженных систем.
Для объяснения повышенной стабильности и нестандартных длин связей в молекуле бутадиена-1,3 следует подробно рассмотреть четыре sp2-гибридизо- ванных атома углерода, имеющихся в любом сопряженном диене.
79

1 2 3 4
C C C
C C C
C
A
В классических химических формулах каждая черточка означает локализованную химическую связь, т.е. пару электронов. Связи между первым и вторым, а также третьим и четвертым углеродными атомами обозначают как двойную, а между вторым и третьим углеродами - как одинарную (структура А). Перекрывание р-орбиталей, приводящее к образованию двух π-связей, показано на рис. 19а.
Такое рассмотрение абсолютно не учитывает тот факт, что р-электроны атомов С-2 и С-3 также могут перекрываться. Такое взаимодействие показано с помощью следующей формулы Б:
1 2 3 4
C C C C
C C
Б
Дуга указывает на формальную связь между первым и четвертым углеродами диенового фрагмента. Использование для описания строения молекулы бутадиена формулы Б позволяет объяснить уменьшенную длину связи С-2 – С-3. Однако простейшие геометрические расчеты показывают, что расстояние между первым и четвертым углеродными атомами 0,4 нм, что значительно превышает длину простой связи.
Поскольку описание структурных формул на бумаге очень ограничено (валентные черточки показывают лишь локализованные связи) Л. Полинг предложил использовать для сохранения концепции ковалентных связей и привычного изображения молекул так называемую теорию резонанса (метод валентных схем).
Основные принципы этой концепции:
•если молекула не может быть правильно отображена одной структурной формулой, то для ее описания используется набор граничных (канонических, резонансных) структур.
•реальная молекула не может быть удовлетворительно представлена ни одной из граничных структур, а представляет собой их суперпозицию (резонансный гибрид).
•реальная молекула (резонансный гибрид) стабильнее, чем любая из резонансных структур. Увеличение стабильности реальной молекулы называют энергией сопряжения (делокализации, резонанса).
80
