
Organicheskaya_khimia
.pdf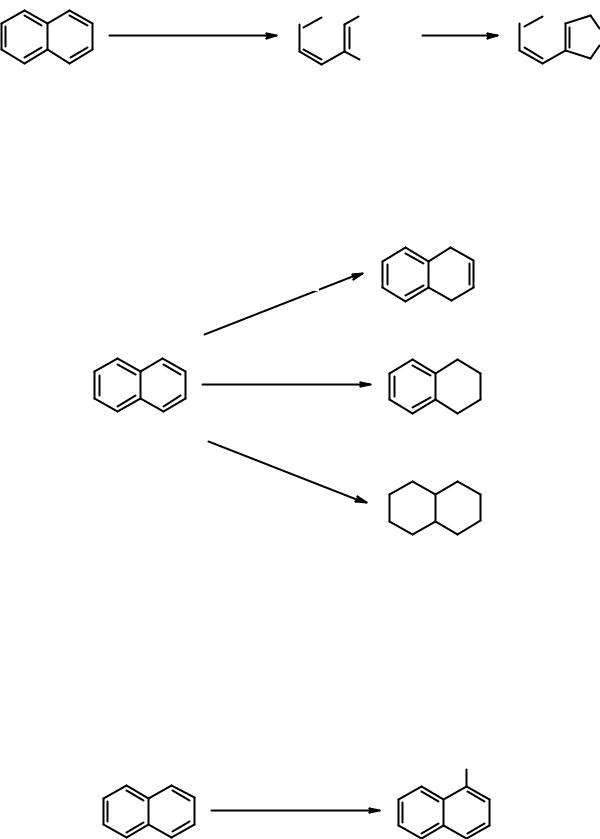
O O2, V2O5, 450-500o 
 COOH
COOH 
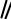
O
COOH  O
O
Образующаяся фталевая кислота в условиях реакции превращается во фталевый ангидрид, который и выделяют в результате превращения.
Реакции восстановления также иллюстрируют меньшую ароматичность нафталина в сравнении с бензолом. Нафталин можно гидрировать химическими восстановителями в мягких условиях.
Na, ROH, 78o
1.4-дигидронафталин
Na, ROH, 132o
H2, кат тетралин
декалин
Реакции ароматического электрофильного замещения
В целом реакции SEAr в нафталине протекают по общему механизму, рассмотренному ранее в разделе «Бензол». Особенность реакций в нафталиновом ряду заключается в том, что даже монозамещенные нафталины существуют в виде двух изомеров (1- и 2-производные). Особенности реакций SEAr рассмотрены на примере реакции нитрования, основной продукт которой - 1-нитронафталин (2-изомер образуется в следовых количествах).
NO2
HNO3к, H2SO4к
1-нитронафталин
Ключевая стадия реакции - образование σ-комплексов, которых может быть два. Надо определить структурные факторы, которые стабилизируют или
131
дестабилизируют интермедиат. Основываясь на этом можно предсказать и объяснить протекание замещения. Рассмотрим строение возможных промежуточных продуктов.
При атаке электрофила по положению 1 нафталина образуется σ- комплекс, строение которого может быть описано двумя граничными структурами, в которых сохраняется бензольный цикл. Такие структуры более стабильны за счет бензольного сопряжения. При атаке электрофила в положение 2 можно нарисовать только одну энергетически выгодную структуру.
H NO2 |
H NO2 |
H NO2 |
+ |
|
|
очень выгодно |
+ |
+ |
очень выгодно |
|
|
H |
NO2 |
H NO2 |
+ |
|
|
+

+ NO2 |
+ |
NO2 |
NO2 |
H |
|
H |
H |
|
|
|
+ |
очень выгодно
NO2 |
NO2 |
H |
H |
+ |
+ |
|
Таким образом можно сделать вывод, что электрофильная атака в положение 1 нафталина приводит к более устойчивому σ-комплексу, чем реакция в положение 2.
Хлорирование и бромирование нафталина, как и нитрование, протекает в положение 1. Реакция идет настолько легко, что в отличие от бензола не требует катализатора – кислоты Льюиса.
132
Br
Br2
1-бромнафталин
Результаты сульфирования нафталина зависят от условий проведения и связаны с обратимостью реакции.
SO3H
H2SO4к, 80o
нафталин-1-сульфоновая кислота
160o
H2SO4к, 160o

 SO3H
SO3H
нафталин-2-сульфоновая кислота
При 80о основной продукт – 1-нафталинсульфокислота, при 160о – 2- нафталинсульфокислота. Нагревание 1-изомера при 160о превращает его в 2- производное. Сульфирование (по причинам, изложенным выше для реакции нитрования) легко протекает в положение 1. По тем же причинам легко протекает и реакция десульфирования. Реакция в положение 2 идет медленно, но образующийся продукт не склонен к десульфированию. При низкой температуре десульфирование проходит медленно, поэтому из реакции выделяют α-изомер. При высокой - десульфирование α-производного становится заметным и из реакции выделяют более устойчивый β-изомер. Эта реакция - один из классических случаев кинетического и термодинамического контроля.
Направление ацилирования нафталина по Фриделю-Крафтсу зависит от природы растворителя, в котором проводится реакция.
133
O R
R
RCOCl, AlCl3
дихлорэтан
RCOCl, AlCl3
O
нитробензол |
R |
Алкилирование нафталина по Фриделю-Крафтсу практического значения не имеет, поскольку в результате реакции образуется многокомпонентная смесь, которую крайне трудно разделить.
Реакции SEAr в производных нафталина
Зависимость направления реакции SEAr от природы заместителя в нафталине заметно сложнее, чем в бензоле. Если дизамещенные бензолы существуют в виде трех изомеров, то в нафталиновом ряду уже 14 изомерных дипроизводных. Входящая группировка может оказаться в кольце или уже имеющем заместитель или в свободном.
На основе знаний о механизме реакции ароматического электрофильного замещения и строении нафталина можно сформулировать два основных правила:
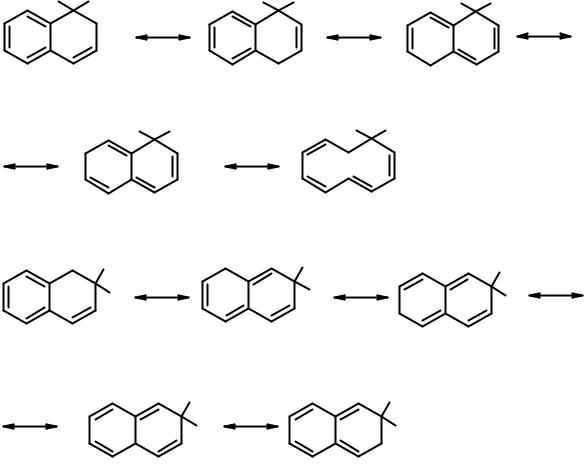
•активирующие группы направляют входящий электрофил в свое кольцо. Если донорная группировка находится в положении 1, второй заместитель входит в положение 4. Если активирующая группа находится в положении 2, второй заместитель входит в положение 1.
•дезактивирующая группа направляет входящий заместитель в α- положение другого кольца при нитровании и галогенировании. В реакции сульфирования направление замещения зависит от температуры и проходит в положения α- или β-свободного цикла.
134
CH3 |
|
|
|
|
|
|
CH3 |
||
|
|
|
|
|
|
|
|
||
|
|
|
HNO3к, H2SO4к |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
SO3H |
SO3H |
|
HNO3к, H2SO4к |
|
NO2 |
Антрацен, фенантрен |
|
Антрацен и фенантрен – трициклические конденсированные ароматические углеводороды. Антрацен относится к линеарным, фенантрен – к ангулярным полициклам.
|
|
|
|
3 |
|
|
|
|
|
4 |
2 |
8 |
9 |
1 |
5 |
|
1 |
7 |
|
2 |
6 |
|
|
|
|
|
|||
6 |
|
3 |
7 |
10 |
|
5 |
10 |
4 |
8 |
9 |
|
|
антрацен |
|
|
фенантрен |
|
Энергия делокализации антрацена – 84 ккал/моль (351,7 кДж/моль), фенантрена – 92 ккал/моль (385,1 кДж/моль).
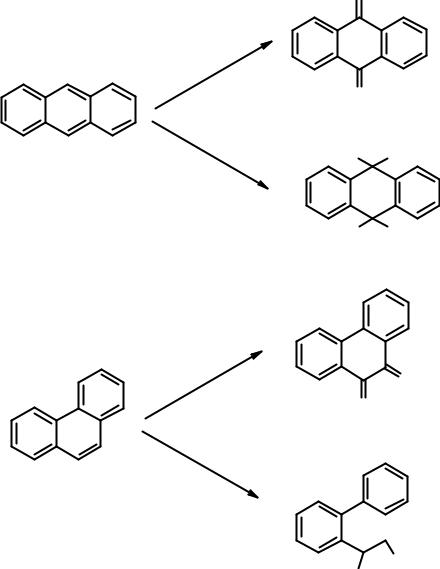
Оба соединения не столь ароматичны как бензол. Ароматичность фенантрена сравнима с нафталином, антрацен менее ароматичен, чем нафталин. Они легко вступают в реакции окисления и восстановления с частичным нарушением ароматической системы. Все реакции (присоединения и замещения) идут в основном по положениям 9 и 10.
135
O
K2Cr2O7,
H2SO4
O
Na,
C2H5OH
H H
H H
K2Cr2O7,
H2SO4
O
O
Na,
C2H5OH
 H
H
H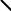 H H
H H
Протекание реакций именно по положениям 9 и 10 трициклических систем легко объяснить. Как видно из схемы, в результате превращений образуются молекулы, имеющие по два изолированных бензольных цикла. Их энергию сопряжения несложно рассчитать: 36 х 2 = 72 ккал/моль. Если предположить возможность протекания восстановления или окисления в боковое кольцо, то в результате образуется бициклическая конденсированная ароматическая система, т.е. нафталин. Его энергия сопряжения 64 ккал/моль, что меньше, чем в рассмотренном выше варианте.
В антрацене реакции бромирования и нитрования протекают через устойчивый продукт присоединения, который ароматизуется только при нагревании.
136
|
H |
Br |
Br |
|
|
||
|
|
|
to |
Br2 |
|
|
|
|
H |
Br |
|
HNO3 |
H |
NO |
NO2 |
|
|
2 |
to
H OH
Сульфирование в мягких условиях приводит к 50% смеси 1- и 2- сульфокислот. При повышении температуры образуются ди- и полизамещенные производные.
Бромирование фенантрена приводит к довольно устойчивому продукту присоединения, который при нагреве отщепляет HBr, превращаясь в 9- бромфенантрен.
Br2 |
|
|
to |
|
Br H H |
Br |
Br |
|
|
||
|
|
|
Другие реакции SEAr приводят к сложным смесям. В результате нитрования фенантрена образуется 36% 9-, 26% - 1- и 22% - 3- нитропроизводного. Сульфирование дает 13% 9-, 8% - 1-, 18% -2 и 18% - 3- фенантренсульфониевых кислот.
137
4.КОНТРОЛЬНЫЕ ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
4.1. Как решать задачи по органической химии?
Проблемы органического синтеза всегда находились в фокусе внимания химиков-oрганикoв. В последние годы обязательным компонентом в решении теоретических и прикладных задач органического синтеза является научное планирование. Надо признать, что очень часто недостатки технологии и затруднения при проведении тех или иных стадий синтеза в той или иной мере связаны с низким качеством планирования.
В общем курсе органической химии студенты также сталкиваются с необходимостью планирования схем получения конкретных органических веществ, причем решение таких задач является одним из важнейших методов изучения основ органического синтеза. При решении синтетических задач студент должен не только проявить знание химических и физических свойств конкретных соединений, но и хорошо представлять их пространственнoe строение, условия взаимных переходов для соединений разных классов, стереохимические особенности реакций и др.
Главная цель обучения синтетическoй органической химии заключается в yсвоeнии студентом генетических связей между классами органических соединений. У гpaмoтного химика оргaникa многократно ветвящиеся переходы между классами и внутри них вполне строго алгоритмизированы. Это достигается опытом и постоянной тренировкой. Именно решение задач по синтезу и превращениям органических соединений наиболее продуктивно в развитии химичеcкой комбинaтоpики, которая позволяет студенту систематизировать свои знания, учит рассчитывать многошаговые органические цепи, определять главный путь к целевому продукту, предвидеть и отсекать побочные процессы (ветви), ликвидировать неоднозначности.
Авторы пособия отдают себе отчет в том, что найденные на пути решения задачи вроде бы правильные цепочки реакций не всегда могут служить рецептом для реального синтеза, а как говорят профессионалы "идут только на бyмаге». Да и на практике, при синтезе конкретного заданного вещества химик полностью игнорирует хорошо усвоенные общие соображения и ищет в многочисленной справочной, моногpафичеcкой, периодической и патентной литературе методику синтеза именно этого соединения. Чаще всего такой путь оправдывает себя, но в связи с резким ростом объема информации в органичеcкой химии и пpoблeмaтичной доступностью некоторых редких изданий иногда проще заново синтезировать вещество, исходя как раз из этих общих сообpажений.
В любом случае, на этапе обучения основам oрганическoй химии решение задач оправдано как средство активного усвоения материала.
138
В издание вошли задачи по методам получения и химическим свойствам алифатических углеводородов (задачи 1-12), их функциональных производных (задачи 13-20), алициклических и ароматических соединений и их производных (задачи 21-35). Перед их решением необходимо тщательно проработать соответствующие разделы курсов органической химии по конспeктaм лекций и учебникам (список литературы дается в конце методического пособия). Издание включает также ряд простых, но практически важных расчетов (задачи 1,2), необходимых для подготовки студентов к лабораторному практикуму по органической химии и к дальнейшей практической деятельности. Работа над ними требует знания общих химичеcких закономерностей, изyчаемых в рамках программ средней школы и I курса института.
Большинство задач (3-36) посвящено органическому синтезу. При их решении необходимо сконструировать молекулы определенного строения исходя из других веществ путем ряда последовательных превращений. Условие задачи обычно задается в виде А → В. Это подразумевает поиск пути синтеза конечного продукта В из исходного вещества А через ряд промежуточных стадий. Составление схемы синтеза удобнее проводить в обратном порядке (ретросинтетический подход), то есть с последней стадии. Основные принципы ретросинтетического подхода:
•определить, к какому классу органических соединений относится конечный продукт В;
•рaссмотреть все методы получения соединений этого класса;
•выбрать оптимальный метод получения B, учитывая строение исходного продукта А и тех веществ, которые могут быть получены на основе А.
Поскольку часто возможно несколько вариантов получения целевого продукта, при решении синтетических задач необходимо выбрать наиболее оптимальный путь. При составлении схем синтеза следует учитывать следующие факторы:
•количество стадий должно быть минимальным, потому что чем больше стадий, тем выше материальные и временные за траты на их реализацию;
•следует стремиться к максимальному выходу целевого продукта на каждой стадии;
•следует избегать создания условий для конкурентных реакций, ведущих к образованию изомеров или побочных веществ;
•по возможности не следует использовать реакции, требующие особых условий проведения (высокое давление и температура, благородные металлы в качестве катализаторов и т.п.) или применение пожаровзрывоопасных веществ;
•выделение продукта не должно встречать технологических затруднений.
139

Следует помнить, что одновременный учет всех этих факторов может приводить к противоречивым результатам. Всегда возможно, однако, найти оптимальный путь синтеза данного соединения.
4.2. Примеры решения задач
Пример 1. Осуществите превpaщение:
|
Cl |
H3C CH2 |
CH3 |
H3C |
|
|
Cl |
Конечный продукт (2,5-дихлоргексан) является дихлорпроизводным предельного углеводорода. Дихлорпроизводные алканов могут быть получены следующими методами:
1.Хлорированием предельных углеводородов.
2.Присоединeниeм хлора к нeнасыщeнным углеводородам.
3.Присоединенем хлopистoгo водорода к двойным связям алкадиенов.
Существуют и другие химические реакции, ведущие к соединениям такого типа, но мы пока ограничимся рассмотрением указанных выше методов.
Первый метод - хлорирование reксана - привел бы к очень пестрой смеси галогенопроизводных с различной степенью замещения (моно-, ди, три- и т.д.), причиной чего является свободнoрадикальная природа реакций замещения в алканах. Только изомерных дихлоpгeкcaнов может получиться более 10. Поскольку выход интересующего нас продукта будет крайне невысоким, а выделение его из смеси - весьма затруднительным, применение этого способа нецелесообразно.
Второй способ - присоединение хлора к aлкeнaм (в данном случае к гексенам) - позволяет получать только вицинальные дихлорпроизводные гексана (с атомами хлора у соседних углеродов), и, следовательно, не может быть использован для получении целевого продукта.
Третий способ - присоединение хлористого водорода к двойным связям диенов. Поскольку в молекуле 2.5-дихлоргексана атомы хлора находятся в положениях 2 и 5, двойные связи в диене должны быть у этих же атомов углерода. Таких диеновых углеводopoдов существует три:
1. СН2=СН-СН2-СН=СН-СН3 гексадиен-1,4 2. СН3-СН=СН-СН=СН-СН3 гексадиен-2,4 3. СН2=СН-СН2-СН2-СН=СН2 гексадиен-l.5
Поскольку в результате присоединения НСl к первым двум диенам следует ожидать образования смеси дихлоpпроизводных (подумайте, почему) предпочтение следует отдать l,5-гексадиену, который однозначно присоединяет
140
