
Organicheskaya_khimia
.pdf
Используют платиновые, палладиевые или никелевые катализаторы. В промышленности чаще используют более дешевый никель.
Присоединение галогенов
Классическая качественная реакция на присутствие в молекуле двойной связи - обесцвечивание бромной воды или раствора брома в инертном растворителе при пропускании через него газообразного алкена.
Br2
Br |
Br |
Механизм реакции присоединения брома к алкенам
Известные экспериментальные факты.
1.При проведении реакции в инертном растворителе (например, в тетрахлорметане) в результате реакции образуется исключительно 1,2- дибромэтан.
2.Если реакция проводится в бромной воде, образуются 1,2-дибромэтан, 2- бромэтанол и бромистый водород.
3.Если в растворе наряду с бромом содержится хлорид натрия, то в продуктах реакции фиксируется 1-бром-2-хлорэтан. Причем сам NaCl не реагирует с этиленом ни в каких условиях.
4.Если образуется соединение, в котором отсутствует вращение относительно углерод-углеродной связи, атомы галогена в нем занимают транс-положение.
Когда молекула галогена подходит к молекуле алкена, π-электроны последнего поляризуют связь в молекуле брома с образованием так называемого π-комплекса:
Br |
|
Br |
Brδ+ |
|
|
|
Brδ- |
|
π-комплекс |
π-Электроны алкена все более сдвигаются к частично позитивированному атому брома, пока полностью не образуют с ним σ-связь, а связь Br-Br гетеролитически разрывается. В результате образуется карбокатион. Затем происходит перекрывание свободной пары электронов брома со свободной
51
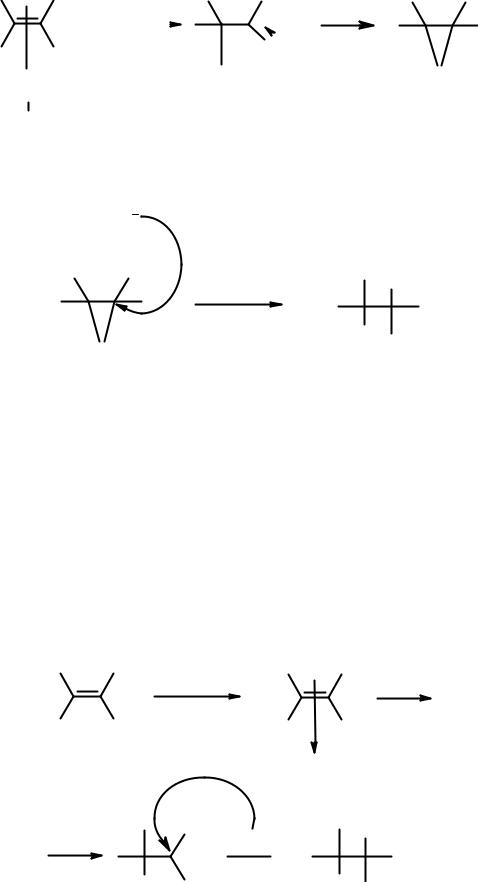
орбиталью карбокатионного центра. Образуются положительно заряженный бромониевый катион и анион брома. Это самая медленная стадия реакции.
медленно
+
 Br:
Br: Br+ Br δ+
Br+ Br δ+
Brδ-
Образовавшийся катион быстро подвергается атаке анионом брома, причем образование связи C-Br происходит с противоположной стороны от Br+.
Br |
|
|
|
быстро |
Br |
|
|
|
Br+ |
|
Br |
|
|
Присутствие в продуктах реакции бромэтанола и бромхлорэтана объясняет тем, что нуклеофильные реагенты, имеющиеся в реакционной смеси (вода, хлорид-анион), наряду с анионом брома вступают в конкурирующую реакцию с бромониевым катионом.
Транс-ориентацию заместителей в продуктах присоединения объясняет последняя стадия, в ходе которой нуклеофил атакует бромониевый катион с противоположной стороны от атома, несущего заряд.
По аналогичному механизму протекают все реакции электрофильного присоединения (AE). Если электрофил способен образовывать ониевый катион, считается, что реакция идет через циклический ониевый катион (не во всех случаях доказано). Если электрофил не может образовывать две связи (например, протон) – реакция идет через карбокатион.
E
E
Nu
+ Nu
E E
52
Первая стадия реакции всегда - атака электрофильной частицы на электроны π-связи с образованием катиона, который быстро присоединяет нуклеофил.
Присоединение галогеноводородов
Алкены легко реагируют с галогеноводородами (кроме HF), образуя соответствующие галогенопроизводные алканов.
HX
H X
(X = Cl, Br, I)
В случае взаимодействия галогеноводорода с несимметричным алкеном возникает вопрос региоориентации реакции, т.е. к какому атому углерода двойной связи присоединяется галоген, а какому - водород.
Например, присоединение бромистого водорода к пропилену может привести к 1-бромпропану или к 2-бромпорпану, либо к смеси этих продуктов. В эксперименте установлено, что преимущественно образуется 2-бромпропан с незначительной примесью 1-изомера.
|
|
|
|
|
|
H3C |
|
Br |
1-бромпропан |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||
|
|
|
CH2 |
HBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
||||
H3C |
|
Br |
|
||||||
|
H3C |
|
CH3 |
2-бромпропан |
|||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
Еще в 1869 г. В. Марковников (Казанский университет) на основе большого числа экспериментальных фактов сформулировал эмпирическое правило:
“Реагент HX присоединяется к несимметричному олефину так, чтобы водород присоединился к наиболее гидрогенизованному (наименее замещенному), а X – к наименее гидрогенизованному (наиболее замещенному) атому углерода двойной связи”.
Таким образом, образование 2-бромпропана происходит в соответствии с правилом Марковникова.
В соответствии с изложенным выше общим механизмом, реакция начинается с атаки электрофильной частицы. В бромистом водороде электрофилом может быть только протон (Н+).
53
|
|
|
|
H+ |
|
|
H |
|
|
|
|
|
|
|
+ |
|
|
|
|||
|
|
|
CH2 |
|
H3C |
или H3C |
+ |
|||
|
|
|
|
CH3 |
||||||
H3C |
|
|
|
|
|
CH2 |
||||
|
|
|
|
|
II |
|
|
|
I |
|
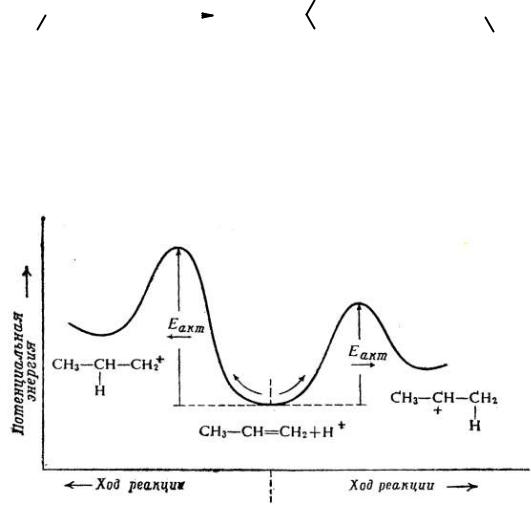
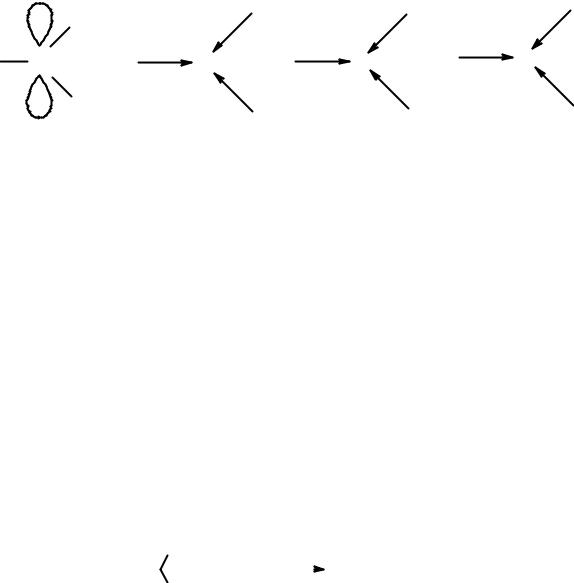
Присоединение протона к двойной связи может теоретически привести к одному из двух карбониевых катионов: первичному (I) или вторичному (II). На практике основной процесс – образование катиона II. Для объяснения этого факта рассмотрим ключевую стадию реакции – присоединение протона (рис. 18).
Рис. 18. Строение и устойчивость карбокатионов
Вобщем случае реакция определяется самым энергетически затратным
местом на энергетической кривой. В реакции AE это – переходное состояние, возникающее в ходе присоединения протона. Переходное состояние не может быть зарегистрировано какими-либо физическими методами. Но для оценки его строения можно использовать постулат Хэмонда.
Вреакциях присоединения к алкенам переходное состояние ближе по энергии к промежуточному продукту (карбокатиону) и, следовательно, структурные факторы, стабилизирующие (понижающие энергию) промежуточный продукт, будут стабилизировать и активированный комплекс.
Рассмотрим, как строение карбониевых катионов влияет на их устойчивость. В зависимости от строения вступающего в реакцию присоединения алкена могут образовываться первичные, вторичные и третичные карбокатионы.
54
|
|
|
H |
|
R' |
R' |
C + |
R |
C + |
R |
C + |
R |
C + |
|
|
|
H |
|
H |
R" |
карбокатион |
|
первичный |
|
вторичный |
|
третичный |
В карбокатионе положительно заряженный атом углерода находится в sp2-гибридном состоянии. Алкильные группы обладают большим положительным индуктивным эффектом по сравнению с атомом водорода. Донорный эффект заместителей, связанных с положительно заряженным углеродом, приводит к увеличению электронной плотности на карбокатионном центре и понижению его энергии. Увеличение числа алкильных групп у карбокатионного центра повышает его стабильность. Устойчивость карбокатионов растет в ряду метильный < первичный < вторичный < третичный.
Образование вторичного карбокатиона II происходит с меньшей энергией активации и большей скоростью, чем первичного карбокатиона I. Это объясняет тот факт, что именно карбокатион II является интермедиатом в рассматриваемой реакции.
Вторая стадия реакции – взаимодействие карбокатиона II с анионом брома – протекает очень быстро и приводит к образованию 2-бромпропана.
|
|
H |
_ |
|
|
H |
||||
|
|
+ |
|
Br- |
|
|
||||
H3C |
|
|
|
H3C |
|
C |
|
CH3 |
||
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||
|
|
CH |
3 |
|
|
|
Br |
|||
|
|
|
|
|
|
|
|
|
|
|
|
II |
|
|
2-бромпропан |
||||||
Общее правило: электрофильное присоединение к двойной углерод-
углеродной связи протекает через образование наиболее стабильного карбокатиона.
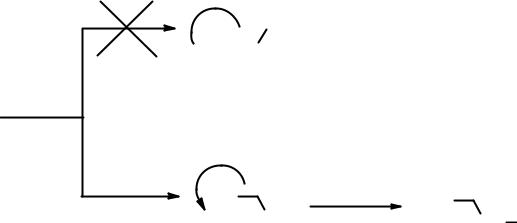
«Правило Марковникова» совпадает с современным объяснением региоселективности присоединения несимметричных реагентов к несимметричным алкенам. Но Марковников сформулировал свое правило для объяснения протекания реакций присоединения галогеноводородных кислот исключительно к этиленовым углеводородам. Наличие в молекуле алкена акцепторных группировок приводит к протеканию реакции против правила Марковникова (в редакции автора), но в соответствии с современной трактовкой.
55
+ H
 Акц
Акц
CH3
менее устойчивый
H+
 CH2 Акц
CH2 Акц
Акц |
+Х- |
Акц |
|
|
CH2 |
|
CH |
2 |
X |
+ |
|
|
|
более устойчивый
В этом примере вторичный карбокатион менее устойчив, чем первичный, т.к. акцепторная группировка находится рядом с заряженным атомом углерода и дополнительно понижает на нем электронную плотность. В случае первичного карбокатиона акцепторная группа и заряженный атом углерода разделены двумя простыми связями. Поскольку индуктивный эффект проявляется на близких расстояниях, первичный карбокатион будет более стабилен.
Поэтому и в рассматриваемом случае присоединение НХ будет протекать через образование наиболее стабильного – первичного - карбокатиона.
•Алкены. Реакции радикального присоединения - реакции против «правила Марковникова». Каталитическое гидрирование алкенов. Окисление: реакция гидроксилирования, образование оксиранов, озонолиз, окислительное расщепление двойной связи.
Радикальное присоединение к алкенам
Присоединение HCl и HI к алкенам всегда протекает в соответствии с правилом Марковникова (в его современном понимании). Присоединение же бромистого водорода может протекать как по Марковникову, так и против этого правила. Объяснение этому факту дали в 1933 г. М. Хараш и Ф. Майо, которые установили, что направление присоединения зависит от механизма реакции. В условиях электрофильного присоединения реакция всегда протекает через образование наиболее устойчивого карбокатиона (в соответствии с правилом Марковникова). Наличие в реакционной смеси пероксидов или веществ, способных в условиях превращения генерировать свободные радикалы, приводит к изменению механизма реакции и она проходит как цепное радикальное присоединение (АR). В качестве инициаторов чаще всего используют органические перекиси.
56

|
|
|
|
RO |
|
OR |
|
|
|
2RO. |
|
|
|
|||||
|
|
|
|
|
|
|
||||||||||||
RO. + |
HBr |
|
|
|
ROH + |
Br . |
|
|||||||||||
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
Br. |
|
|
|
|
Br |
|
||||
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
R'CH2 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
R'CH2 |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
. |
Br |
|
HBr |
|
|
|
|
Br |
. |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
Br |
||||
|
|
|
|
|
|
|
|
|
|
R'CH2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
R'CH2 |
|
|
|
|
|
|
H |
|
||||||||||
Пероксидная связь подвергается гомолитическому расщеплению в темноте при незначительном нагревании или при комнатной температуре на свету. Взаимодействие свободных радикалов с бромистым водородом приводит к образованию свободных атомов брома, атакующих алкен с образованием алкильного радикала, который в свою очередь реагирует с молекулой бромистого водорода, образуя галогенопроизводное и свободный атом брома, ведущий цепь дальше. Промежуточная частица в этой реакции свободный алкильный радикал. Реакция будет протекать через образование наиболее стабильного алкильного радикала. Как было показано ранее (см. раздел алканы), устойчивость алкильных радикалов растет в ряду метильный < первичный < вторичный < третичный.
Учитывая изменение механизма в ходе присоединения бромоводорода к алкенам в присутствии перекисей не вызывает удивления изменение региоориентации в рассматриваемой реакции.
Гидратация алкенов
Присоединение воды к алкенам происходит в присутствии разбавленных минеральных кислот (H2SO4, H3PO4) или действием Al2O3 при 400о, приводя к спиртам.
|
|
|
|
.. |
|
|
|
|
|
|
|
|
|
|
H3C CH2 |
H+ |
H3C |
CH3 |
H2O H C |
|
|
CH |
|
H |
C |
|
CH |
|
|
|
|
3 |
|
|
3 |
|
3 |
|
|
|
3 |
|||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
+ |
|
|
|
|
+ |
-H+ |
|
|
|
|
|
|
|
|
|
|
O |
|
OH |
|
||||||
|
|
|
|
|
H |
H |
|
|
|
|
||||
|
|
|
I |
|
|
II |
|
|
|
|
III |
|
||
На первой стадии происходит атака электрофильной частицей (протоном минеральной кислоты) электронов π-связи, приводящая к образованию карбокатиона I. Это медленная стадия реакции, определяющая ход процесса в целом. Карбокатион I взаимодействует с нуклеофильной частицей, в роли
57
которой выступает молекула воды, предоставляющая одну из своих электронных пар для образования С-О связи. На заключительной стадии оксониевый катион II теряет протон, образуя спирт III.
Как было показано выше, региоориентация присоединения определяется стабильностью промежуточно образующегося карбокатиона и не зависит от природы нуклеофильной частицы. Поэтому гидратация несимметричных алкенов всегда приводит к получению вторичных или третичных спиртов. Единственным исключением является присоединение воды к этилену, в результате которого образуется первичный спирт этанол.
Образование галогенгидринов
Галогенгидринами называют соединения, содержащие вицинально расположенные гидроксильную группу и атом галогена. Их получают реакцией алкенов с водными растворами хлора или брома.
Региоориентация присоединения легко объясняется исходя из предложенного выше механизма электрофильного присоединения. Первая стадия реакции – присоединение галогена - происходит таким образом, что образуется наиболее устойчивый карбокатион.
|
+ |
|
|
|
|
|
OH + |
|
|
OH |
||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|||
|
Cl2 |
H O |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||||
H3C CH2 |
|
H3C |
CH2 |
2 |
|
H3C |
|
|
CH2 |
|
H C |
|
|
CH |
|
|
|
|
|
|
|
|
|||||||
|
|
Cl |
|
|
|
|
Cl |
-H+ |
3 |
|
|
2 |
||
|
|
|
|
|
|
|
|
Cl |
||||||
|
|
|
|
|
|
|
|
|
||||||
Иногда эту реакцию формально рассматривают как присоединение хлорноватистой или бромноватистой кислот к алкенам. Однако существует большое количество экспериментальных фактов, указывающих на то, что галогенгидрины образуются в результате взаимодействия алкенов с галогеном и водой.
Окисление алкенов
Под термином «окисление алкенов» подразумевают реакции, в которых происходит разрыв только π- или π- и σ-связей этиленового фрагмента. Более глубокое окисление, затрагивающее алкильные заместители в этом разделе не рассматривается.
В зависимости от строения алкена, природы окислителя и условий проведения реакции могут образовываться эпоксиды, 1,2-диолы, альдегиды, кетоны, карбоновые кислоты и углекислый газ. Некоторые реакции окисления могут быть использованы для определения положения двойной углеродуглеродной связи.
Образование эпоксидов
Эпоксисоединения (оксираны или органические оксиды) в лаборатории получают действием на алкены пероксикислот (реакция Прилежаева).
58

O |
|
|
R |
O |
|
O OH |
||
|
||
+ |
R |
|
O |
OH |
|
эпоксид |
|
В промышленности получают в больших количествах эпоксиэтилен (этиленоксид) окислением этилена кислородом воздуха в присутствии серебряного катализатора.
|
|
|
O , Ag, 300o |
H2C |
|
CH2 |
|
H2C |
|
CH2 |
2 |
|
|
||
|
|
O |
|||||
|
|
|
|||||
|
|
|
|
|
|||
|
|
|
|
|
эпоксиэтилен |
||
Окислительное расщепление двойной связи
Сильные окислители (перманганат калия, дихромат калия, оксид хрома и др.) при нагревании легко расщепляют молекулу алкена по двойной связи. В зависимости от строения алкена результатом могут быть карбоновые кислоты и/или кетоны. Алкены с терминальной двойной связью выделяют также и СО2.
R' |
|
|
|
|
|
|
|
R''' |
|
[O] |
|
R' |
+ |
|
|
|
|
R''' |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
|
|
|
R'''' |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
R'' |
|
|
|
|
|
|
|
R'''' |
|
|
|
|
R'' |
|
|
|
|
|
|||||||||
R' |
|
|
|
|
|
|
|
R''' |
|
[O] |
|
R' |
+ |
|
|
|
|
R''' |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
|
|
OH |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
R'' |
|
|
|
|
|
|
|
H |
|
|
|
|
R'' |
|
|
|
|
|
|||||||||
R' |
|
|
|
|
|
|
|
H |
|
[O] |
|
R' |
+ |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
CO2 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
R'' |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
R'' |
|
|
|
|
|
|
||||||||||
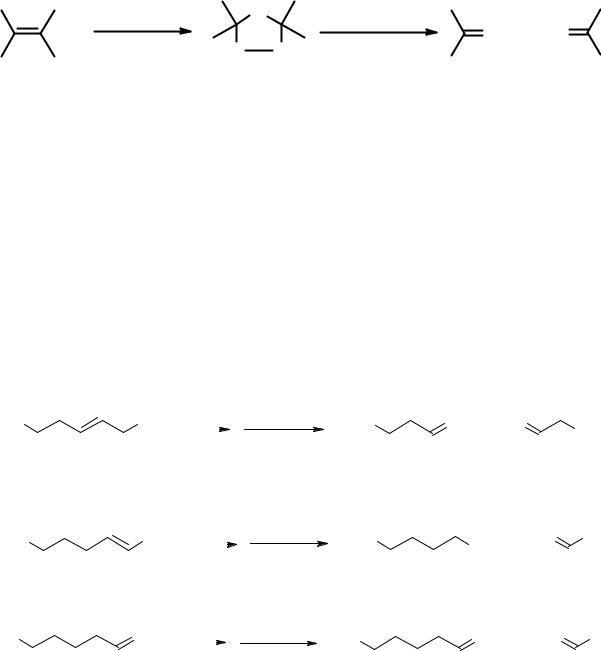
Озонолиз (реакция Гарриеса)
Алкены даже при пониженных температурах легко окисляются озоном с расщеплением и π- и σ-связи алкенового фрагмента. Озон пропускают через раствор алкена в инертном растворителе, после упаривания которого остается вязкое масло – озонид.
59
O3, CCl4 |
O |
H2O, Zn |
|
O O |
O + O |
|
|
|
алкен |
озонид |
карбонильные |
|
|
соединения |
Обычно озониды не выделяют из-за их высокой взрывоопасности. Их разлагают водой в присутствии восстанавливающего реагента (цинковой пыли), чтобы предотвратить окисление альдегидов в карбоновые кислоты. В результате образуются карбонильные соединения (альдегиды и кетоны), в которых атомы кислорода связаны двойными связями с теми атомами углерода, которые в исходном алкене были соединены двойной углерод-углеродной связью.
Карбонильные соединения легко могут быть идентифицированы физикохимическими методами, поэтому реакция Гарриеса часто используется для определения положения двойной связи в углеродной цепи. Ниже приведены результаты реакций озонолиза трех изомерных гептенов.
|
|
|
H |
|
O3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
H C |
|
|
|
|
|
|
|
CH |
|
H2O, Zn H |
C |
|
O |
+ |
O |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||
3 |
|
|
3 |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
H |
|
|
H |
|||||||||||||||
|
гептен-3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
H |
|
O3 |
|
|
|
O |
|
|
|
|
|
|
|||||||||||
H3C |
|
|
|
|
|
|
|
CH3 |
|
H2O, Zn H3C |
|
|
|
|
|
H + |
|
O |
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
||||
|
гептен-2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
H3C |
|
|
|
|
|
|
|
CH2 |
|
|
O3 |
H2O, Zn H3C |
|
|
|
|
|
|
O + |
|
O H |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
H |
|
|
|
|
H |
||||||
|
гептен-1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Строение продуктов озонолиза однозначно указывает на положение двойной углерод-углеродной связи в молекулах анализируемых алкенов. При озонолизе веществ со вторичными углеродами при кратной связи в результате образуются кетоны, с первичными – альдегиды, с концевой двойной связью – углекислый газ.
Гидроксилирование алкенов (реакция Вагнера)
Русский химик Е.Е. Вагнер в 1898 г. открыл реакцию окисления алкенов до гликолей. Гликолями называют двухатомные спирты с вицинальным расположением гидроксильных групп. Окисление проходит при комнатной температуре в нейтральном или слабощелочном растворе перманганата калия.
60
