
Organicheskaya_khimia
.pdf
Химической промышленности необходимо значительно большее количество низших углеводородов, чем может быть извлечено из углеводородного сырья. Алканы подвергаю пиролизу (от греческих слов pyr – огонь и lisis – разрушение), т.е. термическому разложению. Пиролиз алканов называют крекингом. Термический крекинг состоит в пропускании алканов через металлическую колонку, нагретую до высокой температуры (от 450 до 900оС). При этом высшие алканы превращаются в насыщенные соединения с меньшим молекулярным весом, алкены и водород. В качестве примера приведем крекинг пропана, приводящий к образованию пропилена, этилена, метана и водорода.
CH3CH2CH3 |
to |
CH4 + CH3CH=CH2 + CH2=CH2 + H2 |
•Основные методы получения алканов: гидрирование алкенов и алкинов, восстановление кислород- и галогенсодержащих соединений, реакция Вюрца, декарбоксилирование и электролиз солей карбоновых кислот. Природные источники алканов.
Природные источники и методы получения алканов
Основные природные источники предельных углеводородов - нефтяные и газовые месторождения. Природный газ содержит в основном низшие алканы, находящиеся при н.у. в газообразном состоянии (метан, этан, пропан и бутан).
Сырая нефть состоит из сотен химических соединений. Для получения веществ, которые можно использовать в качестве горючего и сырья для химической промышленности, сырую нефть подвергают фракционной перегонке. Получаемые фракции представляют собой смеси органических соединений различных классов, кипящих в соответствующем интервале температур.
Фракционный состав нефти
Фракция |
Т. кип. (оС) |
|
Число атомов |
Применение |
|
|
|
|
углерода |
|
|
Газ |
< 20 |
C1 |
– C4 |
Топливо |
|
Петролейный эфир |
20 – 100 |
С5 |
– С7 |
Растворитель |
|
Природный бензин |
40 – 205 |
С5 |
– С10 и |
Двигатели |
|
циклоалканы |
|||||
|
|
внутреннего |
|||
|
|
|
|
||
|
|
|
|
сгорания |
|
Керосин |
175 – 325 |
С12 – С18 и |
Реактивные |
||
|
|
ароматические |
двигатели |
||
|
|
углеводороды |
|
||
41
Газойль (соляровое |
200 – 400 |
С12 и выше |
Дизельные |
масло) |
|
|
двигатели |
Смазочные масла |
Нелетучие |
Высшие алканы, |
Смазочные масла |
|
жидкие |
содержащие |
|
|
|
циклические |
|
|
|
фрагменты |
|
Асфальт (битум) |
Нелетучие |
Полициклические |
Покрытие дорог |
|
твердые |
|
|
Выделяемые из нефтяных фракций индивидуальные химические соединения являются ценнейшим сырьем для получения массы необходимых продуктов (лекарства, полимеры и т.д.).
Получение алканов. Лабораторные и промышленные методы синтеза
Все методы получения органических соединений могут быть разделены на две большие группы: промышленные и лабораторные.
Впромышленности обычно получают вещество в больших количествах, стремясь к максимальной рентабельности. Часто в технике могут быть использованы не чистые органические соединения, а смеси. В ряде случаев экономически выгодно проводить разделение даже сложных смесей, в особенности, если одновременно удается выделить и другие полезные вещества. Известно много случаев, когда оказывается прибыльна разработка уникального метода синтеза и построение специального предприятия для выпуска высокорентабельного вещества.
Влаборатории обычно необходимо синтезировать небольшие количества вещества (граммы и доли грамма). В исследованиях химикам почти всегда необходимы индивидуальные вещества, а не смеси. В отличие от промышленности время имеет большую ценность, чем цена. Кроме того, лабораторные синтезы всегда гибкие, потому что исследователь не заинтересован в многократном повторении изученного процесса. Поэтому используются методы, позволяющие быстро, с высоким выходом получить целевой продукт с минимальным содержанием примесей.
Важно, что лабораторные (но не промышленные) методы, как правило, могут быть распространены на весь класс синтезируемых соединений.
В ходе изучения курса органической химии основное внимание направлено на лабораторные методы получения. При решении задач не следует использовать промышленные методы, даже в том случае, если они используются для получения именно того вещества, синтез которого необходимо спланировать. Например, если в ходе синтеза необходимо синтезировать этилен, его следует получать, используя общие методы синтеза алкенов, хотя это соединение в огромных количествах получают крекингом.
42

Алкены и алкины в присутствии гетерогенных катализаторов, таких как Pt, Pd, Ni, легко присоединяют один или два моль водорода при незначительном нагревании и невысоком давлении. При этом количественно образуются алканы с тем же углеродным скелетом.
R R'
R'
R'
H2, Ni, p, to
R
R R'
R'
Галогенопроизводные насыщенных углеводородов могут быть восстановлены до алканов металлом в кислой среде:
RX + Zn + H+ |
|
RH + Zn2+ + X- |
|
Также алканы могут быть получены гидролизом реактивов Гриньяра:
RMgX + H2O  RH + Mg(OH)X
RH + Mg(OH)X
Приведенные выше методы позволяют синтезировать алканы, имеющие такой же углеродный скелет, как в исходной молекуле.
Для синтеза парафинов, строение углеродной цепи которых отличается от исходных веществ, известно несколько методов. Моногалогенопроизводные алканов при взаимодействии с металлическим натрием превращаются в предельные углеводороды по реакции Вюрца. В ходе реакции образуется
углерод-углеродная связь между атомами углерода, связанными в исходном соединении с галогенами.
2 |
CH3 |
|
|
H3C |
|
CH3 |
|
|
2Na |
|
|
|
|||
|
|
|
|
|
|
||
H3C Cl |
-2NaCl |
H |
C |
|
CH |
||
|
|
|
3 |
|
3 |
||
2-Бромпорпан |
|
2,3-Диметилбутан |
|||||
Реакция Вюрца может быть использована исключительно для синтеза симметричных алканов (R-R) с четным числом углеродных атомов. Во избежание образования смесей алканов в эту реакцию нужно вводить только одно галогенопроизводное.
Ограничения реакции Вюрца понятны из следующего примера.
|
|
|
|
CH |
CH |
+ |
CH CH CH |
3 |
|
|
|
|
|
3 |
|
3 |
3 |
2 |
|
CH Cl + |
CH CH Cl |
Na |
этан |
|
пропан |
|
|||
|
|
|
|
|
|
|
|||
3 |
3 |
2 |
|
|
|
|
|
|
|
хлористый |
хлористый |
|
+ |
CH3CH2CH2CH3 |
|
||||
метил |
этил |
|
|
|
|
|
н-бутан |
|
|
|
|
|
|
|
|
|
|
|
|
43

В реакции образуется смесь пропана, этана и н-бутана. Поскольку скорости реакций близки, невозможно предложить условия, в которых образование пропана будет преобладающим процессом. Следовательно, две трети исходных веществ будут израсходованы впустую. Кроме того, возникает сложная проблема разделения продуктов реакции.
При распространении реакции Вюрца на более сложные галогенопроизводные следует соблюдать осторожность. Щелочные металлы обладают очень высокой реакционной способностью. Если в молекуле, кроме атома галогена, есть функциональные группы, в большинстве случаев реакция натрия или калия с ними пойдет быстрее, чем с галогеном. Не имеет смысла даже пытаться проводить реакцию Вюрца, если в молекуле наряду с галогеном есть гидрокси- (OH), карбокси- (СOOH), сульфо- (SO3H) и многие другие группировки.
Одним из способов получения алканов является реакция декарбоксилирования (отщепления СО2) солей карбоновых кислот. В некоторых случаях этот процесс происходит очень легко уже при незначительном нагревании. Hасыщенные карбоновые кислоты алифатического ряда отщепляют карбоксильную группу только при прокаливании их солей со щелочью.
O
NaOH,
H3C ONa -Na2CO3 CH4
ONa -Na2CO3 CH4
В результате декарбоксилирования образуется алкан, содержащий на один атом углерода меньше, чем было в исходной кислоте.
Если соль карбоновой кислоты алифатического ряда подвергнуть электролизу (анодный синтез Кольбе), то на аноде карбоксилат-анион отдает электроду один электрон, превращаясь в нестабильный радикал. Выброс СО2 приводит к алкильному радикалу. При рекомбинации двух алкильных радикалов образуется симметричный алкан с четным числом атомов углерода.
RCOONa электролиз RCOO. |
|
R. |
||||
|
||||||
|
- e |
- CO2 |
||||
2R. |
|
R |
|
R |
|
|
|
|
|
|
|||
44
•Алкены. Гомологический ряд, номенклатура, виды изомерии. Геометрическая изомерия в ряду алкенов. Цис- и транс-изомеры, E,Z- номенклатура. Причины отсутствия свободного вращения относительно двойной связи. Физические свойства, закономерности их изменения в гомологическом ряду и спектральные характеристики алкенов.
•Методы получения: дегидрирование алканов, крекинг нефти, частичное гидрирование алкинов, дегалогенирование, дегидрогалогенирование галогеналканов и дегидратация спиртов (правило Зайцева).
2.2. Алкены (олефины, этиленовые углеводороды)
Алкены - открытоцепные углеводороды, отвечающие общей формуле CnH2n.и содержащие в молекуле одну двойную связь (π-связь).
По сравнению с алканами соответствующие этиленовые углеводороды образуют большее число изомеров, что связано не только с различиями в углеродных скелетах, но также с расположением двойной связи и геометрией молекулы.
Рассмотрим изомерию алкенов с четырьмя атомами углерода. Кроме структурных изомеров есть изомеры положения двойной связи (бутен-1 и бутен-2). Бутен-2 может существовать в виде двух изомеров, отличающихся пространственным расположением заместителей относительно двойной связи. Поскольку свободное вращение относительно π-связи невозможно (барьер 60 ккал) и весь фрагмент молекулы лежит в одной плоскости, метильные группы могут располагаться либо с одной стороны от двойной связи, либо с противоположных сторон. В названии первых используют приставку цис- (с одной стороны – лат.), вторых – транс- (через – лат.). Такой вид пространственной изомерии называется геометрической.
CH2 |
|
|
CH3 |
|
CH3 |
|
H3C |
|
H3C CH2 |
||
H3C |
|
|
|
||
бутен-1 |
|
|
бутен-2 |
|
метилпропен |
H |
|
CH3 |
H |
|
CH3 |
H |
|
CH3 |
H3C |
|
H |
|
|
||||
цис-бутен-2 |
транс-бутен-2 |
||||
Использование цис- и транс-номенклатуры позволяет однозначно описать строение лишь тогда, когда этиленовым фрагментом связаны два типа
45
одинаковых заместителей (в примере - СН3 и Н). Если при двойной связи более двух заместителей, то используют так называемую Е, Z-номенклатуру (от нем. Entgegen – напротив и Zusammen – вместе). В этом случае определяют взаимное расположение двух старших из имеющихся заместителей у разных углеродов двойной связи, причем старшими считаются заместители, имеющие большую молекулярную массу.
I |
|
|
II |
|
|
III |
IV |
|
|
|
|
|
|
H |
H |
H |
H |
F |
C2H5 |
F |
C H |
|
N |
N |
||
5 |
H |
|
|
H |
||||
|
|
|
2 |
|
|
|||
H3C |
Cl |
Cl |
CH3 |
|
H |
O |
H |
O |
|
H |
OH |
H |
|
||||
|
|
|
|
|
|
OH |
||
E-изомер |
Z-изомер |
|
H H H |
H H H |
|
|||
|
|
|
|
|
|
E-изомер |
Z-изомер |
|
Впаре соединений I и II конфигурацию молекулы определяют атомы галогена. У соединения I они расположены по разные стороны от двойной связи (Е-изомер), а у соединения II - по одну сторону (Z-изомер). В случае веществ III и IV определение старшинства заместителей провести сложнее, т.к.
стригональными углеродами связаны атомы углерода. В этом случае определение старшинства проводится по так называемому «второму слою», т.е. определяют старшинство заместителей, связанных с этими углеродами. В приведенном примере старшей группой будет СООН, затем – CN, третьей по
старшинству – С2Н5 и самой младшей – СН3. Такое старшинство заместителей позволяет отнести соединения III и IV к E- и Z-изомерам соответственно.
Всоответствии с номенклатурой IUPAC в качестве основы названия алкена выбирается самая длинная углеродная цепь, содержащая двойную углерод-углеродную связь. Затем следует определить, какому алкану она соответствует и использовать его название с заменой окончания –ан на -ен. Положение двойной связи указывается цифрой. Затем надо назвать заместители в боковой цепи и указать цифрами их положение.
46

10
|
H3C |
|
|
|
9 |
|
|
|
7 |
8 |
|
|
|
|
|
|
|
6 |
|
|
5 |
2 |
1 |
|
|
||
H3C |
4 |
3 |
CH3 |
|
|
В примере цифрами показана самая длинная углеродная цепь, содержащая двойную связь. За основу названия выбран насыщенный углеводород декан. Непредельное соединение, соответственно - децен. Поскольку, двойная связь расположена между третьим и четвертым атомами С
– децен-3. С пятым атомом углерода основной цепи связан углеводородный заместитель, состоящий из пяти атомов углерода - пентил. Полное название непредельного вещества 4-(пентил-1)-децен-3. Это соединение существует в виде пары E,Z-геометрических изомеров.
Получение алкенов
Основной промышленный источник алкенов – нефть. Низшие алкены (до 5 углеродов в цепи) в индивидуальном виде выделены при ее фракционной перегонке или крекинге.
Лабораторные методы получения алкенов позволяют получать в индивидуальном виде как высшие, так и низшие производные.
Более общее применение при получении алкенов имеют реакции дегалогенирования моногалогенопроизводных и дегидратация спиртов.
Дегидрогалогенирование алкилгалогенидов
Действие на алкилгалогенид раствора едкой щелочи в этаноле приводит к элиминированию (отщеплению) молекулы галогеноводорода с образованием алкена. Реакция элиминирования будет рассмотрена в следующих разделах. Здесь необходимо отметить, что следует точно выдерживать условия реакции. Использование не спиртового, а водного раствора щелочи приводит к протеканию конкурентной реакции гидролиза с образованием соответствующего спирта.
Cl |
|
|
|
|
|||||
|
|
CH3 KOH (спирт) |
|
|
CH |
|
|||
H3C |
H C |
3 |
|||||||
|
|
|
|
|
|||||
|
|
|
|
||||||
|
|
|
-HCl |
3 |
|
|
|
||
|
|
|
CH |
|
|||||
|
CH3 |
|
|||||||
|
|
|
|
|
3 |
|
|||
2-метил-3-хлорбутан |
метилбутен-2 |
|
|||||||
(основной продукт)
47
Как видно из схемы, возможно образование двух изомерных веществ - производных бутена-1 и бутена-2. Направление реакции предсказывает правило Зайцева: в ходе реакции элиминирования образуется алкен с наибольшим числом заместителей при двойной связи. Это правило совпадает с рядом устойчивости алкенов, которая убывает в ряду:
R' |
|
|
|
R' |
R' |
|
|
|
R' |
R' |
|
|
|
H |
|
|
|
|
R' |
|
|
|
H |
|
|
|
|
|
> |
|
|
|
|
> |
|
|
|
|
> R' |
|
|
|
R' > |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
R"' |
|
|
|
R"" |
R"' |
|
|
|
H |
R" |
|
|
|
H |
|
|
|
|
H |
|
|
|
H |
Дегидратация спиртов
|
|
|
|
H+, to |
|
|
|
|
|
|
|
|
|
|
|
-H2O |
|
H OH |
|||||
Реакция подобна дегидрогалогенированию, однако условия ее протекания другие. Реакцию проводят, нагревая спирт с разбавленной серной или фосфорной кислотами при температуре около 200 оС, либо пропуская пары спирта при 400 оС над оксидом алюминия (Al2O3). Направление отщепления воды от спирта то же самое, что и в случае отщепления галогеноводорода – атом водорода отщепляется от соседнего с функциональной группой наименее гидрогенизированного атома углерода. «Гидрогенизированный» - атом углерода, несущий водородные атомы. Водород отщепляется от того углерода, который связан с меньшим числом атомов водорода.
Если в органическом соединении два заместителя связаны с одним атомом углерода, такое расположение атомов или функциональных групп называется вицинальным (виц-). Если атомы или функциональные группы связаны с соседними углеродными атомами – геминальным (гем-).
Вицинальное и геминальное
X
X X X
расположение заместителей
Дегалогенирование дигалогенопроизводных
Вициальные дигалогенопроизводные под действием цинковой пыли легко отщепляют два атома галогена, превращаясь в алкен:
48

Zn
X X - ZnX2
X = Cl, Br, I
Парциальное (частичное) гидрирование алкинов
Источником алкенов могут быть и ацетиленовые углеводороды. Гидрирование алкинов в присутствии гетерогенного катализатора (Pt, Pd, Ni) сразу приводит к предельным углеводородам, поскольку промежуточно образующиеся алкены вступают в реакцию гидрирования легче, чем алкины.
|
|
|
|
|
H2, кат |
H |
H |
||
R |
|
|
|
R' |
|
R |
|
|
R' |
|
|
|
|
||||||
|
|
|
|
|
|
||||
|
|
|
|||||||
|
|
|
|
|
|
H |
H |
||
Для частичного гидрирования алкинов используют специально приготовленный катализатор, так называемый «отравленный катализатор» или «катализатор Линдлара» (палладий, содержащий свинец). Гидрирование на катализаторе Линдлара останавливается на стадии образования алкена и, следовательно, он не может быть использован для превращения алкенов в алканы. Следует отметить, что при таком восстановлении всегда образуются цис- или Z-изомеры.
R R' H2, Pd/Pb
R' H2, Pd/Pb H
H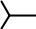

 H
H
R R'
Похожий результат может быть получен при гидрировании алкинов металлическим натрием в жидком аммиаке. Принципиальное отличие этой реакции от каталитической в том, что образуются алкены транс- или Z- конфигурации.
|
|
|
|
Na, NH3 жид. |
R |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
R' |
H |
|
|
|
R' |
|
|
|
|
|
|
||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
49

•Алкены. Химические свойства. Реакции электрофильного присоединения галогенов, галогеноводородов, кислот (H2SO4 и HClO), воды, гидроборирование. Правило Марковникова, его современная трактовка на основе представления о механизме реакции и относительной стабильности карбониевых ионов. Стереоспецифичность электрофильного присоединения.
Химические свойства алкенов
Характерной особенностью алкенов, определяющей их химические свойства, является наличие двойной углерод-углеродной связи, которая является комбинацией π- и σ-связей. Энергия π-связи (60 ккал/моль) меньше, чем σ-связи (85 ккал/моль). Типичными для двойной связи являются реакции присоединения, при которых происходит разрыв π-связи с образованием двух σ-связей:
|
|
|
|
|
X-Y |
H |
H |
||
R |
|
|
|
R' |
X |
|
|
Y |
|
|
|
|
|
|
|
||||
|
|
|
|
||||||
|
|
|
|
|
|
R |
R' |
||
При этом из двух или большего числа простых молекул образуется одно более сложное соединение.
π-Электроны двойной связи находятся над и под плоскостью, в которой расположены атомы этиленового фрагмента (см. рис. 6). Они могут быть относительно легко атакованы реагентами, имеющими недостаток электронной плотности (электрофилами). Сами алкены выступают в роли донора пары электронов. Таким образом, типичными реакциями алкенов являются реакции электрофильного присоединения (AE). Кроме того, алкены легко вступают в реакции присоединения с участием свободных радикалов (AR).
Не следует забывать, что кроме фрагмента двойной связи все алкены (исключение - этилен) содержат и алкильные группы, которые способны участвовать и реакциях замещения, описанных в разделе алканы.
Присоединение водорода (гидрирование)
Присоединение молекулы водорода по двойной связи - экзотермическая реакция, протекающая в отсутствие катализатора даже при повышенной температуре с низкой скоростью. В присутствии гетерогенного катализатора, роль которого заключается в понижении энергии активации, реакция способна протекать уже при комнатной температуре.
H2, кат
H H
50
