
Organicheskaya_khimia
.pdf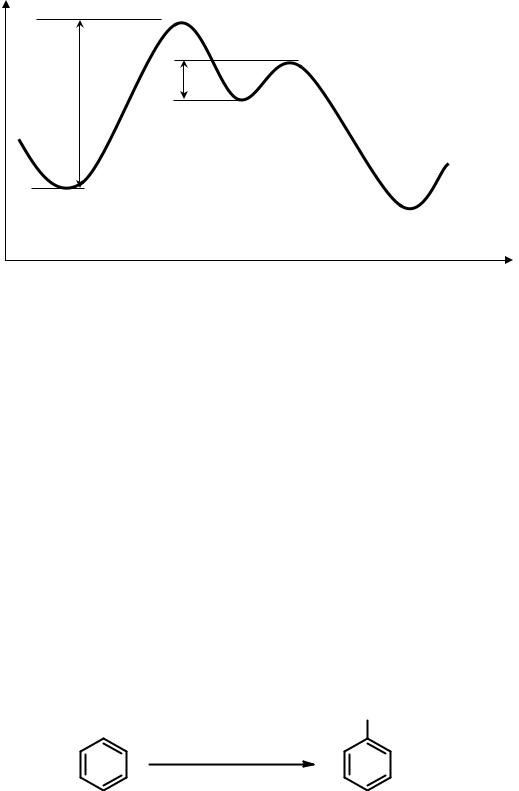
Из энергетического профиля реакции SEAr (рис. 18.1) можно сделать вывод, что первая стадия реакции (образование σ-комплекса) является определяющей. Её энергия активации (Еа1) значительно большее энергии активации второй стадии (Еа2).
E
Ea1 |
Ea2 |
|
H-Ar+-E
Ar-H + E+ Ar-E + H+
координата реакции Рис. 28. Энергетическая диаграмма реакции
ароматического электрофильного замещения (SEAr)
Доказательством правильности изложенного механизма является отсутствие первичного кинетического изотопного эффекта в реакциях SEAr дейтерированного бензола.
Рассмотрение рис. 28 позволяет сделать важный вывод. Высшая точка реакции – переходное состояние, строение которого не может быть установлено, образующееся на первой стадии, по энергии ближе к промежуточному продукту (σ-комплексу). Поэтому все факторы, стабилизирующие σ-комплекс, будут стабилизировать (уменьшать энергию, облегчать реакцию) и переходное состояние. Рассмотрим конкретные реакции замещения, обращая внимание на природу атакующего агента.
Реакция нитрования
Нитрование бензола проводится «нитрующей смесью» (смесь концентрированных азотной и серной кислот). В результате реакции образуется нитробензол.
NO2
HNO3к, H2SO4к
111
Образование электрофильной частицы происходит при взаимодействии кислот.
HO |
|
NO2 |
+ H2SO4 |
+ |
|
|
|
|
|
|
+ |
NO2 |
||||
|
|
|
|
H2O |
|
NO2 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
-H2O |
|
|
||||||||
|
|
|
|
-HSO - |
|
|
нитроний-катион |
|||||||||
|
|
|
|
4 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||
Это кислотно-основное равновесие, в котором серная кислота (более сильная) выступает в качестве кислоты (донора протона), а азотная (менее сильная) – в качестве основания (акцептора протона). Образующийся электрофильный нитроний-катион и начинает реакцию.
Галогенирование
Непосредственно в бензольное кольцо реакцией галогенирования можно ввести только хлор и бром. Введение же фтора и йода осуществляют через соли диазония (будет рассмотрено позже).
Реакции идут только в присутствии катализаторов – кислот Льюиса. При хлорировании обычно используют безводный AlCl3, при бромировании – FeBr3. Взаимодействие хлора или брома с соответствующей кислотой Льюиса генерирует в реакционной смеси электрофил:
Cl2 + AlCl3 |
|
|
|
|
Cl+ + AlCl4- |
|||||||||
|
|
|
||||||||||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
||
|
|
|
|
|
Cl2, AlCl3 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алкилирование по Фриделю-Крафтсу
Гомологи бензола могут быть получены введением в бензольное кольцо алкильной группы по реакции Фриделя-Крафтса. Электрофил генерируется при взаимодействии кислоты Льюиса с моногалогенопроизводным.
Alk-Cl + AlCl |
3 |
|
|
|
Alk+ + AlCl |
4 |
|
|
|||||
|
|
|
||||
|
|
|
|
|
алкильный катион
Alk
Alk-Cl, AlCl3
Известна модификация реакции Фриделя-Крафтса, в которой электрофил генерируется при взаимодействии алкена и минеральной кислоты.
112
|
+ |
|
H3C CH2 |
H3C |
CH3 |
|
H3C |
CH3 |
|
Cl2, AlCl3 |
|
|
кумол |
|
|
(изопропилбензол) |
|
Ацилирование по Фриделю-Крафтсу
Отличие от предыдущей реакции в том, что в кольцо вводят не остаток алкана, а остаток карбоновой кислоты – ацил. В результате реакции образуются кетоны.
R |
|
|
|
O |
|
|
|
|
O |
+ AlCl4 |
- |
|||||
|
|
|
|
+ AlCl3 |
|
|
|
R |
|
|
+ |
|
||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
Cl |
|
|
|
|
|
|
|
|||||
хлорангидрид |
ацилиевый катион |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
O |
R |
|
|
||||
|
|
|
|
|
Cl2, AlCl3 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сульфирование
Сульфирование проводят либо олеумом, либо концентрированной серной кислотой. В любом случае в качестве электрофила выступает оксид серы (VI), в котором атом серы имеет недостаток электронной плотности. Сульфирование отличается от остальных реакций SEAr тем, что она обратима. Варьируя условия можно выполнить как сульфирование, так и десульфирование.
δ+ SO3H H2SO4, SO3 
H+, H2O, пар
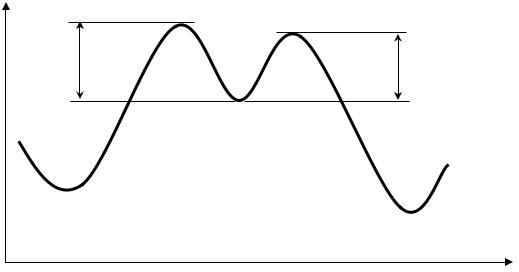
Причины особенностей реакции сульфирования понятны из рисунка 29. Энергии активации превращений σ-аддукта в продукт реакции (Еапр) и в исходные соединения (Еаоб) очень близки.
113
E
Eaоб |
Eaпр |
|
H-Ar+-SO3-
Ar-H + SO3 |
Ar-SO3H |
|
|
|
координата реакции |
Рис. 29. Энергетическая диаграмма реакции сульфирования
Высокие концентрации серной кислоты (обычно используют олеум) сдвигают реакцию в сторону сульфирования. Низкие концентрации серной кислоты (обычно в раствор сульфоновой кислоты в водной H2SO4 пропускают перегретый пар) – в сторону десульфирования.
Эта особенность реакции сульфирования часто используется в органическом синтезе. Проведя реакцию сульфирования, блокируют какое-то положение в бензольном кольце. Затем проводят с веществом необходимые превращения, после чего удаляют сульфогруппу.
•Реакции SEAr в замещенных бензолах. Факторы, влияющие на скорость реакции и соотношение образующихся изомеров. Правила ориентации. Влияние природы заместителя на устойчивость σ-комплексов и
направление SE реакций. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты. Согласованная и несогласованная ориентация.
•Реакции гомологов бензола с участием боковой цепи: галогенирование, окисление. Окисление алкилбензолов и конденсированных ароматических углеводородов до карбоновых кислот.
•Реакции присоединения (галогенирование, гидрирование, озонолиз), окисление бензола.
Реакции ароматического электрофильного замещения в монозамещенных бензолах
Если в бензольном кольце есть хотя бы один заместитель, реакции SEAr заметно усложняются. Во-первых, имеющийся заместитель может активировать
114
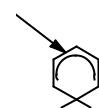
или дезактивировать кольцо к взаимодействию с электрофильной частицей. Вовторых, дизамещенные бензолы могут существовать в виде трех изомеров. Таким образом, при введении второй группы в бензольный цикл надо ответить на два вопроса:
•как идет реакция (легче или труднее в сравнении с незамещенным бензолом);
•куда идет реакция (в орто-, мета- или пара-положение).
Поскольку определяющая стадия реакции – переходное состояние образования σ-комплекса, строение которого не может быть определено, рассмотрим влияние донорных и акцепторных заместителей на стабильность самого σ-комплекса. В соответствии с постулатом Хэммонда все структурные факторы, стабилизирующие σ-комплекс, будут понижать энергию переходного состояния и, следовательно, облегчать реакцию. Соответственно структурные факторы, дестабилизирующие σ-комплекс, будут затруднять реакцию. Любой уже связанный с ароматическим циклом заместитель может быть либо электронодонорным, либо электроноакцепторным. Рассмотрим, как донорные и акцепторные свойства заместителя (независимо от того, за счет индуктивного I или мезомерного эффекта M эти свойства проявляются) будут влиять на устойчивость σ-комплекса.
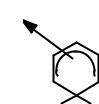
Электронодонорные заместители, отдавая часть своей электронной плотности, увеличивают последнюю в цикле, стабилизируя интермедиат. Следовательно, наличие в цикле доноров облегчает протекание реакции SEAr. Донорные группировки (-OH, -NH2, -NHAlk, -NAlk2, -OR, -NHC(=O)R, Alk, Ar – расположены по степени убывания донорных свойств) называют активирующими.
D
+ стабилизация
HE
Электроноакцепторные заместители уменьшают электронную плотность σ-комплекса, дестабилизируя интермедиат. Таким образом, наличие в цикле акцепторов затрудняет протекание реакции SEAr. Акцепторные группы (-CN, - COOH, -COOR, -CHO, -COR, NO2, -N+R3, SO3H, CCl3, галогены и многие другие) называют дезактивирующими. Следует отметить, что дезактивирующие группы невозможно однозначно расположить в ряд по их дезактивирующему действию.
115
W
+ дестабилизация
HE
Таким образом, все донорные заместители активируют кольцо (облегчают реакцию) в реакциях ароматического электрофильного замещения, а все акцепторные – дезактивируют (затрудняют реакцию). Термины «облегчают» и «затрудняют» используют при сравнении однотипных реакций либо по отношению к незамещенному бензолу, либо в однотипных рядах производных.
Для понимания ориентирующих свойств заместителей используется тот же подход, что и для определения активирующих и дезактивирующих. При анализе строения интермедиата нужно найти структурные факторы, которые его стабилизируют или дестабилизируют. Интуитивно понятно, что донорные заместители будут обладать одними, акцепторные – другими ориентирующими свойствами.
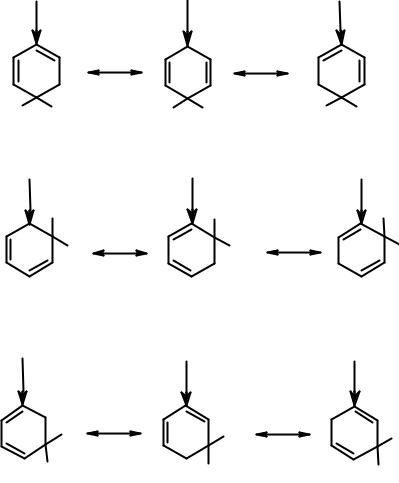
Один из самых простых примеров – свойства алкильных групп, обладающих положительным индуктивным (+I) эффектом. Индуктивный эффект проявляется тем сильнее, чем меньше расстояние. При замещении в орто- или пара-положения среди соответствующих граничных структур есть по одной особенно энергетически выгодной. В них донорная группировка непосредственно связана с углеродом, несущим положительный заряд. В случае замещения в мета-положение такой энергетически выгодной структуры нет. Группировки, обладающие +I эффектом, - орто- и пара-ориентанты.
116
CH3 |
CH3 |
CH3 |
|
|
|
|
+ |
|
пара-замещение |
|
+ |
|
+ |
|
|
|
|
||
H |
E |
H E |
H E |
|
|
|
выгодно |
|
|
CH3 |
CH3 |
CH3 |
|
|
|
E |
E |
E |
|
+ |
H |
H |
H |
орто-замещение |
|
выгодно |
+ |
+ |
|
|
|
|
|
|
CH3 |
CH3 |
CH3 |
|
|
|
+ |
|
+ |
|
|
E |
E |
мета-замещение |
|
|
E |
|||
|
H |
+ H |
H |
|
К аналогичным выводам можно придти при рассмотрении всех других заместителей, обладающих положительным индуктивным эффектом (+I) – доноров.
Рассмотрим свойства группировок, обладающих +М эффектом (способных отдавать электронную плотность за счет эффекта сопряжения) на примере аминогруппы.
При атаке в орто- и пара-положения соответствующие σ-комплексы могут быть изображены с помощью четырех граничных структур. Одна из них энергетически очень выгодна, поскольку она представляет собой не карбониевый, а аммониевый катион. При реакции в мета-положение структуру такого типа написать не удается. Аммониевые катионы очень устойчивы, достаточно вспомнить о существовании большого числа неорганических солей (например, NH4+Cl-), стабильных при комнатной температуре. Кроме того, при оценке стабильности ионов (молекул и свободных радикалов) с использованием граничных структур применяется простое правило: чем больше граничных структур можно написать, тем стабильнее ион (молекула, свободный радикал). Отчетливо видно, что при вхождении электрофила в орто- и пара-положения соответствующие σ-комплексы показаны с помощью
117
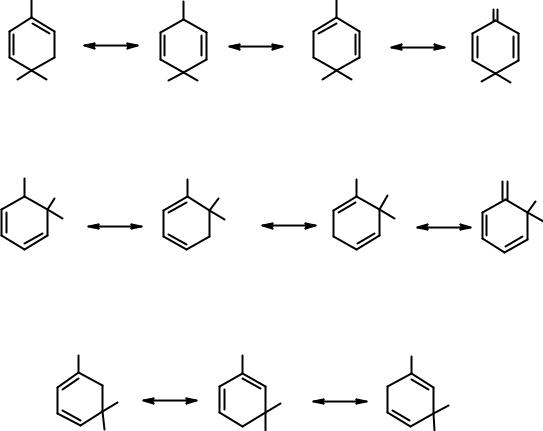
четырех структур, а при реакции в мета-положение граничных структур только три.
Рассмотрение других заместителей, обладающих положительным мезомерным (+М) эффектом, например, OH, OR, NHR, NR2, приводит к аналогичным результатам.
NH2 |
NH2 |
|
NH2 |
|
|
+ |
|
|
|
|
NH2 |
||||
|
|
+ |
|
|
|
|
пара- |
|
+ |
|
|
+ |
|
|
|
|
|
|
|
|
|
||
H E |
H E |
|
H E |
|
H |
E |
|
|
|
|
|
|
|
очень выгодно |
|
NH2 |
|
NH2 |
|
NH2 |
|
|
+ |
E |
|
E |
|
NH2 |
|||
|
E |
|
|
|
E |
||
+ |
H |
H |
|
|
H |
|
H орто- |
|
|
|
|
||||
|
|
+ |
|
+ |
|
|
|
|
|
|
|
|
|
очень выгодно |
|
|
NH2 |
NH2 |
|
|
NH2 |
|
|
|
+ |
|
|
+ |
|
|
|
|
|
E |
E |
|
E |
мета- |
|
|
|
|
|
||||
|
H |
+ H |
|
|
H |
|
|
Таким образом, донорные заместители активируют все положения кольца к реакции ароматического электрофильного замещения, но орто- и пара- положения активированы в большей степени, чем мета-.
Акцепторные заместители (дезактивирующие) направляют входящий заместитель в мета-положение кольца. Доказательство аналогично изложенному выше. При протекании реакции в орто- или пара-положения есть по одной очень богатой энергией граничной структуре. В них акцептор непосредственно связан с атомом углерода, несущим положительный заряд. Как было указано, индуктивный эффект проявляется на небольших расстояниях. В этих граничных структурах акцептор сильнее всего уменьшает электронную плотность на атоме углерода, т.е. еще больше увеличивает на нем положительный заряд. Энергия орто- и пара-σ-комплексов выше, чем у интермедиата реакции, протекающей в мета-положение. В последнем случае нет особенно невыгодных по энергии структур.
118
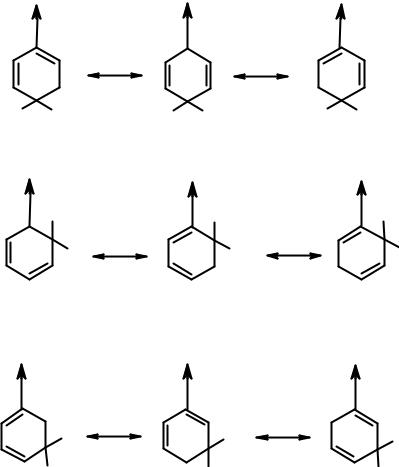
Акцепторные (дезактивирующие) заместители дезактивируют все положения бензольного цикла в реакциях ароматического электрофильного замещения, но мета-положение дезактивировано в меньшей степени, чем орто- и пара-. Следовательно, акцепторы являются мета-ориентантами.
В некоторых изданиях орто-, пара-ориентанты называют ориентантами I рода, мета-ориентанты – ориентантами II рода.
NO2 |
NO2 |
NO2 |
|
|
+ |
|
пара-замещение |
|
+ |
|
+ |
|
|
|
|
||
H |
E |
H E |
H E |
|
|
|
невыгодно |
|
|
NO2 |
NO2 |
NO2 |
|
|
|
E |
E |
E |
|
+ |
H |
H |
H |
орто-замещение |
|
|
+ |
+ |
|
невыгодно |
|
|
|
|
NO2 |
NO2 |
NO2 |
|
|
|
+ |
|
+ |
|
|
E |
E |
мета-замещение |
|
|
E |
|||
|
H |
+ H |
H |
|
Суммируя вышеизложенное:
•активирующие заместители – орто- и пара-ориентанты;
•дезактивирующие заместители – мета-ориентанты.
Все изложенное имеет одно исключение:
Галогены – дезактивирующие заместители, но орто- и пара- ориентанты.
Причина такого поведения галогенов в их двойственной природе. Они проявляют свойства индуктивных акцепторов (-I-эффект) и, одновременно, мезомерных доноров (+М-эффект).
Анализ строения σ-комплексов, образующихся в ходе реакций электрофильного замещения в галогенопроизводных бензола показывает, что
119
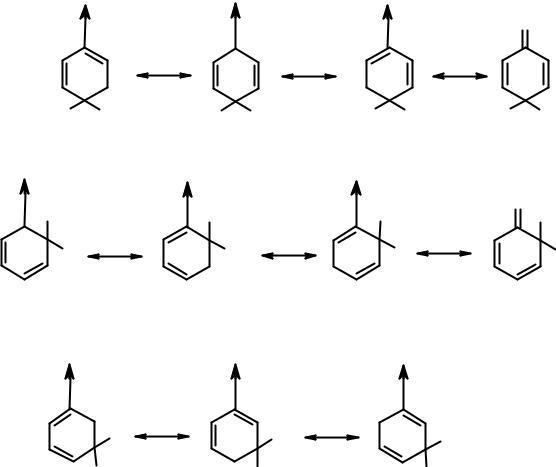
при реакциях в орто- и пара-положения есть по одной энергетически невыгодной граничной структуре, в которых акцепторный атом галогена связан с положительно заряженным углеродом. Кроме того, есть по одной выгодной структуре за счет сопряжения четырех π-электронов цикла с электронной парой атома галогена. При реакциях в мета-положение нет ни особо выгодных, ни особо невыгодных граничных структур. При орто- и пара-замещении интермедиаты могут быть изображены с помощью четырех граничных структур, при мета-замещении – трех. Таким образом, галогены, являясь дезактивирующими заместители, уменьшают реакционную способность всех положений (о-, м- и п-) бензольного цикла, но понижение реакционной способности в орто- и пара-положениях выражено в меньшей степени, чем в
мета-.
|
Cl |
Cl |
Cl |
|
|
|
|
|
|
+ Cl |
|
|
|
+ |
|
|
пара- |
|
+ |
|
+ |
|
|
|
|
|
|
||
|
H E |
H E |
H E |
H E |
|
|
|
невыгодно |
|
очень выгодно |
|
Cl |
|
Cl |
Cl |
|
|
|
E |
E |
E |
+ Cl E |
|
+ |
H |
H |
H |
H |
орто- |
|
|||||
|
|
+ |
+ |
|
|
невыгодно |
|
|
очень выгодно |
|
|
|
Cl |
Cl |
Cl |
|
|
|
+ |
|
+ |
мета-замещение |
|
|
E |
E |
|||
|
E |
||||
|
H |
+ H |
H |
|
|
Реакции ароматического электрофильного замещения в дизамещенных бензолах
При планировании синтеза тризамещенных бензолов следует учитывать ориентирующие свойства каждого из заместителей. Возможно два варианта их совместного действия:
120
