
Organicheskaya_khimia
.pdfФедеральное агентство по образованию Уральский государственный технический университет–УПИ
имени первого Президента России Б.Н.Ельцина
М.Г. Понизовский, Л.И. Русинова
ОРГАНИЧЕСКАЯ ХИМИЯ
Часть 1 Углеводороды
Учебное пособие
Екатеринбург УГТУ-УПИ
2008

УДК 547.99
ББК
П56
Понизовский М.Г. Русинова Л.И.
Рецензенты: кафедра фармации Уральской государственной медицинской академии (д-р фарм. наук А.Ю. Петров); старший научный сотрудник Института органического синтеза УрО РАН канд.хим.наук Г.Л. Левит
П56 Органическая химия: Ч. 1. Углеводороды: учеб. пособие/М.Г.Понизовский, Л.И. Русинова. Екатеринбург: УГТУ―УПИ, 2008. 172 с.
ISBN
Учебное пособие предназначено для организации самостоятельной работы по курсам «Органическая химия и основы биохимии», «Органическая химия и химия биологически активных веществ» студентов II курса ХТФ заочной формы обучения направления 240000 "Химическая технология и биотехнология". Пособие необходимо при подготовке к лекционным, практическим, лабораторным занятиям, промежуточному, итоговому контролю, выполнению домашних заданий и контрольных работ по разделу «Углеводороды». Учебное пособие рекомендовано также для студентов I-III курсов ХТФ, ФСМ, ФТФ, МТФ, РТФ, изучающих дисциплину «Органическая химия».
Библиогр.: 16 назв. Табл. 2. Рис. 31.
|
УДК 547.99 |
|
|
|
|
|
ББК |
|
ISBN |
© УГТУ―УПИ, 2008 |
|
2
ОГЛАВЛЕНИЕ
1.ВВЕДЕНИЕ В КУРС……………………………………………………………4
1.1.Предмет органической химии……………………………………………....4
1.2.Эмпирические, молекулярные и структурные формулы. Изомерия……..5
1.3.Классификация органических веществ…..………………………………...6
1.4.Номенклатура органических веществ….…………………………………...8
1.5.Виды химических связей...……….…………………………………….......10
1.6.Образование молекулярных орбиталей из АО (ЛКАО МО)….….…........12
1.7.Электронная конфигурация и гибридизация углерода
ворганических соединениях……………….………………………………12
1.8.Классификация органических реакций..…………………………………..16
1.9.Энергетические аспекты химических реакций………………………........18
1.10.Равновесные реакции……….……………………………………………..22
1.11.Кинетический и термодинамический контроль….………………….......23
1.12.Кислотно-основные свойства органических соединений…..……….......25
2.АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ …………………………………..29
2.1.Алканы (насыщенные ациклические соединения, парафины)……...……29
2.2.Алкены (олефины, этиленовые углеводороды)…………………………...45
2.3.Алкины (ацетиленовые углеводороды)……………………………………67
2.4.Алкадиены………………………………………………………………...…78
3.АЛИЦИКЛИЧЕСКИЕ И АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ….…93
3.1.Циклоалканы………………………………………………………...………93
3.2.Ароматические углеводороды………………………………………….....103 3.2.1. Бензол и его гомологи……………………………………………….103 3.2.2. Многоядерные ароматические углеводороды и их производные..124
4.КОНТРОЛЬНЫЕ ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ
РАБОТЫ……………………………………………………………………....138
4.1.Как решать задачи по органической химии?.......................................138
4.2.Примеры решения задач………………………………………………140
4.3.Варианты заданий……………………………………………………..148
5.РАБОЧАЯ ПРОГРАММА ДИСЦИПЛИНЫ……………………………...166
Библиографический список …………………………………………………...171
3

1.ВВЕДЕНИЕ В КУРС
•Предмет органической химии. Причины ее выделения в самостоятельную науку и основные этапы развития. Теория строения и ее роль в развитии органического синтеза.
•Эмпирические, молекулярные и структурные формулы. Изомерия. Изомеры строения. Гомологические ряды. Основные функциональные группы и классы органических соединений.
•Основные принципы номенклатуры органических веществ. Заместительная номенклатура, IUPAC. Основные правила составления названий органических соединений.
1.1.Предмет органической химии
Впервые понятие органическая химия ввел шведский химик Берцелиус в 1808 г. Он считал, что различие между неорганическими и органическими веществами состоит в том, что первые могут быть получены в лаборатории обычными препаративными методами, тогда как вторые могут образовываться исключительно в результате процессов жизнедеятельности.
В 1828 г. немецкий химик Ф. Вёлер осуществил превращение неорганического вещества циановокислого аммония в хорошо известное органическое соединение – мочевину:
O NH4CNO 


H2N NH2
Открытие Ф. Вёлером органического синтеза стало мощнейшим толчком к развитию органической химии во второй половине XIX века. А. Кекуле и А.Купер независимо друг от друга открыли четырехвалентность углерода. Купер обратил внимание на способность атомов углерода образовывать цепи и предложил использовать формулы, в которых символы атомов связаны валентными черточками. В 1861 г. А.М. Бутлеров выдвинул теорию, согласно которой свойства вещества обусловлены природой, числом составляющих его атомов и способом их связывания друг с другом. Это было названо Бутлеровым химическим строением вещества. Кроме того, Бутлеров утверждал, что изучение свойств веществ позволит установить их строение, а знание строения позволит прогнозировать свойства. В 1874 г. одновременно Вант-Гофф и ЛеБель предположили, что некоторые явления могут быть объяснены пространственной ориентацией валентностей атома углерода. Согласно ВантГоффу, четыре валентности углерода идентичны и направлены к вершинам правильного тетраэдра, в центре которого находится атом углерода.
Среди элементов, входящих вместе с углеродом в состав органических веществ, исключительная роль принадлежит водороду, поскольку число органических соединений, не содержащих ни одного водородного атома, чрезвы-
4
чайно мало в сравнении с общим числом известных сегодня химикам-органи- кам веществ.
Набор свойств, определяющих уникальную природу органических соединений, принадлежит не углероду или водороду в отдельности, а веществам, образованным этими двумя элементами – гидридам углерода, или углеводородам. Углеводороды являются основой классификации органических веществ, поскольку все органические соединения можно считать производными углеводородов, образующимися при замещении атомов водорода атомами других элементов. Поэтому органическая химия – химия углеводородов и их производных (К. Шорлеммер, 1889 г.).
Сам термин «органическая» сохраняет силу в связи с тем, что химия углеводородов и их производных более важна для жизни, чем химия любых других элементов.
1.2. Эмпирические, молекулярные и структурные формулы. Изомерия
Объектом изучения химии являются индивидуальные соединения, т.е. вещества, состоящие из одинаковых молекул. В простейшем случае вещество считается чистым, если его температура плавления (для твердого) или температура кипения (для жидкости) не меняются.
Эмпирическая формула – химическая формула, отражающая качественный состав с указанием относительного количества атомов каждого элемента во всем образце (не в одной молекуле) с помощью целых чисел, не имеющих общего кратного. Например, СН – эмпирическая формула бензола.
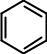
Молекулярная формула (брутто-формула) показывает качественный и количественный составы молекулы. Молекулярная формула может быть тождественна эмпирической или быть ее целым кратным. С6Н6 – молекулярная формула бензола.
Структурная формула показывает взаимное расположение атомов и функциональных групп в молекуле. Структурная формула бензола
Изомеры (isos – тот же, meros – часть) – вещества, имеющие одинаковую молекулярную формулу, но различающиеся по строению. Явление изомерии обусловлено существованием молекул, имеющих одинаковый качественный и количественный составы, но обладающих различными физическими и химическими свойствами из-за различного расположения атомов или функциональных групп или их ориентации в пространстве.
Структурная изомерия – два или более соединения, имеющие одну молекулярную формулу, отличающиеся между собой:
5
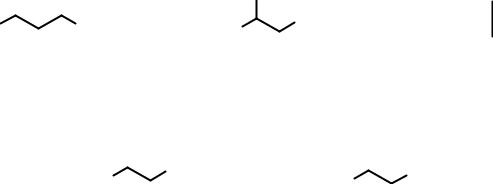
• строением углеродного скелета, например для С5Н12:
|
|
CH3 |
|
CH3 |
||
H3C |
CH3 |
|
CH3 |
H3C |
|
CH3 |
|
|
|||||
H3C |
|
CH3 |
||||
|
|
|
|
|
||
|
пентан |
2-метилбутан |
2,3-диметилпропан |
|||
•различным расположением одинаковых функциональных групп (при одинаковом углеродном скелете):
|
OH |
|
CH2OH |
|
CH3 |
|
||
H3C |
H3C |
|
бутанол-1 |
бутанол-2 |
|
Другие виды изомерии будут рассмотрены в дальнейшем.
Гомологический ряд – ряд соединений, в котором каждый член отличается от предыдущего на одинаковую структурную единицу (гомологическую разность). Гомологи – члены гомологического ряда.
1.3. Классификация органических веществ
Основа классификации органических соединений – теория строения. Все органические вещества, содержащие разные радикалы R (где R – органический остаток) и одинаковые функциональные группы, могут быть разделены на соответствующие классы. Это позволяет классифицировать вещества по их химическим и физическим свойствам, характерным для определенного строения.
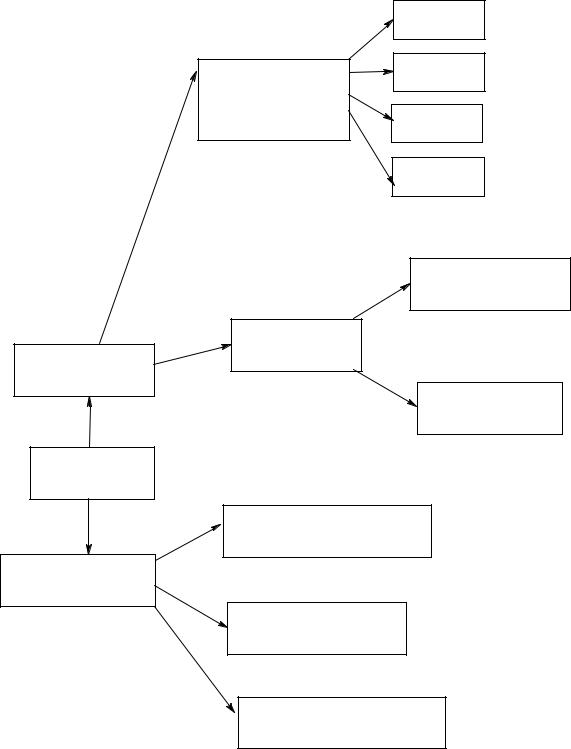
Безграничное разнообразие органических соединений не позволяет привести полную их классификацию, поэтому на рис. 1 приведен лишь ее фрагмент. Важнейшие функциональные производные органических веществ приведены в табл. 1.
6
|
Алканы |
CnH2n+2 |
Алифатические |
Алкены |
CnH2n |
(открытоцепные) |
|
|
углеводороды |
Алкины |
CnH2n-2 |
|
||
|
Диены |
CnH2n-2 |
|
|
Алициклические |
|
|
углеводороды |
|
Циклические |
|
Углеводороды |
углеводороды |
|
|
|
|
|
|
Ароматические |
|
|
углеводороды |
Органические |
|
|
соединения |
|
|
|
Монофункциональные |
CnHm-1FG |
|
производные |
|
|
|
|
Функциональные |
|
|
производные |
|
|
|
Бифункциональные |
CnHm-2FG1FG2 |
|
производные |
|
|
|
Полифункциональные |
CnHm-iFG1FG2...FGi |
производные |
Рис. 1. Классификация органических веществ
7
Таблица 1 Важнейшие функциональные производные органических веществ
Функциональная |
Класс |
|
Функциональная |
Класс |
группа |
соединений |
|
группа |
соединений |
|
|
|
||
R-F, Cl, Br, I |
Галогенопроизводные |
R-C(O)NH2 |
Амиды |
|
R-OH, Ar-OH |
Спирты и фенолы |
R-NO |
Нитрозосоединения |
|
R-O-R’ |
Простые |
эфиры, |
R-NO2 |
Нитросоединения |
|
оксираны |
|
|
|
R-SH |
Тиолы (тиоспирты) |
R-NH2, RR’NH, |
Амины |
|
|
|
|
RR’R’’N |
|
R-S-R’ |
Сульфиды |
|
-N=N- |
Азосоединения |
R-CHO |
Альдегиды |
|
-NH-NH- |
Гидразосоединения |
R-C(O)-R’ |
Кетоны |
|
-N=N+ |
Диазосоединения |
|
|
|
|
(соли диазония) |
R-COOH |
Карбоновые кислоты |
R-SO2OH |
Сульфоновые |
|
|
|
|
|
кислоты |
R-C(O)OR’ |
Сложные эфиры |
-O-, -S-, -NH-, |
Гетероциклические |
|
|
|
|
-N= в цикле |
соединения |
|
|
|
|
|
1.4. Номенклатура органических веществ
Химическая номенклатура – система, описывающая строение и пространственное расположение атомов в молекуле.
Систематическое название – составленное в полном соответствии с принятыми номенклатурными правилами (рис. 2). В настоящее время наиболее распространенная и универсальная номенклатура IUPAC (International Union of Pure and Applied Chemistry):
8

Название вещества
Префикс(ы) |
Базовое название |
Суффикс |
|
|
|
Углеводородные радикалы и |
Главная цепь |
Главная |
не главные характеристичес- |
или основной |
характеристическая |
кие группы |
цикл |
группа |
|
|
|
Базовое название – часть, на которой строится название в целом.
Заместитель – атом или функциональная группа, занимающая место водорода в исходном соединении.
Характеристическая группа – функциональная группа.
Главная группа – та, наличие которой указывает суффикс. Старшинство главных групп убывает в следующем ряду:
карбоновые кислоты > сульфоновые кислоты > сложные эфиры > амиды > нитрилы > альдегиды > кетоны > спирты и фенолы > тиолы > амины > имины
Локант – цифра или буква, которая указывает положение функциональной группы в молекуле.
Число одинаковых заместителей в молекуле указывают приставками ди-, три- и т.п. – умножающими префиксами.
Для того чтобы назвать вещество, необходимо выполнить следующую последовательность действий:
1.Определить главную характеристическую группу (ряд старшинства – см. выше).
2.Определить базовую структуру – найти главную углеродную цепь или цикл. Базовая структура должна соответствовать следующим требованиям:
•включать максимальное число главных групп;
•наибольшее количество кратных связей;
•состоять из максимального числа углеродных атомов;
•иметь наибольшее число заместителей.
3.Назвать базовую структуру с учетом главной группы.
4.Определить и назвать заместители.
5.Пронумеровать атомы углерода базовой структуры так, чтобы главная группа получила наименьший номер. Если однозначный выбор сделать
9

не удается, используют правило наименьших локантов. Базовую структуру нумеруют таким образом, чтобы заместители имели наименьшие номера. Из возможных последовательностей локантов правильная та, в которой раньше встретится меньшая цифра (1,3,6- меньше, чем 1,4,5-);
6.Объединить сделанное выше, создав полное название, перечисляя префиксы в алфавитном порядке.
Пример:
6 |
5 |
4 |
3 |
2 |
|
1 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
||
H3C |
|
|
|
|
CH3 |
H C |
|
|
|
CH |
|
||||
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
H3C |
CH3 |
|||
|
|
|
|
CH |
3 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2-Метилгексан |
|
|
2,2-Диметилгептан |
||||||||||||
Номенклатура IUPAC конкретных классов органических веществ будет подробно рассмотрена в соответствующих разделах курса.
•Виды связей в органических соединениях. Волновое уравнение, волновая функция, атомные орбитали и их типы. Природа ковалентных связей. Типы молекулярных орбиталей.
•Электронная конфигурация и гибридизация углерода в органических соединениях. σ- и π-связи в органических соединениях, их
характеристики: энергия, длина, полярность, поляризуемость.
1.5. Виды химических связей
Известно несколько видов химических связей: ионная, ковалентная, металлическая, водородная. Органические соединения образованы почти исключительно за счет ковалентных связей.
Движение электрона в зависимости от его энергии описывается
уравнением Э. Шрёдингера (1926) |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-h2 |
|
|
∂2ψ |
∂2ψ |
∂2ψ |
|
|
||||
|
|
|
|
|
|
+ |
|
+ |
|
|
+ U ψ = E ψ , |
(1) |
|
8π2m |
|
|
∂x2 |
∂y2 |
∂z2 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
где m – масса электрона; h – постоянная Планка; U – потенциальная энергия системы; Е – полная энергия системы; x,y,z – координаты; ψ – волновая функция.
10
