
- •Перевозка сжиженных газов морем
- •Оглавление
- •Основы химии газов строение атома. Периодическая таблица элементов
- •Масса атома
- •Закон авогадро
- •Классификация углеводородов
- •Основные химические свойства углеводородов полимеризация
- •Полимер
- •- (СнсНз-сн2)n –
- •Катализаторы
- •Ингибиторы
- •Пахучие вещества
- •Реакция углеводородов с водой - образование гидратов (slush)
- •Химическая совместимость газов
- •Неорганические газы
- •Транспортные характеристики газов общие положения
- •Основные группы газов, перевозимых морем
- •Химические грузы
- •Основные физические свойства газов
- •Воздействие низких температур (brittle fracture)
- •Переворачивание груза (rollover)
- •Статическое электричество
- •Основные опасности на танкерах и газовозах статическое электричество на танкерах и газовозах
- •IBce переносное оборудование, которое используется при работе в танках, должно быть надежно заземлено перед тем, как опускать его в танк или использовать в опасных зонах.
- •Способы уменьшения возникновения статических зарядов
- •Пожароопасность
- •Воспламеняемость
- •Классификация опасных грузов
- •Токсичность сжиженных газов и сопутствующих веществ
- •Предельно допустимая концентрация
- •Классификация токсинов
- •Пути проникновения токсинов в организм
- •Побочные опасности
- •Приборы контроля атмосферы танков типы приборов контроля атмосферы
- •Приборы для измерения взрывоопасных концентраций газов
- •Эксплозиметры
- •Интерферометр
- •Анализаторы содержания кислорода
- •Приборы и устройства для измерения концентрации токсичных газов
- •Перевод концентраций, выраженных в мг/м3, в ррм осуществляется следующим образом:
- •Молярная масса (г)
- •Перевод объемных концентраций, выраженных в ррм, в весовые осуществляется следующим образом:
- •Молярный объем (24,1 л)
- •Приборы для измерения точки росы
- •Состав сухого воздуха, %
- •Типы газовозов типы и группы газовозов
- •Газовозы напорного типа
- •Газовозы полунапорного типа
- •Газовозы-химовозы
- •Суда рефрижераторного типа
- •Суда для перевозки природного газа - метановозы
- •Конструктивные особенности газовозов
- •Защита грузовых емкостей от повреждений
- •Материал, используемый для изготовления танков
- •Изоляция грузовых танков
- •Основные системы газовозов
- •Специальные системы газовозов
- •Оборудование. Инструменты
- •Основы термодинамики сжиженных газов идеальный газ
- •Основы термодинамики
- •Расчет температуры смеси жидкой фазы груза
- •Взаимные превращения жидкостей и газов
- •Работа при изменении объема газа
- •Энтропия
- •Теплопроводность
- •Расчет изоляции грузовых танков
- •Диаграмма молье
- •Установки повторного сжижения газов принципы искусственного охлаждения
- •Циклы упсг
- •Каскадная упсг
- •Насосы грузовых систем газовозов основные понятия и определения
- •Математические основы расчета рабочих параметров насосов
- •Типы насосов грузовых систем газовозов
- •Напорные характеристики насосов
- •Напорные характеристики трубопроводов
- •Работа центробежных насосов в составе трубопроводов
- •Особенности действия грузовых насосов
- •Меры предосторожности при эксплуатации грузовых систем
- •Меры безопасности на газовозах общие принципы обеспечения безопасности на газовозах
- •Конструктивное обеспечение пожарной безопасности
- •1. Оборудование конструктивно безопасного типа исключает искрообразование в процессе его нормальной эксплуатация и питается от сетей пониженного напряжения.
- •Оборудование газовоза активными средствами пожаротушения
- •Системы обнаружения пожаров
- •Переносные средства пожаротушения
- •Дыхательные аппараты
- •Организационные мероприятия по обеспечению пожаробезопасности
- •Меры безопасности при выполнении судовых работ
- •Разрешение на выполнение «горячих» работ
- •Раздел 1.
- •Раздел 2.
- •Раздел 3.
- •Комментарии к «Разрешению на выполнение горячих работ»
- •Раздел 1.
- •Раздел 2.
- •Разрешение на выполнение холодных работ
- •Раздел 2.
- •Раздел 3.
- •Комментарии к «Разрешению на выполнение холодных работ»
- •Меры безопасности при выполнении судовых работ
- •Раздел 1.
- •Раздел 2.
- •Раздел 3.
- •Раздел 4. Записи о вошедших (подлежит заполнению лицом, контролирующим вход)
- •Раздел 5. Завершение работы (подлежит заполнению лицом, контролирующим вход)
- •Грузовые операции основные этапы обработки груза на борту судна
- •Расчет времени на погрузку
- •Выгрузка
- •Специальные правила
- •Замеры и подсчет груза. Грузовая документация общие положения
- •Особенности подсчета груза на газовозах
- •Плотность груза
- •Стандартные способы подсчета груза
- •Общие правила определения веса груза
- •Расчет газовой фазы груза
- •Перевод процентных соотношений смесей в весовые или объёмные соотношения, и наоборот
- •Подсчет линейной скорости потока жидкости
- •Грузовая документация
- •Методы замены атмосферы танка
- •Метод разбавления атмосферы (dilution method)
- •II Повторный запуск всего оборудования — дело долгое и хлопотное.
- •Организация процесса замены атмосферы танков
- •Смена груза и условия предъявления судна под погрузку
- •Мойка танков
- •Заключительная обработка поверхности танка
- •Аварийные мероприятия на газовозах аварийное планирование
- •Организация борьбы с пожарами
- •Инциденты с грузом
- •Операции с грузом
- •Подвижка судна у причала
- •Посадка на мель
- •Касание грунта
- •Столкновение
- •Аварийная перекачка груза с судна на судно
- •Подготовка экипажа к оставлению судна
- •Словарь терминов общепринятые сокращения
- •Приложения
- •Спецификации сюрвейерской компании sgs на некоторые сжиженные химические газы (можно использовать только как справочные данные)
- •Сжиженные и химические газы, включенные в igc кодекс
Основы химии газов строение атома. Периодическая таблица элементов
Согласно современным представлениям, все вещества, находящиеся в жидком или парообразном состоянии, имеют молекулярную структуру. В твердом виде только органические вещества состоят из молекул, как и некоторые неметаллы, оксиды углерода и вода. Строение же большинства твердых неорганических веществ определяется решеткой, состоящей из атомов и ионов, образующих макротела — кристаллы. Молекулярной структуры не имеют соли, оксиды металлов, кремний, алмаз, металлы и т. д.
Химические связи между молекулами менее прочные, чем между атомами, и поэтому температуры плавления и кипения веществ с молекулярной структурой сравнительно низкие. Современная химия изучает свойства микрочастиц (молекул, атомов, ионов) и макротел.
Из школьного курса физики известно, что вокруг положительно заряженного ядра атома движутся электроны, имеющие единичный отрицательный заряд. В целом атом электрически нейтрален, следовательно число электронов, движущихся вокруг ядра атома, должно быть равно заряду ядра атома (рис. 1).
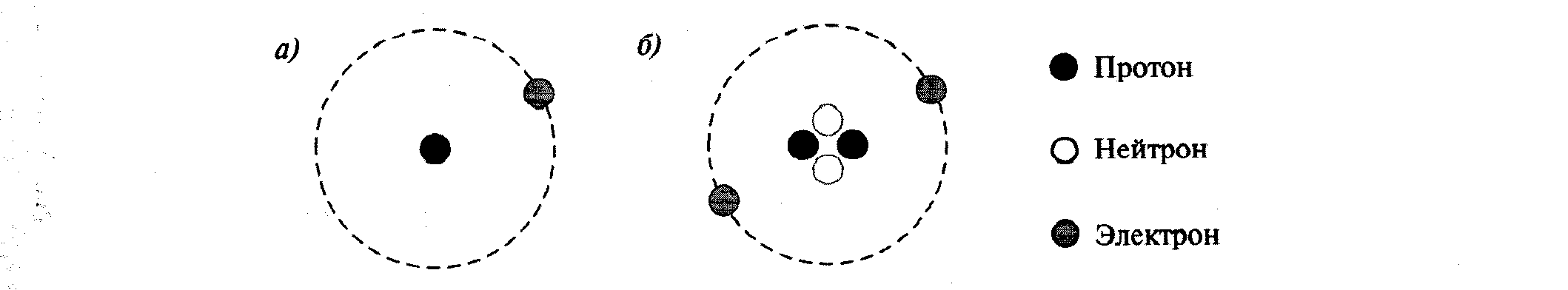
Рис. 1. Структура атома водорода (о) и гелия (б)
Ядро атома состоит из протонов (частицы с массой 1 и зарядом +1). Поскольку масса атомов, кроме атома водорода, всегда больше той массы, которая приходится на долю протонов, было естественно предположить, что в состав ядра входят и электрически нейтральные частицы с массой 1, впоследствии названные нейтронами.
Было установлено, что свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атомов этих элементов.
!В Периодической таблице элементов порядковый номер элемента совпадает с зарядом ядра его атома.
Электроны в атомах обладают различным запасом энергии, и в зависимости от величины этой энергии они располагаются на различных энергетических уровнях или орбитах относительно ядра атома.
На первом энергетическом уровне может быть не более 2 электронов, а внешней орбите может быть расположено не более 8 электронов. Заряд атомного ядра (порядковый номер) определяет химические свойства элемента.
Количество электронов на внешнем энергетическом уровне определяет валентность элемента (его химическую активность), поэтому они называются валентными электронами.
Сущность явления периодичности объясняется тем, что с возрастанием заряда ядра атома элементов наблюдается периодическая повторяемость элементов с одинаковым числом валентных электронов. Это определяет периодическую повторяемость свойств химических элементов и их соединений.
В вертикальных колонках периодической таблицы (рис. 2) расположены группы элементов, имеющих одинаковое количество электронов на внешней орбите (определяющих валентность элемента). Всего в таблице восемь основных групп элементов.
Периодическая таблица имеет также семь горизонтальных строк — периодов, поскольку каждый атом не может иметь более семи электронных орбит. Можно сказать, что количество электронных орбит определяет энергетический уровень электронов.
Когда два или более атомов объединяются между собой, образуется молекула вещества.
Если два атома имеют одну или несколько пар электронов, являющихся общими для них, т. е. электроны перескакивают с орбиты одного атома на орбиту другого, возникает так называемая ковалентная связь. Основную часть неорганических элементов составляют металлы, они формируют металлические связи между атомами. При этом атомы располагаются очень близко друг к другу и образуют структурную (кристаллическую) решетку, В правой части периодической таблицы элементов расположены инертные газы, которые существуют только в виде атомов.
