
- •Современные проблемы биологии
- •Содержание
- •Модуль 1. Проблемы современной генетики и смежных наук
- •Введение
- •Модуль 1. Проблемы современной генетики и смежных наук Тема № 1: Особенности развития биологии на современном этапе
- •1. Общая характеристика современной биологии
- •2. Методы и методология современной биологии
- •3. Основные концепции современной биологии
- •4. Основные направления современных биологических исследований
- •Список источников
- •Тема № 2. Проблемы генетической инженерии
- •1. Краткая история генетической инженерии
- •2. Генная и геномная инженерия
- •3. Генетическая инженерия микробиологических систем
- •4. Методология генной инженерии растений
- •5. Достижения генной инженерии растений
- •6. «Плюсы» и «минусы» генетически модифицированных организмов
- •Список источников
- •Тема № 3. Клонирование и трансгеноз животных
- •1. История клонирования животных
- •2. Проблемы в клонировании животных
- •3. Достижения в области клонирования животных
- •4. Трансгеноз животных
- •5. Трансгенные животные и моделирование заболеваний человека
- •Список источников
- •Тема № 4. Современные методы исследования генома
- •1. Классический подход к расшифровке последовательностей днк
- •4. Использование методов биоинформатики в секвенировании
- •5. История прочтения генома человека
- •Зачем учёным тысячи геномов?
- •Список источников
- •Тема № 5. Геномика и медицина
- •1. Ключевые открытия, сделанные в результате анализа генома человека
- •2. Практическая польза знания последовательности генома человека для медицины
- •3. Классификация наследственных заболеваний человека
- •4. Биохимические и молекулярно-генетические методы диагностики наследственных болезней
- •Виды молекулярно-генетической диагностики
- •Методы исследования днк
- •5. Персонализированная медицина. Фармакогенетика. Фармакогеномика
- •6. Генетический паспорт
- •7. Геномная дактилоскопия
- •8. Генотерапия
- •Список источников
- •Тема № 6. Этногеномика и геногеография
- •1.Основные подходы к днк-анализу в популяционных исследованиях
- •2. Африканское происхождение человека современного типа
- •3. Использование анализа днк для изучения истории этносов
- •4. Этногеномика и геногеография Восточно-Европейского региона
- •5. Особенности русского генофонда
- •Список источников
- •Тема № 7. Рнк – интерференция
- •1. Короткие интерферирующие рнк и механизм рнк-интерференции
- •3. Функции и эволюция микроРнк
- •4. Строение, функции и эволюция пиРнк
- •Тема № 8. Генетика индивидуального развития
- •1. Ооплазматическая сегрегация и полярная плазма
- •2. Формирование градиентов в яйцеклетке
- •3. Гены сегментации
- •4. Гомеозисные гены, их роль в развитии
- •5. Гипотеза э. Льюиса о механизме функционирования гомеозисных генов
- •6. Гомеобокс и гомеодомен. Принцип коллинеарности
- •7. Гены — господа и гены — рабы. Опыты Вальтера Геринга
- •Список источников
- •610000, Г. Киров, ул. Московская, 36, тел.: (8332) 64-23-56, http://vyatsu.Ru
5. Персонализированная медицина. Фармакогенетика. Фармакогеномика
Цель персонализированной медицины состоит в том, чтобы найти конкретное лекарство для конкретного больного, разработать схему лечения больного в соответствии с его генотипом и обосновать меры профилактики. В более широком смысле персонализированная медицина представляет собой интегральную медицину, которая включает разработку персонализированных средств лечения на основе геномики, тестирование на предрасположенность к болезням, профилактику, объединение диагностики с лечением и мониторинг лечения.
Термин «personalized medicine» впервые появился в качестве названия монографии, изданной Кеваль Джайн (Швейцария) в 1998 г. Наряду с понятием «персонализированная медицина» (personalized medicine), для обозначения индивидуализации лечения применяют и другие термины, в том числе «предсказательная медицина» (predictive medicine) и «геномная медицина» (genomic medicine). Еще до того как предметом внимания в медицине стала концепция персонализации, индивидуальный подход применялся, например, при переливании крови, трансплантации тканей и клеточной терапии. Типирование тканей на основе генетических маркеров применяется при подборе трансплантатов для конкретных реципиентов, а в некоторых способах лечения рака используются собственные опухолевые клетки пациента.
В настоящее время концепция персонализации распространяется на все фармацевтические препараты. Стало ясно, что реакция пациентов с одной и той же болезнью на одно и то же лекарство различается в зависимости от генотипа больного (генетической конституции организма), так что возможны значительные колебания в эффективности и безопасности препарата, применяемого для лечения определенного заболевания.
Индивидуализация лечения подразумевает также досимптоматическую идентификацию предрасположенности к той или иной болезни и выбор адекватных профилактических мер.
Важную часть основ персонализированной медицины составляют шесть технологий и подходов: (I) молекулярная диагностика, в особенности определение полиморфизма по единичным нуклеотидам (SNP), (II) интеграция диагностики и лечения, (III) мониторинг лечения, (IV) фармакогенетика, (V) фармакогеномика и (VI) фармакопротеомика. Первые три составляющие известны хорошо. Но существуют некоторые различия во мнениях о сути трех последних, которые можно определить следующим образом.
Фармакогенетика — это исследование влияния генетических факторов на действие лекарств; данный термин был принят в фармакологии еще в догеномную эру. Фармакогеномика — это применение геномики для разработки новых лекарств. Она включает исследование механизмов действия лекарств на клетки на основе изучения изменений экспрессии генов. Фармакопротеомика — это применение протеомики к разработке новых лекарств, её можно рассматривать как расширение фармакогеномики.
Концептуальную основу предиктивной медицины составляют представления о генетическом полиморфизме.
Генетический полиморфизм и гены предрасположенности. В отличие от мутаций, приводящих к патологическим изменениям и снижающих жизнеспособность, генетические полиморфизмы проявляются в фенотипе менее очевидно. Вместе с тем генетические полиморфизмы далеко не всегда являются нейтральными, значительно чаще они приводят к появлению белковых продуктов с несколько измененными физико-химическими свойствами и, соответственно, параметрами функциональной активности. Известно, что однонуклеотидные замены (SNP) в смысловых частях гена часто влияют на такие характеристики как изменение третичной структуры белка, стабильность его связывания с субстратом и промежуточными метаболитами, посттрансляционную модификацию, температурный оптимум активности и пр. Некоторые миссенс - мутации оказывают сильное влияние на гидрофобность белка, его водородные, электростатические и сульфгидрильные связи. При этом функциональный спектр таких белков может сильно меняться от практически нейтрального эффекта генетического полиморфизма до полного нарушения функции соответствующего белкового продукта.
В определенных условиях некоторые генетические полиморфизмы могут предрасполагать либо, наоборот, препятствовать проявлению различных заболеваний. Гены предрасположенности — это мутантные гены (аллели), которые совместимы с рождением и жизнью в постнатальном периоде, но при определенных неблагоприятных условиях способствуют развитию того или иного заболевания.
В зависимости от особенностей действия и роли в метаболических процессах гены «предрасположенности» условно подразделяют на гены «внешней среды», гены - «триггеры» и гены клеточных рецепторов. Именно аллельные варианты этих генов составляют основу таких частых заболеваний как атеросклероз, ишемическая болезнь сердца (ИБС), остеопороз, диабет, бронхиальная астма, опухоли и пр. Сочетания аллельных вариантов различных генов, вовлеченных в развитие каждой конкретной патологии, получили название «генных сетей». В каждой из таких сетей выделяют главные (центральные) гены, и дополнительные (вспомогательные) гены, называемые также генами-модификаторами.
Составление генной сети для каждого мультифакториального заболевания, идентификация в ней центральных генов и генов-модификаторов, анализ ассоциации их полиморфизмов с конкретным заболеванием, разработка на этой основе комплекса профилактических мероприятий для конкретного пациента составляют основу предиктивной (предсказательной) медицины.
В настоящее время в клинической практике применяются около 150—200 генетических тестов и разработаны панели генетических тестов для многих наиболее частых мультифакториальных болезней.
Гены внешней среды (гены детоксикации). Гены детоксикации кодируют разнообразные ферменты, ответственные за метаболизм, деграда-цию, детоксикацию и выведение ксенобиотиков.
Именно эти гены, точнее их полиморфные варианты, определяют индивидуальные особенности реакции организма на различные химические препараты и пищевые продукты. Генетические полиморфизмы, приводящие к полному отсутствию соответствующего белка, либо к появлению ферментов с измененной, как правило, более низкой, чем в норме, активностью, и являются причиной выраженной индивидуальной вариабельности реакций организма на лекарственные препараты, промышленные загрязнения, гербициды и пр.
Большинство ксенобиотиков, попадая в организм, не оказывают прямого биологического эффекта, но подвергаются различным превращениям, так называемой биотрансформации, которая является трехэтапным процессом, включающим активацию (фаза 1), детоксикацию (фаза 2) и выведение (фаза 3) (рис.7). Гены, кодирующие ферменты биотрансформации, характеризуются значительным полиморфизмом и обнаруживают существенные популяционные, этнические и расовые вариации, связанные с исторически сложившимися традициями, различиями продуктов питания, географической среды обитания, эпидемиями и пр. Типичными представителями фазы 1 являются гены системы цитохромов, фазы 2 — гены семейства трансфераз. Некоторые из этих генов и их полиморфизмы приведены в табл. 1.
Высокая активность различных цитохромов (фаза 1) в сочетании с низкой или нормальной активностью ферментов фазы 2 является наиболее неблагоприятным вариантом, при этом риск развития заболевания или патологического состояния резко возрастает.
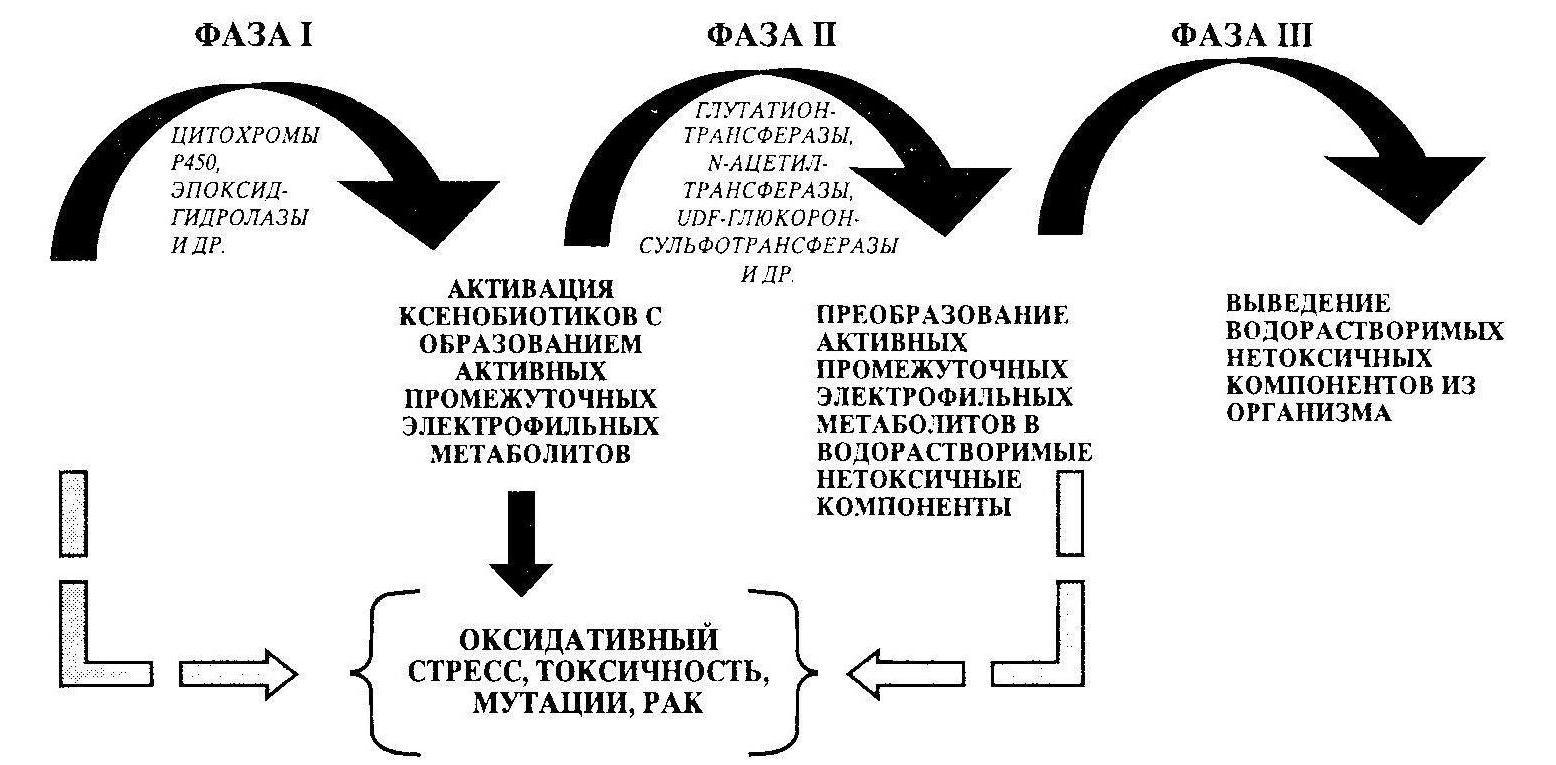
Рисунок 7-Основные фазы детоксикации [1]
Так, высокая активность ферментов фазы I детоксикации (CYP1A1, CYP1A2, CYP1 Bl, CYP3A4, CYP2A6) предрасполагает к раку легких (особенно у курящих индивидуумов), а также к раку мочевого пузыря и толстого кишечника. Повышенная активность CYP1A2 может быть индуцирована табачным дымом, пережаренным мясом, некоторыми лекарствами (полибромидные бифенилы), а также диоксином. При некоторых вирусных заболеваниях также происходит повышение активности этого цитохрома. Столь же пагубные последствия для здоровья могут иметь и патологические аллели генов эпоксидгидролаз (фаза 1). Так, отмечено, что лица, гомозиготные по «медленной» форме микросомальной эпоксидгидролазы (тЕРХН), составляющие до 6% населения России, обнаруживают высокую чувствительность к действию табачного дыма, различных оксидантов, ксенобиотиков с повышенной продукцией свободных радикалов. У них чаще, чем в популяции, встречаются заболевания легких, в том числе эмфизема, хронические обструктивные пневмонии, а при наличии мутаций в гене CFTR заболевание муковисцидозом протекает особенно неблагоприятно.
Неполноценный (нулевой) аллель глутатион-5-трансферазы (GSTM1), не случайно ассоциирован с раком легких, хроническим обструктивным бронхитом, раком мочевого пузыря и даже с таким частым мультифакториальным заболеванием как эндометриоз. На фоне алкоголизма у гомозигот GSTM10/0 чаще развивается цирроз печени. Имеются многочисленные данные о предрасположенности лиц, гомозиготных по «ослабленному» аллелю гена GSTP1 к различным опухолям, в том числе к раку кожи, а также к болезни Паркинсона.
Таблица 1 – Гены детоксикации
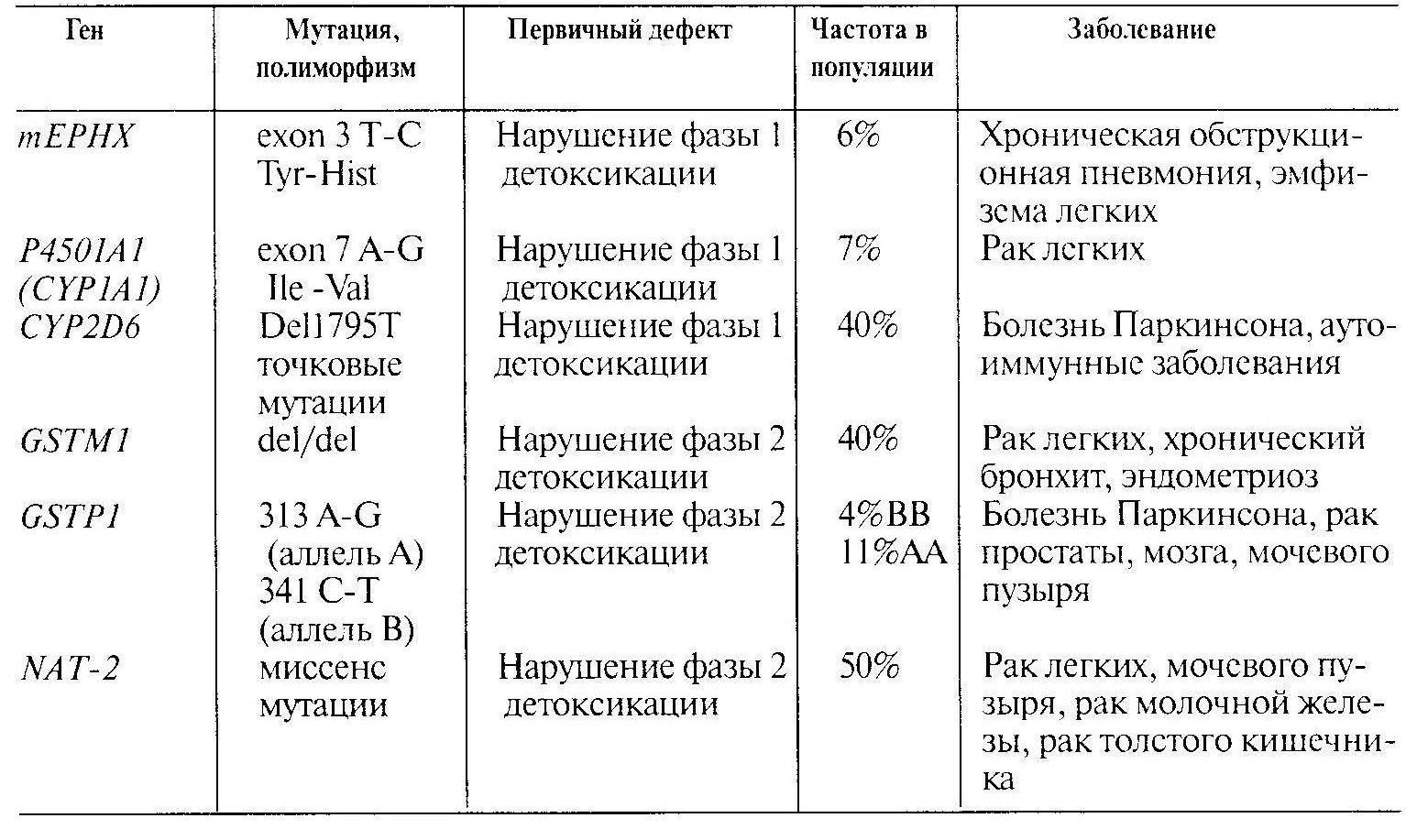
Генетический полиморфизм гена NAТ-2, ответственного за синтез фермента N-ацетилтрансферазы 2, может существенно влиять на возникновение рака молочной железы. Этот эффект находится в прямой зависимости от курения. У женщин, гомозиготных по медленному аллелю этого гена (медленные «ацетиляторы»), курение увеличивает почти в 20 раз риск развития рака молочной железы. В то же время у курящих женщин, относящихся к группе быстрых «ацетиляторов», такой закономерности не отмечается.
Таким образом, по крайней мере, некоторые аллели генов «внешней среды» ассоциированы, а возможно, и непосредственно вовлечены в возникновение ряда онкологических и иных заболеваний.
Гены мембранных рецепторов. Поступление ксенобиотиков в организм, равно как и всякие межклеточные взаимодействия регулируются рецепторным аппаратом клеточных мембран. Для многих генов рецепторных белков показано наличие полиморфизмов, а для некоторых доказано неблагоприятное фенотипическое проявление некоторых аллельных вариантов. В частности, функционально ослабленный аллель гена рецептора витамина D3 (VDR3) может предрасполагать к остеопорозу — заболеванию, возникающему при снижении минеральной плотности костей и приводящему к увеличению вероятности переломов. Аллели с низким числом CAG повторов в гене адренорецептора (AR) ассоциированы с раком предстательной железы. Тестирование мужчин по данному полиморфизму полезно для выявления лиц с генетической предрасположенностью к раку простаты задолго до начала заболевания, что позволяет более рационально организовать его профилактику.
Делеция 32-х нуклеотидов в гене CCR5, ответственном за синтез кофактора рецептора CD4 (рецептор CD4 служит основным входом для штаммов вируса ВИЧ-1 в клетки макрофагов и моноцитов), приводит к возникновению мутантного белка с несколько измененными функциями. Белок, несущий делецию, приводит к существенному затруднению проникновения патогенного вируса иммунодефицита человека в клетки у гетерозиготных носителей мутации, или полностью блокирует проникновение — у гомозиготных носителей делеции. Высокая частота (до 14%) этого аллеля в одних популяциях и крайне низкая — у других, может иметь существенное значение в плане организации рациональной профилактики пандемии СПИДа.
Гены-триггеры. К тяжелым мультифакториальным заболеваниям могут приводить мутации в генах, играющих ключевую роль в поддержании клеточного гомеостаза, которые названы генами-триггерами мультифакториальных болезней. Именно к этой группе отнесены многочисленные онкогены, а также гены онкосупрессоров (например, р53), следствием мутаций которых является активация соответствующих онкогенов и включение цепи метаболических реакций, приводящих, в конечном счете, к злокачественной трансформации клеток. Для многих десятков таких генов уже идентифицированы неблагоприятные аллельные варианты, предрасполагающие к заболеваниям.
Так, термолабильный вариант ключевого фермента синтеза цистеина — метилентетрагидрофолатредуктазы (MTHFR), ассоциирован с предрасположенностью к атеросклерозу и ишемической болезни сердца, с врожденными дефектами заращения невральной трубки, а также с нерасхождением хромосом в женском мейозе, приводящем к болезни Дауна.
Дефектный ген ангиотензинконвертирующего фермента (АСЕ) ассоциирован с развитием гипертрофии миокарда и гладкой мускулатуры сосудов, а также состоянием инсулинорезистентности, что имеет существенное значение в генезе эссенциальной гипертензии, инфаркта миокарда, инсулиннезависимого сахарного диабета, диабетической нефропатии и другой сосудистой патологии. Один из аллелей (Е4) гена аполипопротеина Е (АроЕ) ассоциирован не только с предрасположенностью к атеросклерозу, но и с болезнью Альцгеймера, хореей Гентинттона, некоторыми другими нейродегенеративными заболеваниями.
В последние годы были идентифицированы мутантные аллели гена СС16, предрасполагающие в гомозиготном состоянии (10% населения) к астме; мутации в гене фактора V свертывания крови резко увеличивают вероятность тромбозов; аллельные полиморфизмы гена TGF2 коррелируют с такими частыми аномалиями внутриутробного развития как расщелина верхней губы (заячья губа) и твердого неба (волчья пасть). Группа известных триггеров мультифакториальных заболеваний сегодня насчитывает более 50 генов и быстро увеличивается.
Наиболее опасным для возникновения многих болезней является сочетание неблагоприятных аллелей нескольких генов с аддитивным эффектом. В частности, индивидуумы с неблагоприятными аллелями генов микросомальной эпоксидгидролазы, СС16, интерлейкинов 4 и 9, а также альфа-1-антитрипсина имеют особенно высокий риск хронических пневмоний, обтурационных бронхитов, эмфиземы легких и астмы.
Особенно сложен генетический механизм возникновения наиболее распространенных мультифакториальных заболеваний, таких как диабет, атеросклероз, ишемическая болезнь сердца, большинство онкологических и нервно-психических заболеваний. Считают, что этиология и патогенез этих заболеваний зависят от неблагоприятного сочетания всех трех основных вариантов генов предрасположенности, т.е. проявления патологических мутаций соответствующих основных генов модифицируются эффектами генов-триггеров, генов детоксикации и генов рецепторов.
В заключение необходимо подчеркнуть, что 1) тестирование генов предрасположенности носит вероятностный характер. Оно не устанавливает диагноз, но выявляет лиц с повышенным риском развития той или иной патологии; 2) с помощью соответствующих мер и рекомендаций можно уберечь их от этих заболеваний; и 3) только наличия неблагоприятных аллелей недостаточно для развития заболевания.
