
- •Современные проблемы биологии
- •Содержание
- •Модуль 1. Проблемы современной генетики и смежных наук
- •Введение
- •Модуль 1. Проблемы современной генетики и смежных наук Тема № 1: Особенности развития биологии на современном этапе
- •1. Общая характеристика современной биологии
- •2. Методы и методология современной биологии
- •3. Основные концепции современной биологии
- •4. Основные направления современных биологических исследований
- •Список источников
- •Тема № 2. Проблемы генетической инженерии
- •1. Краткая история генетической инженерии
- •2. Генная и геномная инженерия
- •3. Генетическая инженерия микробиологических систем
- •4. Методология генной инженерии растений
- •5. Достижения генной инженерии растений
- •6. «Плюсы» и «минусы» генетически модифицированных организмов
- •Список источников
- •Тема № 3. Клонирование и трансгеноз животных
- •1. История клонирования животных
- •2. Проблемы в клонировании животных
- •3. Достижения в области клонирования животных
- •4. Трансгеноз животных
- •5. Трансгенные животные и моделирование заболеваний человека
- •Список источников
- •Тема № 4. Современные методы исследования генома
- •1. Классический подход к расшифровке последовательностей днк
- •4. Использование методов биоинформатики в секвенировании
- •5. История прочтения генома человека
- •Зачем учёным тысячи геномов?
- •Список источников
- •Тема № 5. Геномика и медицина
- •1. Ключевые открытия, сделанные в результате анализа генома человека
- •2. Практическая польза знания последовательности генома человека для медицины
- •3. Классификация наследственных заболеваний человека
- •4. Биохимические и молекулярно-генетические методы диагностики наследственных болезней
- •Виды молекулярно-генетической диагностики
- •Методы исследования днк
- •5. Персонализированная медицина. Фармакогенетика. Фармакогеномика
- •6. Генетический паспорт
- •7. Геномная дактилоскопия
- •8. Генотерапия
- •Список источников
- •Тема № 6. Этногеномика и геногеография
- •1.Основные подходы к днк-анализу в популяционных исследованиях
- •2. Африканское происхождение человека современного типа
- •3. Использование анализа днк для изучения истории этносов
- •4. Этногеномика и геногеография Восточно-Европейского региона
- •5. Особенности русского генофонда
- •Список источников
- •Тема № 7. Рнк – интерференция
- •1. Короткие интерферирующие рнк и механизм рнк-интерференции
- •3. Функции и эволюция микроРнк
- •4. Строение, функции и эволюция пиРнк
- •Тема № 8. Генетика индивидуального развития
- •1. Ооплазматическая сегрегация и полярная плазма
- •2. Формирование градиентов в яйцеклетке
- •3. Гены сегментации
- •4. Гомеозисные гены, их роль в развитии
- •5. Гипотеза э. Льюиса о механизме функционирования гомеозисных генов
- •6. Гомеобокс и гомеодомен. Принцип коллинеарности
- •7. Гены — господа и гены — рабы. Опыты Вальтера Геринга
- •Список источников
- •610000, Г. Киров, ул. Московская, 36, тел.: (8332) 64-23-56, http://vyatsu.Ru
4. Методология генной инженерии растений
Одной из основных задач селекционеров всегда было получение высокоурожайных сортов растений с повышенной пищевой ценностью. Наибольшее внимание уделялось при этом таким зерновым культурам как кукуруза, пшеница и рис, однако были осуществлены программы и по скрещиванию других сельскохозяйственных и садовых культур. В качестве важного инструмента прямого генетического воздействия на растения применяется технология рекомбинантных ДНК, широко использующаяся в микробиологических системах. К настоящему времени разработано несколько эффективных систем переноса ДНК и экспрессирующих векторов, которые работают в ряде растительных клеток. Одним из достоинств последних является их тотипотентность: из одной клетки может быть регенерировано целое растение, так что из клеток, сконструированных генноинженерными методами, можно получить фертильные растения, все клетки которых несут чужеродный ген (трансгенные растения). Если такое растение цветет и дает жизнеспособные семена, то желаемый признак передается последующим поколениям.
Можно привести три основных аргумента в пользу получения трансгенных растений. Во-первых, введение гена (генов) часто приводит к повышению сельскохозяйственной ценности и декоративных качеств культурных растений. Во-вторых, трансгенные растения могут служить живыми биореакторами при малозатратном производстве экономически важных белков или метаболитов. В-третьих, генетическая трансформация растений (трансгеноз) позволяет изучать действие генов в ходе развития растения и других биологических процессов.
На сегодняшний день уже получены многочисленные трансгенные растения на основе как культурных, так и диких видов, которые приобрели такие ценные признаки как инсектицидная активность, устойчивость к вирусным заболеваниям и гербицидам, замедление старения, устойчивость к неблагоприятным условиям окружающей среды, измененная окраска цветков, повышенная пищевая ценность семян. Генная инженерия внесла коррективы в традиционные программы разведения растений, в рамках которых для выведения нового сорта требуется от 10 до 15 лет.
Один из главных методических приёмов генной инженерии растений основан на использовании Ti-плазмиды из Agrobacterium tumefaciens. Эта грамотрицательная почвенная бактерия - фитопатоген, который в процессе своего жизненного цикла трансформирует клетки растений. Трансформация приводит к образованию корончатого галла - опухоли, нарушающей нормальный рост растения (рисунок 1). Этой болезни, имеющей серьезные агрономические последствия, подвержены только двудольные растения, в частности виноград, косточковые фруктовые деревья, розы.
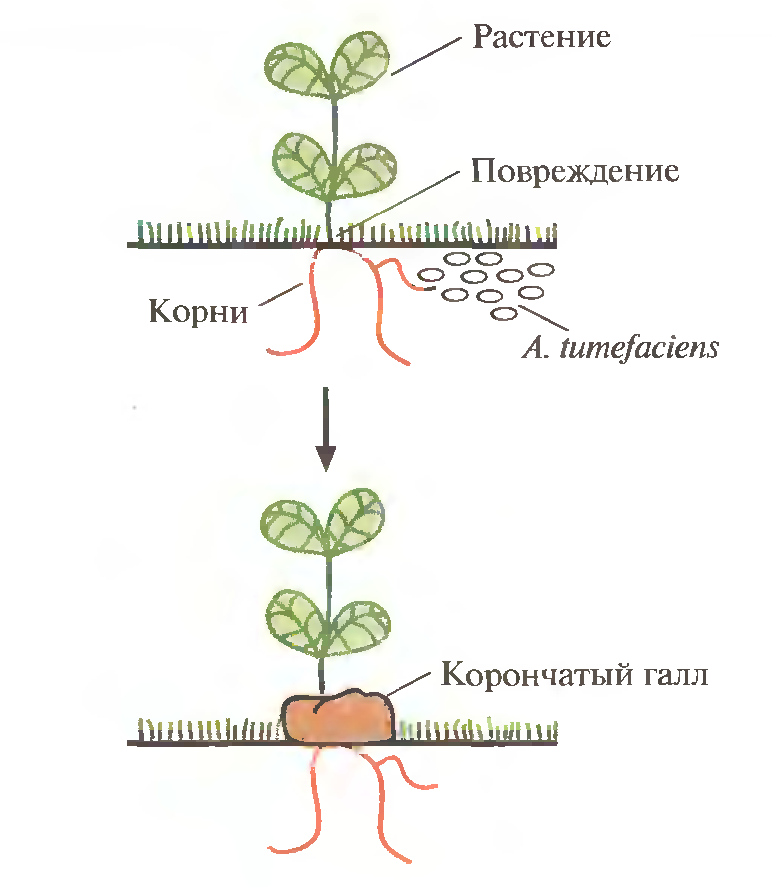
Рисунок 1 - Инфицирование растений агробактериями [2]
Образование корончатого галла начинается с проникновения, встраивания в геном растительных клеток и экспрессии специфического фрагмента бактериальной плазмидной ДНК — так называемой Т-ДНК (от англ. transferred DNA), длина которой составляет 12-22 тыс. пар оснований. Т-ДНК — это часть плазмиды, индуцирующей развитие опухоли (Tumor inducing plasmid, Ti –плазмиды); ее несут большинство штаммов A.tumefaciens.
Т-ДНК содержит гены опухолеобразования, они кодируют ферменты синтеза фитогормонов, вызывающие увеличение размеров растительных клеток (ауксин) и их безудержную пролиферацию (цитокинин). Кроме того, инфицированные растительные клетки начинают синтезировать специфическую аминокислоту опин, который может использоваться только бактериями A. tumefaciens.
Инфекционный процесс начинается с прикрепления A. tumefaciens к клеткам растения в месте повреждения, часто у основания стебля (у корневой шейки). Ранее предполагалось, что A. tumefaciens заражает именно поврежденные растения вследствие разрушения клеточной стенки и устранения физического барьера, затрудняющего проникновение бактерий в клетку. Однако сейчас считается, что все дело в специфических фенольных соединениях, ацетосирингоне и гидроксиацетосирингоне, которые выделяет поврежденное растение; они активируют кластер генов вирулентности (vir), которые локализованы в участке Ti - плазмиды длиной 35 т.п.н., находящемся за пределами Т-ДНК. Продукты vir -генов необходимы для транспорта и встраивания Т-ДНК в геном растительной клетки. Рядом находятся гены утилизации опинов, а также локусы, контролирующие репликацию плазмиды в бактериальной клетке и ее перенос при бактериальной конъюгации (рис. 2).
Один из пяти генов вирулентности VirD кодирует эндонуклеазу. Область Т-ДНК окружена одинаковыми повторами длиной 25 пар оснований. Эти последовательности являются сайтами узнавания VirD - эндонуклеазы, режущей точно между 3-м и 4-м основаниями 25 пар оснований повтора. Эта эндонуклеаза ответственна за вырезание Т-ДНК. Встраивание её происходит по механизму гомологичной рекомбинации; имеется гомология между растительной ДНК по обеим сторонам от места встраивания и наружными областями плазмидной ДНК агробактерий.
В геном растения могут встраиваться несколько копий Т-ДНК. После встраивания в хромосому Т-ДНК становится обычной частью генома расте ния, происходит её транскрипция РНК - полимеразой растения - хозяина, а затем – трансляция. Сама бактерия в клетку не проникает, а остается в межклеточном пространстве и использует растительные клетки со встроенной Т-ДНК как фабрику, продуцирующую для неё опины - источник азота и углерода.
Чтобы использовать природную способность A. tumefaciens проникать в растительные клетки для доставки в них клонированных генов, были созданы векторы на основе Ti -плазмиды.

Рисунок 2 - Генетическая карта Ti-плазмиды. Т-ДНК содержит гены ауксина, цитокинина и опина, которые транскрибируются только в растительных клетках. За пределами Т-ДНК находятся vir-гены, гены ферментов катаболизма опина и сайт начала репликации. Л и П – левая и правая фланкирующие последовательности [2]
Все векторы на основе Тi- плазмид имеют следующие элементы:
- селективный маркерный ген, например ген неомицинфосфотрансферазы, который обеспечивает устойчивость трансформированных растительных клеток к канамицину. Поскольку этот ген (как и многие другие маркерные гены, используемые при трансформации растений) по своей природе прокариотический, необходимо поставить его под контроль растительных (эукариотических) сигналов регуляции транскрипции, в том числе промотора и сигнала терминации-полиаденилирования. Это обеспечивает эффективную экспрессию гена в трансформированных растительных клетках;
- сайт инициации репликации (ori), который позволяет плазмиде реплицироваться в Е.соli. Некоторые векторы содержат также и сайт инициации репликации в A. tumefaciens;
- правая фланкирующая последовательность Т-ДНК. Этот элемент абсолютно необходим для интеграции Т-ДНК в клеточную ДНК растений. Большинство же векторов содержат как правую, так и левую фланкирующие последовательности;
- полилинкер (множественный сайт клонирования) для встраивания гена в участок между границами Т-ДНК;
- поскольку клонирующие векторы не содержат генов vir, они сами не способны обеспечивать доставку и интеграцию Т-ДНК в клетки растения-хозяина. Чтобы решить эту проблему, было разработано два подхода. В первом случае используют бинарную векторную систему.
Бинарный клонирующий вектор содержит сайты инициации репликации и для Е.соli, и для A. tumefaciens, но не несет генов vir, т. е. это практически челночный вектор Е.соli - A. tumefaciens. Все стадии клонирования проводят в Е.соli, а затем вектор вводят в A. tumefaciens. Штамм-реципиент A. tumefaciens несет модифицированную неонкогенную («разоруженную») Тi -плазмиду; она содержит полный набор vir-генов, но из нее удалена часть (или вся) Т-ДНК (так что Т-ДНК не может быть транспортирована). Продуцируя белки, кодируемые vir -генами, неонкогенная Тi-плазмида выступает в роли помощника, способствуя встраиванию Т-ДНК из бинарного клонирующего вектора в хромосомную ДНК растения.
Во втором случае используют коинтегративную векторную систему. Векторная ДНК рекомбинирует в A. tumefaciens с «разоруженной» Тi-плазмидой, Т-ДНК которой не несет опухолеродных генов, таким образом, что весь клонирующий вектор встраивается в неонкогенную Тi-плазмиду.
При конструировании векторных молекул должно быть предусмотрено наличие промоторов, работающих в растениях. Промотор (участок, к которому присоединяются РНК-полимеразы) должен обладать набором свойств, а именно: силой (активной экспрессией), возможностью регуляции, ткане- и органспецифической экспрессией. Так, например, к регулируемым промоторам относится промотор генов белков теплового шока (генов, активность которых индуцируется при повышенной температуре), а тканеспецифичная экспрессия характерна для генов, контролирующих синтез запасных белков, например зеина, который обнаружен только в тканях семян злаков. Наиболее популярным является промотор гена вируса мозаики цветной капусты (CAMV). Гены, подшитые к такому промотору, активно экспрессируются во всех тканях.
Наконец, в векторе должны быть предусмотрены маркеры, с помощью которых возможен отбор трансгенных растений. В литературе маркерные гены еще называют репортерными. Их достаточно много. Например, luxA и luxB - это гены, выделенные из ДНК светлячков. Они контролируют синтез люциферазы, которая обеспечивает переход люцеферинов из окисленной формы в основную, что и обеспечивает свечение. В последнее время пользуется популярностью другой репортерный ген – ген зелёного флуоресцирующего белка GFP (green fluorescent protein). Этот ген был выделен из ДНК медузы Acquorea victoria. Трансгенные растения с этим геном светятся в ультрафиолете зеленым светом.
Традиционный способ трансформации растительных клеток с помощью Т-ДНК заключается в нанесении агробактерий, содержащих Ti-плазмиду, на специально поврежденный побег. К сожалению, эта система доставки применима не для всех видов растений. Эффективным методом доставки ДНК в различные растительные клетки является также бомбардировка микрочастицами золота или вольфрама с ДНК, нанесенной на их поверхность (биобаллистика, или биолистика). Создан даже специальный дробовик – «Shotgun», который стреляет этими шариками.
Были также разработаны методы встраивания чужеродных генов непосредственно в хлоропластную или митохондриальную ДНК так, чтобы кодируемый белок синтезировался прямо в этих органеллах. И наконец, для того чтобы успокоить общественность, были разработаны методы удаления маркерных генов из трансгенных растений.
