
- •Современные проблемы биологии
- •Содержание
- •Модуль 1. Проблемы современной генетики и смежных наук
- •Введение
- •Модуль 1. Проблемы современной генетики и смежных наук Тема № 1: Особенности развития биологии на современном этапе
- •1. Общая характеристика современной биологии
- •2. Методы и методология современной биологии
- •3. Основные концепции современной биологии
- •4. Основные направления современных биологических исследований
- •Список источников
- •Тема № 2. Проблемы генетической инженерии
- •1. Краткая история генетической инженерии
- •2. Генная и геномная инженерия
- •3. Генетическая инженерия микробиологических систем
- •4. Методология генной инженерии растений
- •5. Достижения генной инженерии растений
- •6. «Плюсы» и «минусы» генетически модифицированных организмов
- •Список источников
- •Тема № 3. Клонирование и трансгеноз животных
- •1. История клонирования животных
- •2. Проблемы в клонировании животных
- •3. Достижения в области клонирования животных
- •4. Трансгеноз животных
- •5. Трансгенные животные и моделирование заболеваний человека
- •Список источников
- •Тема № 4. Современные методы исследования генома
- •1. Классический подход к расшифровке последовательностей днк
- •4. Использование методов биоинформатики в секвенировании
- •5. История прочтения генома человека
- •Зачем учёным тысячи геномов?
- •Список источников
- •Тема № 5. Геномика и медицина
- •1. Ключевые открытия, сделанные в результате анализа генома человека
- •2. Практическая польза знания последовательности генома человека для медицины
- •3. Классификация наследственных заболеваний человека
- •4. Биохимические и молекулярно-генетические методы диагностики наследственных болезней
- •Виды молекулярно-генетической диагностики
- •Методы исследования днк
- •5. Персонализированная медицина. Фармакогенетика. Фармакогеномика
- •6. Генетический паспорт
- •7. Геномная дактилоскопия
- •8. Генотерапия
- •Список источников
- •Тема № 6. Этногеномика и геногеография
- •1.Основные подходы к днк-анализу в популяционных исследованиях
- •2. Африканское происхождение человека современного типа
- •3. Использование анализа днк для изучения истории этносов
- •4. Этногеномика и геногеография Восточно-Европейского региона
- •5. Особенности русского генофонда
- •Список источников
- •Тема № 7. Рнк – интерференция
- •1. Короткие интерферирующие рнк и механизм рнк-интерференции
- •3. Функции и эволюция микроРнк
- •4. Строение, функции и эволюция пиРнк
- •Тема № 8. Генетика индивидуального развития
- •1. Ооплазматическая сегрегация и полярная плазма
- •2. Формирование градиентов в яйцеклетке
- •3. Гены сегментации
- •4. Гомеозисные гены, их роль в развитии
- •5. Гипотеза э. Льюиса о механизме функционирования гомеозисных генов
- •6. Гомеобокс и гомеодомен. Принцип коллинеарности
- •7. Гены — господа и гены — рабы. Опыты Вальтера Геринга
- •Список источников
- •610000, Г. Киров, ул. Московская, 36, тел.: (8332) 64-23-56, http://vyatsu.Ru
1. Короткие интерферирующие рнк и механизм рнк-интерференции
В 2006 г. Эндрю Файер (Andrew Fire) и Крейг Мелло (Craig Mello) получили Нобелевскую премию по физиологии и медицине «За открытие явления РНК-интерференции — механизма сайленсинга (заглушения) генов при участии дцРНК». Хотя сам феномен РНК-интерференции был описан задолго до того (ещё в начале 80-х), именно работы Файера и Мелло расшифровали её механизм, заложили фундамент целому направлению современной молекулярной биологии — РНК-интерференции — и определили направление работ множества исследовательских групп по всему миру не на один десяток лет. К настоящему моменту обнаружены три большие группы малых РНК (короткие, микро- и пикоРНК), которые участвуют в процессах РНК-интерференции. Суть этого феномена заключается в подавлении экспрессии гена на стадии транскрипции или трансляции при активном участии малых молекул РНК. Схематично механизм РНК-интерференции показан на рис.1.
Специфичность РНК-интерференции определяется короткими интерферирующими РНК (siRNA, или киРНК) — небольшими двухцепочечными молекулами РНК с чётко определённой структурой (см. рис.2). Короткие интерферирующие РНК эволюционно наиболее ранние, и распространены шире всего у растений, одноклеточных организмов и беспозвоночных. У позвоночных в норме киРНК практически не обнаружены, потому что их вытеснили более поздние «модели» коротких РНК.
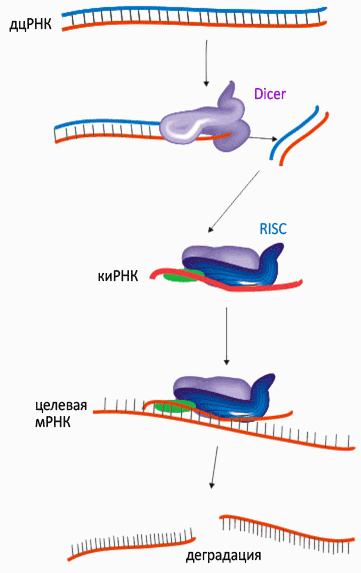
Рисунок 6. Принцип РНК-интерференции [1]
Двуцепочечные молекулы РНК (дцРНК) нехарактерны для нормальных клеток, но они являются обязательным этапом жизненного цикла многих вирусов. Специальный белок Dicer, обнаружив в клетке дцРНК, «режет» её на небольшие фрагменты. Антисмысловая цепь такого фрагмента, которую уже можно называть короткой интерферирующей РНК (киРНК, от siRNA — small interference RNA), связывается комплексом белков под названием RISC (RNA-induced silencing complex), центральный элемент которого — эндонуклеаза семейства Argonaute. Связывание с киРНК активирует RISC и запускает в клетке поиск молекул ДНК и РНК, комплементарных «шаблонной» киРНК. Судьба таких молекул — быть уничтоженными или инактивированными комплексом RISC.
киРНК — «шаблоны» для поиска в цитоплазме и уничтожения молекул мРНК — имеют длину 20–25 нуклеотидов и «особую примету»: по 2 неспаренных нуклеотида на 3’-концах и фосфорилированные 5’-концы. Анти-смысловая киРНК способна (не сама, конечно, а с помощью RISC-комплекса) распознавать мРНК и специфически вызывать её деградацию: разрез целевой мРНК всегда происходит точно в месте, комплементарном 10 и 11 нуклеотидам антисмысловой цепи киРНК.

Рисунок 7. Механизм РНК-интерференции [1]
Механизм «интерференции» мРНК и киРНК. «Интерферирующие» короткие молекулы РНК могут как попадать в клетку извне, так и «нарезаться» уже на месте из более длинных двуцепочечных РНК. Основной белок, необходимый для «нарезания» дцРНК, — эндонуклеаза Dicer. «Выключение» гена по механизму интерференции осуществляется киРНК совместно с белковым комплексом RISC, который состоит из трёх белков — эндонуклеазы Ago2 и двух вспомогательных белков PACT и TRBP. Позже было обнаружено, что комплексы Dicer и RISC могут использовать в качестве «затравки» не только дцРНК, но и одноцепочечную РНК, формирующую двуцепочечную шпильку, а также готовую киРНК (последняя минует стадию «нарезания» и сразу связывается с RISC).
Подытоживая, короткие «обрезки» чужеродной (в том числе, введённой намеренно) двуцепочечной РНК служат «шаблоном» для широкомасштабного поиска и уничтожения комплементарных мРНК (а это эквивалентно подавлению экспрессии соответствующего гена), — причем, не только в одной клетке, но и в соседних.
Функции киРНК в клетках беспозвоночных достаточно разнообразны. Первая и основная — это иммунная защита. «Традиционная» иммунная система (лимфоциты + лейкоциты + макрофаги) присутствует лишь у сложных многоклеточных организмов. У одноклеточных же, беспозвоночных и растений (у которых такой системы либо нет, либо она находится в зачаточном состоянии) иммунная защита строится на основе РНК-интерференции. Иммунитет, основанный на РНК-интерференции, не нуждается в сложных органах «тренировки» предшественников иммунных клеток (селезенка, тимус); в то же время, многообразие теоретически возможных последовательностей коротких РНК (421 вариантов) соотносимо с числом возможных белковых антител высших животных. Кроме того, киРНК синтезируются на основе инфицировавшей клетку «враждебной» РНК, а значит, в отличие от антител, они сразу «затачиваются» под конкретный тип инфекции. И хотя вне клетки защита на основе РНК-интерференции не работает (по крайней мере, таких данных пока нет), внутриклеточный иммунитет она обеспечивает более чем удовлетворительно.
Прежде всего, киРНК создаёт антивирусный иммунитет, уничтожая мРНК или геномную РНК инфекционных организмов (например, так киРНК и были открыты у растений). Введение вирусной РНК вызывает мощную амплификацию специфических киРНК на основе молекулы-затравки — самой вирусной РНК. Кроме того, киРНК подавляют экспрессию различных мобильных генетических элементов (МГЭ), а значит, обеспечивает защиту и от эндогенных «инфекций». Мутации в генах RISC-комплекса часто ведут к повышению нестабильности генома из-за высокой активности МГЭ; киРНК может быть ограничителем экспрессии собственных генов, срабатывая в ответ на их гиперэкспрессию. Регуляция работы генов может происходить не только на уровне трансляции, но и во время транскрипции — через метилирование генов по гистону Н3.
В современной экспериментальной биологии значение РНК-интерференции и коротких РНК трудно переоценить. Разработана технология «выключения» (или нокдауна) отдельных генов in vitro (на культурах клеток) и in vivo (на эмбрионах), что уже стало стандартом при изучении любого гена. Иногда даже, чтобы установить роль отдельных генов в каком-нибудь процессе, проводят систематическое «выключение» всех генов по очереди.
Возможностью применения киРНК заинтересовались и фармацевты, поскольку способность направленной регуляции работы отдельных генов сулит неслыханные перспективы в лечении массы заболеваний. Небольшой размер и высокая специфичность действия обещают высокую эффективность и низкую токсичность лекарств на основе киРНК; однако решить проблему доставки киРНК к больным клеткам в организме пока не удалось — виной тому нестабильность и недолговечность этих молекул. И хотя сейчас десятки коллективов пытаются найти способ направлять эти «волшебные пули» точно в цель (внутрь больных органов), видимых успехов они пока не достигли. Кроме этого, есть и другие сложности. Например, в случае антивирусной терапии высокая избирательность действия киРНК может оказать «медвежью услугу» — поскольку вирусы быстро мутируют, изменённый штамм очень быстро потеряет чувствительность к киРНК, подобранной в начале терапии: известно, что замена всего лишь одного нуклеотида в киРНК приводит к существенному снижению эффекта интерференции.
Необходимо отметить — киРНК были обнаружены только у растений, беспозвоночных и одноклеточных; хотя гомологи белков для РНК-интерференции (Dicer, RISC-комплекс) присутствуют и у высших животных, киРНК привычными методами не обнаруживались. Каково же было удивление, когда искусственно введённые синтетические аналоги киРНК вызывали сильный специфический дозозависимый эффект в культурах клеток млекопитающих! Это означало, что в клетках позвоночных РНК-интерференция не заместилась более сложными системами иммунитета, а эволюционировала вместе с организмами, превратившись во что-то более «продвинутое». Следовательно, у млекопитающих надо было искать не точные аналоги киРНК, а их эволюционных преемников.
2. Строение и механизм действия микроРНК
Действительно, на основе эволюционно достаточно древнего механизма РНК-интерференции у более развитых организмов появились две специализированные системы управления работой генов, использующие каждая свою группу малых РНК — микроРНК (microRNA) и пиРНК (piRNA, Piwi-interacting RNA). Обе системы появились ещё у губок и кишечнополостных и эволюционировали вместе с ними, вытеснив киРНК и механизм «голой» РНК-интерференции.
Их роль в обеспечении иммунитета снижается, поскольку эту функцию взяли на себя более совершенные механизмы клеточного иммунитета, — в частности, интерфероновая система. Однако эта система настолько чувствительна, что срабатывает и на саму киРНК: появление в клетке млекопитающих малых двуцепочечных РНК запускает «сигнал тревоги» (активирует секрецию интерферона и вызывает экспрессию интерферон-зависимых генов, что блокирует все процессы трансляции целиком). В этой связи механизм РНК-интерференции у высших животных опосредован в основном микроРНК и пиРНК — одноцепочечными молекулами со специфической структурой, которая не обнаруживаются интерфероновой системой.
По мере усложнения генома микроРНК и пиРНК принимали всё большее участие в регуляции транскрипции и трансляции. Со временем, они превратились в дополнительную, точную и тонкую систему регуляции генома. В отличие от киРНК, микроРНК и пиРНК (открыты в 2001 году) не производятся из чужеродных двуцепочечных молекул РНК, а изначально закодированы в геноме организма-хозяина.
Предшественник микроРНК транскрибируется с обеих цепей геномной ДНК РНК-полимеразой II, в результате чего появляется промежуточная форма — при-микроРНК, — несущая признаки обычной мРНК — m7G-кэп и полиА-хвост. В этом предшественнике образуется петля с двумя одноцепочечными «хвостами» и несколькими неспаренными нуклеотидами в центре (рис. 3).

Рисунок 8. Структура двуцепочечной молекулы-предшественника микроРНК. Основные особенности: наличие консервативных последовательностей, которые формируют шпильку; наличие комплементарной копии (микроРНК*) с двумя «лишними» нуклеотидами на 3’-конце; специфическая последовательность (2–8 п. н.), формирующая сайт узнавания для эндонуклеаз. Сама микроРНК выделена красным цветом — именно её и вырезает Dicer [1]
Такая петля подвергается двухстадийному процессингу (рис. 4): вначале эндонуклеаза Drosha отрезает от шпильки одноцепочечные «хвосты» РНК, после чего вырезанная шпилька (пре-микроРНК) экспортируется в цитоплазму, где узнается Dicer’ом, вносящим ещё два разреза (вырезается двуцепочечный участок, обозначенный цветом на рис. 3). В таком виде зрелая микроРНК, аналогично киРНК, включается в состав комплекса RISC.
Механизм действия многих микроРНК аналогичен действию киРНК: короткая (21–25 нуклеотидов) одноцепочечная РНК в составе белкового комплекса RISC с высокой специфичностью связывается с комплементарным участком в 3’-нетранслируемой области мРНК-мишени. Связывание приводит к расщеплению мРНК белком Ago. Однако активность микроРНК (по сравнению с киРНК) уже более дифференцирована — если комплементарность не абсолютная, целевая мРНК может не деградировать, а только обратимо блокироваться (трансляции не будет). Тот же RISC-комплекс может использовать и искусственно введённые киРНК. Это объясняет, почему киРНК, сделанные по аналогии с простейшими, активны и у млекопитающих.
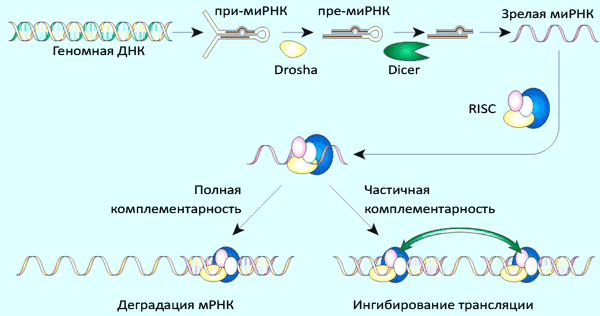
Рисунок 9. Общий механизм процессинга микроРНК и реализации её активности[1]
Таким образом, можно дополнить иллюстрацию механизма действия РНК-интерференции у высших (билатерально-симметричных) организмов, объединив на одном рисунке схему действия микроРНК и искусственно созданных и введённых в организм киРНК (рис. 5).
