- •Методическая разработка
- •Методическая разработка
- •Методическая разработка
- •Лабораторная работа № 2
- •Лабораторная работа № 3 Получение амфотерных гидроксидов и изучение их свойств
- •Основные положения теории с. Аррениуса
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Лабораторная работа № 1
- •Лабораторная работа № 2
- •Лабораторная работа № 3 Зависимость степени гидролиза солей от температуры
- •Лабораторная работа № 4
- •Лабораторная работа № 5 Полный гидролиз солей
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •3.2 Диссоциация воды. Ионное произведение воды. Водородный показатель и методы его определения.
- •3.3 Расчет рН в растворах слабых и сильных кислот и оснований.
- •3.4 Буферные системы: определение, классификация и механизм действия. Расчет буферных систем.
- •Приготовление буферных растворов
- •Определение буферной емкости буферной системы
- •6.2 Диссоциация воды. Ионное произведение воды. Водородный показатель и методы его определения.
- •6.3 Расчет рН в растворах слабых и сильных кислот и оснований.
- •6.4 Буферные системы: определение, классификация и механизм действия. Расчет буферных систем.
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Запись экспериментальных данных
- •Запись экспериментальных данных
- •Масса воды m2
- •Учреждение образования «Гомельский государственный медицинский университет»
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Формулировки второго закона:
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Зависимость скорости реакции от температуры
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Получение кс с катионным комплексом
- •Получение кс с анионным комплексом
- •Внутрикомплексные соединения
- •Дополнительная:
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Окислительно-восстановительные реакции и реакции, протекающие без изменения степени окисления атомов
- •Влияния рН среды на протекание ов реакций
- •Реакции диспропорционирования
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •10 Рис. Кривая потенциометрического
- •Определение константы кислотности уксусной кислоты
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Лабораторная работа № 2
- •В ходе работы необходимо определить поверхностное натяжение (σ) водных растворов амилового спирта с5н11он следующих концентраций: 0,01; 0,025; 0,05; 0,1; 0,2 м.
- •Расчетные задачи:
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Методы получения золей
- •Получение золей методом химической конденсации
- •Строение коллоидной мицеллы Рассмотрим строение мицеллы AgI в избытке ki:
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Изучение набухания и растворения вмс
- •Набухание каучука
- •Набухание желатина в зависимости от значения рН
- •Лабораторная работа № 2
- •Определение изоэлектрической точки белка
- •Реакции полимеризации
- •Реакции поликонденсации
- •Классификация вмс
- •Сравнительная характеристика свойств растворов вмс и золей
- •Изоэлектрические точки некоторых белков
- •Методы экспериментального определения иэт белков
- •И других полиамфолитов
- •Золотые числа некоторых полимеров (мг)
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Тема № 17:Химия биогенных элементов
- •Химия s-элементов
- •Химия р-элементов
- •Химия d-элементов
- •Триада железа
- •6. Литература
Лабораторная работа № 2
Определение зависимости σ раствора от концентрации
поверхностно-активных веществ
В ходе работы необходимо определить поверхностное натяжение (σ) водных растворов амилового спирта с5н11он следующих концентраций: 0,01; 0,025; 0,05; 0,1; 0,2 м.
Результаты занесите в таблицу 2.
Таблица 2
|
СМ (С5Н11ОН), моль/л |
n, число капель спирта |
σ·103, Н/м |
|
0,01 |
|
|
|
0,025 |
|
|
|
0,05 |
|
|
|
0,1 |
|
|
|
0,2 |
|
|
Расчеты проводите по формуле:
 ,
где σ (Н2О
) = 72,75·10-3
Н/м
,
где σ (Н2О
) = 72,75·10-3
Н/м
Начертите график 2 зависимости поверхностного натяжения (σ) от концентрации ПАВ.
График 2. Зависимость поверхностного натяжения (σ)
от концентрации СМ амилового спирта
σ ·103,
·103,
Н/м

С М
(С5Н11ОН),
моль/л
М
(С5Н11ОН),
моль/л
Сделайте вывод на основании полученных данных.
ПРИМЕЧАНИЕ: Перед каждым опытом необходимо предварительно промыть сталагмометр водой. Для расчета поверхностного натяжения каждого ПАВ необходимо подсчитать количество капель для воды и каждого спирта. При переходе к лабораторной работе 2, сталагмометр необходимо промыть водой еще раз.
5. ХОД ЗАНЯТИЯ:
Молекулы жидкости, находящиеся в поверхностном слое на границе жидкость-газ, испытывают со стороны молекул газа значительно меньшее притяжение, чем со стороны молекул жидкости. В результате возникает сила, направленная внутрь жидкости. Свободная поверхность жидкости находится в состоянии натяжения и представляет собой как бы натянутую пленку, стремящуюся к сокращению, толщина которой равна радиусу сферы молекулярного действия.
Поверхностное натяжение – это сила, отнесенная к единице длины линии, ограничивающей поверхность жидкости, и действующая в сторону уменьшения этой поверхности; обозначается σ (сигма). Поверхностное натяжение численно равно свободной энергии единицы площади поверхности и выражается в Джоулях на квадратный метр (Дж/м2 или Н/м). Поверхностная энергия системы Gs= σS, (где σ – поверхностное натяжение; S – площадь поверхности).
Согласно второму закону термодинамики, система стремится уменьшать свободную энергию поверхности. В чистых жидкостях это осуществляется за счет сокращения площади поверхности (жидкость, на которую не действуют посторонние силы, всегда стремится принять форму шара, происходит соединение мелких капель в одну большую). В растворах уменьшение свободной энергии поверхности осуществляется за счет перехода в поверхностный слой молекул вещества, имеющего поверхностное натяжение, меньшее поверхностного натяжения растворителя. Увеличение концентрации вещества в поверхностном слое по сравнению с концентрацией его внутри раствора называется адсорбцией. Вещества, понижающие поверхностное натяжение, накапливаются в поверхностном слое. Это поверхностно-активные вещества. К ним относятся органические соединения, в состав молекул которых одновременно входит полярная группа ( –ОН, –СООН, –NН2) и неполярная углеводородная цепь, т.е. дифильные молекулы. Поверхностный избыток Г (моль/см2 или кмоль/м2) есть избыток растворенного вещества содержащегося в 1 см2 или 1 м2 поверхностного слоя по сравнению с количеством вещества в слое такой же площади внутри объема. Зависимость между Г, и концентрацией раствора C была установлена Гиббсом:
![]() ,
,
где R – газовая постоянная;
Т – абсолютная температура;
![]() –бесконечно малое
изменение σ с бесконечно малым изменением
С, по предложению П.А. Ребиндера, эта
величина была названа поверхностной
активностью, так как она характеризует
способность вещества понижать
поверхностное натяжение.
–бесконечно малое
изменение σ с бесконечно малым изменением
С, по предложению П.А. Ребиндера, эта
величина была названа поверхностной
активностью, так как она характеризует
способность вещества понижать
поверхностное натяжение.
Траубе установил, что в любом гомологическом ряду удлинение углеродной цепи гомолога на группу -СН2- увеличивает его поверхностную активность в 3-3,5 раза. Это значит, что способность вещества понижать поверхностное натяжение увеличивается.
При истечении жидкости из капилляра сила поверхностного натяжения заставляет жидкость собираться у края отверстия в каплю, которая отрывается в тот момент, когда масса капли ничтожно превышает поверхностное натяжение. Чем больше поверхностное натяжение, тем тяжелее и соответственно крупнее будет капля. Таким образом, поверхностное натяжение пропорционально плотности и обратно пропорционально количеству капель, вытекающих из одного и того же объема. Поверхностное натяжение определяется по формуле:
![]()
![]() (1)
(1)
где σ – поверхностное натяжение исследуемой жидкости;
σ (H2O) – поверхностное натяжение воды;
d и d (H2O) – плотности исследуемой жидкости и воды;
n и n (H2O) – число капель исследуемой жидкости и воды.
Для разбавленных водных растворов, плотность которых мало отличается от единицы, формулу можно упростить:
![]() (2)
(2)
σ (H2O) = 72,75 мН/м (72,75.10ˉ3 Н/м или 72,75.10ˉ3 Дж/м2) при температуре 20oС, поэтому для определения поверхностного натяжения достаточно подсчитать количество капель исследуемой жидкости и воды, вытекающей из одного и того же объема. Для определения поверхностного натяжения пользуются сталагмометром Траубе. Жидкость засасывают немного выше верхней кольцевой метки, затем дают ей свободно вытекать, подсчитывая количество капель, образующихся при вытекании отмеченного на сталагмометре объема (от верхней метки до нижней) и по формуле (2) определяют поверхностное натяжение.
К основным видам адсорбции на твердых адсорбентах относятся:
молекулярная адсорбция неэлектролитов и слабых электролитов,
избирательная адсорбция электролитов из их растворов,
ионообменная адсорбция.
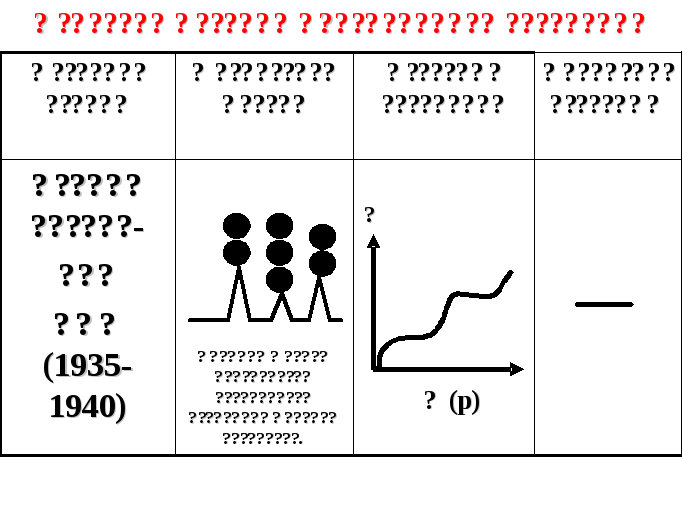
Молекулярной адсорбцией называют адсорбцию неэлектролитов и слабых электролитов из жидкой или газообразной фазы твердыми адсорбентами. Единой теории молекулярной адсорбции не существует, однако имеющиеся теории позволяют удовлетворительно описать адсорбционный процесс для конкретных случаев. Краткое описание трех теорий молекулярной адсорбции представлено в таблице 3.
Таблица 3
Некоторые теории молекулярной адсорбции
|
Название теории |
Физическая модель |
Изотерма адсорбции |
Уравнение изотермы |
|
Теория мономолекулярной адсорбции Ленгмюра (1915) |
Неровности являются активными центрами поверхности. Один центр адсорбирует одну молекулу адсорбата.
|
p - парциальное давление адсорбата |
где К – константа адсорбционного равновесия |
|
Название теории |
Физическая модель |
Изотерма адсорбции |
Уравнение изотермы |
|
Теория полимолекулярной адсорбции Поляни (1915) |
Поверхность однородна; ее силовое поле притягивает несколько слоев адсорбата.
|
|
_____
|
|
Теория адсорбции БЭТ (1935-1940)
|
Активный центр поверхности адсорбирует несколько молекул адсорбата.
|
|
______ |
Для вычисления молекулярной адсорбции используют эмпирическое уравнение Фрейндлиха:
æ = kс1/n
æ = kp1/n
где æ — масса адсорбата на 1 грамме адсорбента,
р — равновесное давление в газовой фазе,
с — равновесная концентрация в жидкой фазе,
k — константа Фрейндлиха,
n — параметр уравнения.
Адсорбция электролитов из растворов бывает двух видов:
(а) избирательная,
(б) ионоселективная.
Избирательная адсорбция электролитов описывается правилами Панета-Фаянса.
Правило 1: на твердой поверхности адсорбируются преимущественно те ионы, которые входят в ее состав. Такую адсорбцию можно рассматривать как достраивание кристаллической решетки адсорбента.
Правило 2: на заряженной поверхности адсорбируются ионы противоположного знака. Они называются противоионами (ПРИ). В результате адсорбции ПРИ на поверхности раздела формируется двойной электрический слой.
Способность ионов адсорбироваться на твердых поверхностях зависит: (а) от заряда иона; чем больше заряд, тем выше адсорбционная способность; (б) от ионного радиуса; чем меньше радиус, тем ниже адсорбционная способность. Ионы одного знака и заряда, но различной адсорбционной способности, образуют лиотропные ряды.
Ионообменная адсорбция — это процесс, в котором твердый адсорбент и раствор обмениваются одноименно заряженными ионами в эквивалентных количествах. Сорбенты, способные и обмену ионов, называются ионообменниками или ионитами. Различают два типа ионитов: катиониты и аниониты.
6. вопросы ДЛЯ САМОконтроля знаний:
1) Что называют внутренним давлением жидкости? Каков механизм возникновения поверхностного натяжения? В каких единицах выражают σ?
2) Что такое адсорбция? Какие процессы вызывают это явление? Каков характер этого процесса – протекает ли он самопроизвольно?
3) Каковы знаки ΔG, ΔS и ΔН для адсорбции газа на кристалле?
4) Напишите уравнение изотермы адсорбции Гиббса, проанализируйте входящие в него величины.
5) Как формулируют правило Дюкло-Траубе? Приведите эмпирическое уравнение Шишковского.
6) Напишите уравнение Фрейндлиха, описывающее адсорбцию газов и жидкостей на твердых поверхностях. Как определяют его константы?
7) Напишите уравнение изотермы адсорбции Ленгмюра, проанализируйте его.
8) Избирательная адсорбция ионов. Правило Пескова-Фаянса. Лиотропные ряды.


 С
концентрация адсорбата в растворе,
С
концентрация адсорбата в растворе,