
- •Методическая разработка
- •Методическая разработка
- •Методическая разработка
- •Лабораторная работа № 2
- •Лабораторная работа № 3 Получение амфотерных гидроксидов и изучение их свойств
- •Основные положения теории с. Аррениуса
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Лабораторная работа № 1
- •Лабораторная работа № 2
- •Лабораторная работа № 3 Зависимость степени гидролиза солей от температуры
- •Лабораторная работа № 4
- •Лабораторная работа № 5 Полный гидролиз солей
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •3.2 Диссоциация воды. Ионное произведение воды. Водородный показатель и методы его определения.
- •3.3 Расчет рН в растворах слабых и сильных кислот и оснований.
- •3.4 Буферные системы: определение, классификация и механизм действия. Расчет буферных систем.
- •Приготовление буферных растворов
- •Определение буферной емкости буферной системы
- •6.2 Диссоциация воды. Ионное произведение воды. Водородный показатель и методы его определения.
- •6.3 Расчет рН в растворах слабых и сильных кислот и оснований.
- •6.4 Буферные системы: определение, классификация и механизм действия. Расчет буферных систем.
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Запись экспериментальных данных
- •Запись экспериментальных данных
- •Масса воды m2
- •Учреждение образования «Гомельский государственный медицинский университет»
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Формулировки второго закона:
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Зависимость скорости реакции от температуры
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Получение кс с катионным комплексом
- •Получение кс с анионным комплексом
- •Внутрикомплексные соединения
- •Дополнительная:
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Окислительно-восстановительные реакции и реакции, протекающие без изменения степени окисления атомов
- •Влияния рН среды на протекание ов реакций
- •Реакции диспропорционирования
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •10 Рис. Кривая потенциометрического
- •Определение константы кислотности уксусной кислоты
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Лабораторная работа № 2
- •В ходе работы необходимо определить поверхностное натяжение (σ) водных растворов амилового спирта с5н11он следующих концентраций: 0,01; 0,025; 0,05; 0,1; 0,2 м.
- •Расчетные задачи:
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Методы получения золей
- •Получение золей методом химической конденсации
- •Строение коллоидной мицеллы Рассмотрим строение мицеллы AgI в избытке ki:
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Изучение набухания и растворения вмс
- •Набухание каучука
- •Набухание желатина в зависимости от значения рН
- •Лабораторная работа № 2
- •Определение изоэлектрической точки белка
- •Реакции полимеризации
- •Реакции поликонденсации
- •Классификация вмс
- •Сравнительная характеристика свойств растворов вмс и золей
- •Изоэлектрические точки некоторых белков
- •Методы экспериментального определения иэт белков
- •И других полиамфолитов
- •Золотые числа некоторых полимеров (мг)
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Тема № 17:Химия биогенных элементов
- •Химия s-элементов
- •Химия р-элементов
- •Химия d-элементов
- •Триада железа
- •6. Литература
Методическая разработка
для проведения занятия со студентами
I курса медико-диагностического факультета в I семестре
по общей и биоорганической химии
Тема № 15: Устойчивость коллоидно-дисперсных систем
Время: 2,5 часа
1. УЧЕБНЫЕ И ВОСПИТАТЕЛЬНЫЕ ЦЕЛИ:
Познакомить студентов-медиков с факторами, влияющими на кинетическую и агрегативную устойчивость коллоидно-дисперсных систем, обратив особое внимание на общие закономерности коагуляции золей электролитами.
МОТИВАЦИЯ ДЛЯ УСВОЕНИЯ ТЕМЫ:
Явление коагуляции играет существенную роль в живом организме, так как коллоидные растворы клеток находятся в соприкосновении с электролитами, содержащимися в биологических жидкостях. Решение многих проблем в медицине (например, протезирование кровеносных сосудов, клапанов сердца и т.д.) связано с проблемой свертывания крови. В хирургии во время операций в кровь вводят антикоагулянты (гепарин), а после операций – для повышения коагуляции – протамин сульфат. С явлением коагуляции эритроцитов врачи постоянно имеют дело в клинических лабораториях.
ТРЕБОВАНИЯ К ИСХОДНОМУ УРОВНЮ ЗНАНИЙ:
а) понятие о дисперсных системах;
б) строение мицелл гидрофобных золей;
в) электрокинетические явления (электрофорез и электроосмос).
В результате проведения занятия студент должен:
1) знать:
теоретические основы устойчивости лиофобных золей;
факторы, влияющие на устойчивость лиофобных золей;
основные закономерности коагуляции золей под действием электролитов;
механизм действия электролитов на устойчивость золей;
понятие о пороге коагуляции, правило Шульце-Гарди;
коагуляцию золей смесью электролитов;
взаимн коагуляция золей;
теоретические основы кинетики коагуляции.
2) уметь:
излагать теоретические основы устойчивости и коагуляции лиофобных золей;
определять, какой ион электролита-коагулятора будет оказывать коагулирующее действие на золь;
сопоставлять коагулирующую способность электролитов;
уметь рассчитывать порог коагуляции электролита в соответствии с правилом Шульце-Гарди;
уметь готовить коллоидные растворы железо (III) гидроксида реакцией гидролиза и берлинской лазури реакцией обмена;
проводить коагуляцию полученных золей под действием электролитов.
2. СВЯЗЬ СО СМЕЖНЫМИ ДИСЦИПЛИНАМИ:
Теоретические основы знаний о строении и свойствах дисперсных систем и коллоидной защиты потребуются студентам при изучении курсов медицинской физики и биологии, хирургических болезней, патологической анатомии с курсом судебной медицины.
3. КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ ЗАНЯТИЯ:
3.1 Виды устойчивости коллоидно-дисперсных систем.
3.2 Основные закономерности коагуляции лиофобных золей под действием электролитов.
3.3. Порог коагуляции. Правило Шульце-Гарди.
3.4 Скорость коагуляции. Кинетические кривые коагуляции.
4. ПРАКТИЧЕСКАЯ ЧАСТЬ ЗАНЯТИЯ:
Лабораторная работа № 1
Получение коллоидных растворов железо (III) гидроксида
и берлинской лазури
1. Получение золя Fe(OH)3 реакцией гидролиза
В конической колбе (250 мл) на электроплитке нагрейте до кипения 150 мл дистиллированной воды. Не снимая колбу, выключите плитку и небольшой струей влейте в воду при помощи аналитической пипетки 5 мл концентрированного раствора железо (III) хлорида. Происходит гидролиз FeCl3, в результате чего образуется коллоидный раствор железо (III) гидроксида интенсивного красно-коричневого цвета.
Охладите полученный золь под струей водопроводной воды до комнатной температуры. Если необходимо, то отфильтруйте его через складчатый фильтр. Золь должен быть прозрачным в проходящем свете.
2. Получение золя берлинской лазури реакцией обмена
В коническую колбу (250 мл) налейте 25 мл дистиллированной воды и добавьте при помощи микропипеток (1 мл и 2 мл) 0,2 мл концентрированного раствора FeCl3 и 2 мл насыщенного раствора желтой кровяной соли при перемешивании. В результате реакции обмена образуется нерастворимая в воде берлинская лазурь (железо (III) гексацианоферрат (II)) Fe4[Fe(CN)6]3 в виде густого геля. К образовавшемуся гелю берлинской лазури добавьте 150 мл дистиллированной воды, встряхните раствор и отфильтруйте золь через складчатый фильтр, смоченный дистиллированной водой. Золь должен быть совершенно прозрачным в проходящем свете и иметь интенсивно синюю окраску.
В данном случае золь берлинской лазури, для которого стабилизатором является желтая кровяная соль, образуется в результате пептизации геля.
Лабораторная работа № 2
Определение порога коагуляции полученных золей Fe(OH)3 и Fe4[Fe(CN)6]3
Для определения порогов коагуляции золя железо (III) гидроксида приготовьте растворы электролитов с убывающей концентрацией. Для этого возьмите три ряда пробирок по 6 штук в каждом ряду. В пробирки каждого ряда налейте заданный объем дистиллированной воды и объемы растворов электролитов в соответствии с таблицей 1. Растворы электролитов отмеряют аналитической пипеткой.
Разведение раствора электролита в 3-х рядах одинаково, поэтому, чтобы рационально использовать время, рекомендуется заполнять пробирку так: взяв в руки одновременно вторые пробирки всех 3-х рядов, налейте в них по 1 мл дистиллированной воды; в третьи – по 2 мл дистиллированной воды и т.д. Затем в пробирки каждого ряда пипеткой добавьте объемы раствора заданного электролита в убывающем количестве 5, 4, 3, 2, 1 и 0,5 мл.
После разведения электролитов водой быстро добавьте во все пробирки по 5 мл золя. Содержимое пробирок перемешайте встряхиванием и запишите время начала опыта. Оставьте пробирки на 30 мин. для протекания явной коагуляции. Приготовьте контрольный раствор золя железо (III) гидроксида сливанием в пробирку 5 мл дистиллированной воды и 5 мл золя.
Методика для определения порогов коагуляции золя берлинской лазури точно такая же (таблица 2). Контрольный раствор готовят сливанием 5 мл дистиллированной воды и 5 мл исходного раствора берлинской лазури. Коагуляцию отмечают, сопоставляя контрольную и исследуемую пробирки.
В таблицах 1 и 2 отмечают коагуляцию знаком "+", а отсутствие коагуляции знаком "–".
Суммарный объем растворов в каждой пробирке составляет 10 мл, следовательно, концентрация золя во всех пробирках одинакова. Если См – молярная концентрация раствора электролита, а V – минимальное число мл этого электролита, достаточное для коагуляции 10 мл золя, то См∙V – это число миллимоль электролита, добавленного к 10 мл золя.
Для пересчета на 1 л золя произведение См∙Vнадо умножить на 100, тогда порог коагуляции будет равен:
γ = СМ∙V∙100 ммоль/л
Таблица 1
Коагуляция золя железо (III) гидроксида под влиянием электролитов
Время начала опыта ....... час. ....... мин.
Время окончания опыта ....... час. ....... мин.
|
Ряд пробирок |
Коагулятор |
Порог коагуля- ции, ммоль/л |
Номер пробирки | ||||||
|
Электролит |
Ион |
1 |
2 |
3 |
4 |
5 |
6 | ||
|
1 |
KCl (3,0 М) |
Cl- |
|
|
|
|
|
|
|
|
2 |
K2SO4 (0,005 M) |
|
|
|
|
|
|
|
|
|
3 |
K3[Fe(CN)6] (0,0005 M) |
[Fe(CN)6]3‾ |
|
|
|
|
|
|
|
|
Объем, мл |
Дистиллированная вода |
0 |
1 |
2 |
3 |
4 |
4,5 | ||
|
Раствор электролита |
5 |
4 |
3 |
2 |
1 |
0,5 | |||
|
Золь железо (III) гидроксида |
5 |
5 |
5 |
5 |
5 |
5 | |||
Таблица 2
Коагуляция золя берлинской лазури под влиянием электролитов
Время начала опыта ...... час. ..... мин.
Время окончания опыта ..... час. ..... мин.
|
Ряд пробирок |
Коагулятор |
Порог коагуля- ции, ммоль/л |
Номер пробирки | ||||||
|
Электролит |
Ион |
1 |
2 |
3 |
4 |
5 |
6 | ||
|
1 |
KCl (1,0 М ) |
K+ |
|
|
|
|
|
|
|
|
2 |
CaCl2 (0,03 М) |
Ca2+ |
|
|
|
|
|
|
|
|
3 |
AlCl3 (0,003 М ) |
Al3+ |
|
|
|
|
|
|
|
|
Объем, мл |
Дистиллированная вода |
0 |
1 |
2 |
3 |
4 |
4,5 | ||
|
Раствор электролита |
5 |
4 |
3 |
2 |
1 |
0,5 | |||
|
Золь берлинской лазури |
5 |
5 |
5 |
5 |
5 |
5 | |||
ФОРМА ОТЧЕТА:
1. Напишите уравнения реакций получения золей Fe(OH)3 и Fe4[Fe(CN)6]3.
2. Представьте формулу, отражающую строение мицеллы золя Fe(OH)3.
3. Приведите формулу строения мицеллы золя берлинской лазури, стабилизированного желтой кровяной солью.
4. Каков знак заряда коллоидных частиц железо (III) гидроксида и берлинской лазури?
5. Какие ионы электролита-коагулятора должны оказать коагулирующее действие на золи Fe(OH)3 и Fe4[Fe(CN)6]3?
6. Рассчитайте порог коагуляции золей Fe(OH)3 и Fe4[Fe(CN)6]3 для каждого электролита-коагулятора.
5. ХОД ЗАНЯТИЯ:
Под устойчивостью дисперсной системы понимают постоянство во времени ее состояния и свойств. Различают два вида коллоидной устойчивости: кинетическую (седиментационную) и агрегативную. Причиной кинетической устойчивости является броуновское движение, которое противодействует оседанию частиц под действием силы тяжести.
Агрегативная устойчивость золей обусловлена наличием двойного электрического слоя у коллоидных частиц, что препятствует их слипанию при столкновении. Другими словами, наличие одноименных зарядов у коллоидных частиц приводит к их отталкиванию друг от друга и повышению устойчивости золя. При нарушении агрегативной устойчивости золей происходит их коагуляция.
Коагуляция — это процесс объединения коллоидных частиц в более крупные агрегаты вследствие полной или частичной потери электрических зарядов. С точки зрения термодинамики, коагуляция протекает самопроизвольно вследствие стремления системы перейти в состояние с более низкой свободной энергией.
Коагуляцию может вызывать целый ряд факторов:
изменение температуры,
увеличение концентрации дисперсной фазы,
механическое воздействие,
добавление электролитов.
Наибольшее практическое значение имеет коагуляция золей электролитами. Коагуляция электролитами протекает в живом организме, т.к. коллоидные растворы клеток находятся в соприкосновении с электролитами, содержащимися в биологических жидкостях.
Коагуляцию золей вызывают все сильные электролиты при увеличении их концентрации в растворе до некоторого значения, называемого порогом коагуляции. Порог коагуляции (γ)– это минимальное количество электролита, которое надо добавить к 1 л золя, чтобы вызвать начало коагуляции.
Порог коагуляции рассчитывается по уравнению:
 ,
,
где γ – порог коагуляции (моль/л),
с – концентрация электролита (моль/л),
V – объем раствора электролита (л)
V3 – объем золя (л).
Коагулирующие действие электролитов описывается правилом Шульце – Гарди: коагуляцию вызывают ионы, заряд которых противоположен заряду гранулы. Коагулирующая способность тем больше, чем выше заряд иона-коагулятора.
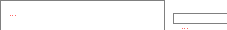
Дерягин и Ландау показали, что порог коагуляции золя обратно пропорционален заряду иона-коагулятора, возведенному в шестую степень:
Правило Шульце - Гарди носит приблизительный характер, так как не учитывает влияния ионных радиусов на коагулирующую способность ионов.
Ионы с одинаковыми зарядами, но различными ионными радиусами, образуют лиотропные ряды:
Li+ > Na+ > K+ > Rb+ > Cs+

Увеличение коагулирующей способности ионов
Процесс коагуляции золя характеризуется определенной величиной скорости коагуляции, которую можно определить как изменение числа коллоидных частиц в единице объема за единицу времени.

Рисунок 1 – Кинетическая кривая коагуляции
Отрезок ОА отвечает периоду скрытой коагуляции, при которой золь сохраняет свою устойчивость. В точке А начинается явная коагуляция, которая соответствует уменьшению ξ-потенциала коллоидных частиц до 30 мВ.
На участке БВ скорость коагуляции достигает максимального значения; этот отрезок кинетической кривой соответствует периоду быстрой коагуляции (ζ-потенциал равен нулю).
6. вопросы ДЛЯ САМОконтроля знаний:
1. Какие ионы электролитов Na2SO4 и K3[Fe(CN)6] являются коагулирующими для золя железо (III) гидроксида, полученного методом гидролиза?
2. Укажите, какой из электролитов, Ba(NO3)2 или Na2SO4, следует взять в избытке, чтобы получить золь барий сульфата с положительно заряженными гранулами.
3. Укажите, какой из электролитов будет иметь наименьший порог коагуляции по отношению к золю Fe(OH)3 с положительно заряженными гранулами: KNO3, MgSO4, AlCl3, K3PO4.
4. Коагуляция 10 мл золя железо (III) гидроксида наступила при добавлении к нему 2 мл раствора Na2SO4 с молярной концентрацией 0,0025 моль/л. Вычислите порог коагуляции этого электролита.
7. ЛИТЕРАТУРА
основная:
1. Конспект лекций.
2. Общая химия. Биофизическая химия. Химия биогенных элементов: учеб. для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – М.: Высш. шк., 2005. – С. 510-526.
3. Основы биофизической и коллоидной химии : учеб. пособие / Е.В. Барковский [и др.]. – Минск: Выш. шк., 2009. – С. 310-317.
ДОПОЛНИТЕЛЬНАЯ:
1. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов. Учеб. пособие для вузов / А.В. Бабков, В.А. Попков, С.А. Пузаков, Л.И. Трофимова; Под ред. В.А. Попкова, А.В. Бабкова. 2-е изд., перераб. и доп. – М.: Высш. шк., 2001. – С. 184-198.
2. Зеленин, К.Н. Химия. / К.Н. Зеленин. – СПб: Специальная литература, 1997. – С. 284-291.
3. Захарченко, В.Н. Коллоидная химия. / В.Н. Захарченко. – М: Высшая школа, 1989 г. – С.104-118.
Авторы: Зав. кафедрой, доцент, к.х.н. Лысенкова А.В., доцент, к.х.н. Филиппова В.А., ст. преподаватели Прищепова Л.В., Чернышева Л.В., Одинцова М.В., ассистенты Короткова К.И., Перминова Е.А.
05.10.2010
Министерство здравоохранения Республики Беларусь
Учреждение образования
«Гомельский государственный медицинский университет»
Кафедра общей и биоорганической химии
Обсуждено на заседании кафедры ___________________
Протокол №_____________________________________
