- •Оглавление
- •1.Факторы, влияющие на растворимость газов.
- •2.Зависимость растворимости газа от температуры.
- •3.Факторы,влияющие на растворимость газов в жидкостях
- •4.Типы растворов жидкостей в жидкостях, причины их разнообразия.
- •5.Идеальные растворы. Построение их диаграммы «давление – состав», температура кипения – состав.
- •6.Вывод зависимости давления насыщенного пара смеси от состава жидкой и паровой фаз.
- •7. Реальные р-ры жидкостей неограниченно растворимые друг в друге. Причины отклонения давления паров над раствором от з-на Рауля.
- •8.Диаграммы давление –состав и температура – состав для реaльных растворов
- •9.Первый з-н Конавалова
- •10.Методы разделения смесей. Ректификация.
- •11. Диаграмма состояния р-ров ,образующих азеотропы.2й з-н Коновалова.
- •12.Диаграмма «давление – состав» и «температура – состав» Жидкости, ограниченно растворимых друг в друге.
- •13.Диаграммы “Давление-состав” и “температура-состав” для жидкостей, взаимно нерастворимых друг в друге.
- •14. Закон распределения Шилова-Нернста. Экстракция.
- •15. Трехкомпанентные системы. Графическое представление. Определение методами Розебома и Гиббса.
- •16.Диаграмма плавкости 2-х компонентных систем с огранич-ной растворимостью в твердом состоянии. Эвтектика.
- •17. Дифферинциальный термический анализ (дта)
- •18Диаграммы плавкости систем с конгруэнтно и инконгруэнтно плавящимися соединениями.
- •19.Проводимость в газах, жидкостях и твердых телах. Электропроводность удельная и эквивалентная. Основные полож-я теории сильных эл-тов. Термодтнамика р-ров сильных эл-тов.
- •20. Скорость движ-ния иона,абсолютная ск-сть движ-я иона,подвижность.
- •21. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
- •23.Влияние различных факторов на электропроводность для р-ров сильных электролитов.
- •24.Уравнение Кольрауша для слабых и сильных электролитов. Числа переноса.
- •25. Ионная сила р-ра. Ионный радиус, ионная атмосфера. Электрофоретическое и релаксационное торможение. Эффект Вина,понятие дисперсии электропроводности.
- •26. Активности и коэффициенты активности электролитов. Вычисление средних коэффициентов активности ионов.
- •27. Кондуктометрическое титрование как метод определения точки эквивалентности при титровании, изменения состава растворов для расчета степени диссоциации, констант диссоциации.
- •28. Понятие об электродвижущих силах, полуэлементе, элементе. Термодинамический вывод уравнения для определения электродного потенциала, уравнение Нернста.
- •29. Термодинамика гальванических элементов.
- •30. Водородный скачок потенциала. Стандартные электродные потенциалы.
- •31. Виды гальванических элементов. Электроды 1-го и 2-го рода. Обратимые, необратимые цепи. Знаки эдс-элементов. Вычисление эдс обратимого гальванического элемента.
- •32. Окислительно-восстановительные электроды или редокс-элементы.
- •33. Химические цепи. Уравнение для расчета эдс.
- •34. Концентрационные цепи. Уравнение для расчета эдс
- •35. Диффузионный скачок потенциала.
- •36. Потенциометрическое титрование. Электрохимические методы определения рН растворов.
- •37. Основные понятия химической кинетики: молекулярность, скорость реакции (начальная, истинная и средняя), константа скорости.
- •38. Вывести уравнение Аррениуса. Энергия активации. Предэкспоненциальный множитель. Методы их определения.
- •39. Порядок реакции по реагенту и методы его экспериментального определения. Лимитирующая стадия химического процесса.
- •40. Вывод интегрального кинетического уравнения для необратимой и обратимой реакции первого порядка.
- •41. Вывод интегрального кинетического уравнения для необратимой реакции второго порядка.
- •42. Вывести уравнение кинетики для параллельных реакций.
- •43. Вывести уравнение кинетики для гомогенной необратимой последовательной реакции первого порядка
- •44. Вывести уравнение скорости процесса в потоке, режим идеального вытеснения в стационарных условиях.
- •45. Кинетика гомогенных реакций первого порядка, протекающих в условиях идеального перемешивания.
- •46. Теория активных соударений и расчет скорости по числу соударений.
- •47. Теория переходного состояния и вывод основного уравнения.
- •48. Связь константы скорости реакции с энтальпией и энтропией активации.
- •49.Цепные р-ии, основные понятия, основные стадии и типы р-ий.
- •50.Кинетика р-ий с неразветвленными цепями.
- •51.Вывод кинетических уравнений цепных р-ий в стационарном приближении
- •52.Пределы воспламенения и взрыва. Механизмы вопламенения.
- •53. Связь кинетики и макрокинетики при протекании экзотермических реакций (теория теплового взрыва)
- •54. Законы и кинетика фотохимических р-ий. Примеры р-ий с различным квантовым выходом. Сенсибилизированные р-ии.
- •55.Особенности кинетики р-ий в р-рах. Влияние природы р-рителя на скорость процесса, ур-ие Бренстеда.
- •56. Влияние ионной силы и давления на кинетику реакций в растворе.
- •57.Основные признаки катализа.
- •58.Общий и специфич. Кислотно-основ.Катализ.
- •59.Катализ комплексами переходных металлов и ферментатив.Катализ.
- •60.Кинетика гомогенных катал. Р-ций
- •61. Гетерогенный катализ. Понятие о катализаторах, носителях и промоторах..
- •62.Области протекания гетероген.Катал.Р-ций.
- •63.Температурная зависимость наблюдаемой скорости реакции
- •66.Кинетика гетерогенных каталитических реакций, проводимых в реакторе идеального вытеснения.
- •68.Основные теории катализа: мультиплетная, ансамблей, электронная, радикальная.
- •69. Основные принципы твердых катализаторов.
- •70.Топохимические реакции.
17. Дифферинциальный термический анализ (дта)
ДТА – это нахождение зависимости между температурой плавления вещества и его свойствами.Метод позволяет изучать фазовый состав Ме систем, природных минералов, устанавливать тем-ые границы сущ-ия многих соединений (соли, полимеры), определять теплоты фазовых превращений, теплопров-ть, теплоемкость.
Метод основан на автоматической записи дифференциальной термопарой термограмм – кривых ∆Т – Т, где ∆Т – разность температур м/у исследуемым веществом и эталоном, нагреваемых или охлаждаемых в одинаковых условиях; Т – температура образца или время нагревания/охлаждения. Эталон – в-во, не имеющее фазовых превращений в исследуемом интервале температур.
Вид термограммы исследуемого в-ва зависит от свойств самого в-ва (состав, структура, теплопроводность, теплоемкость, дисперсность и др.) и от условий снятия термограммы (скорость нагревания, величина навески, плотность набития в-ва в тигле, положения спая в образце и в эталоне, свойства эталона, чувствительность в цепи дифференциальной термопары).
- если теплофизические св-ва эталона и исследуемого в-ва совпадают и последнее при нагревании не испытывает никаких превращений, то ∆Т=0, и термограмма им. вид прямой линии (1) – нулевая линия;
- если исследуемое в-во отличается от эталона своими теплофизическими свойствами, то термограмма (2) отклонится от нулевой линии и регистрируется || оси абсцисс или под углом к ней – базисная линия.
- если в процессе нагревания в образце происходит при к.-л. температуре фазовое превращение или хим. изменение с выделением или поглощением теплоты, то возникает ∆Т, пропорционально кол-ву поглощенной/выделенной теплоты. Возникшая разность температур регистрируется отклонением кривой ДТА вверх или вниз от базисной линии (3) – термический эффект. Согласно методике, отклонение ↑ - экзотермический, ↓ - эндотермический эффект.
Экзотермические эффекты (с выделением Q) могут быть обусловлены переходом из неравновесного состояния в равновесное, наприм. переход из аморфного состояния в кристаллическое.
Эндотермические эффекты (с поглощением Q) связаны с фазовыми превращениями (плавление, испарение, возгонка, полиморфные превращения) или химическими процессами (окисление, разложение, дегидратация, диссоциация и др.). При нагревании большинства веществ наблюдается несколько превращений, которые регистрируются на кривой ДТА при соответствующих температурах термическими эффектами, характерными для данного в-ва.
По термограмме можно дать качественную характеристику исследуемому в-ву, определить температуры фазовых превращений или химических процессов, измерить тепловой эффект процесса.
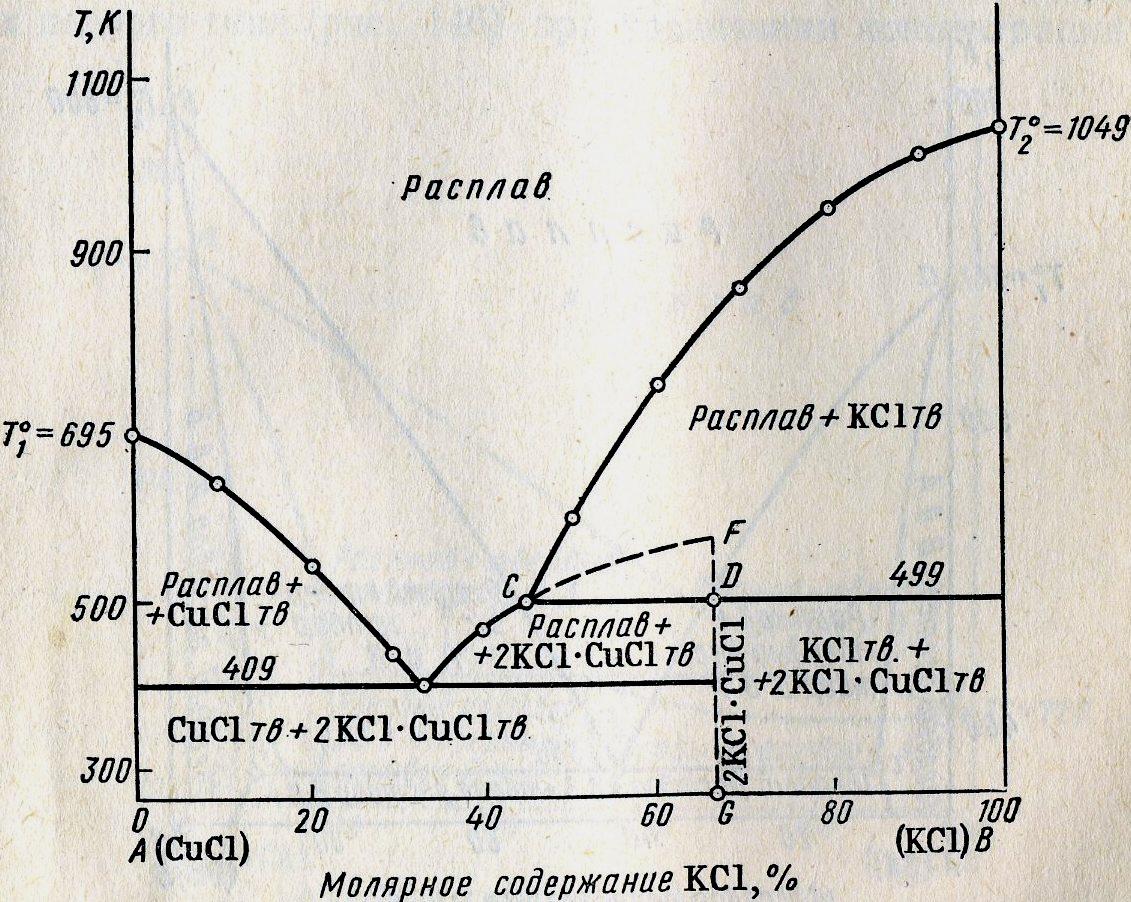
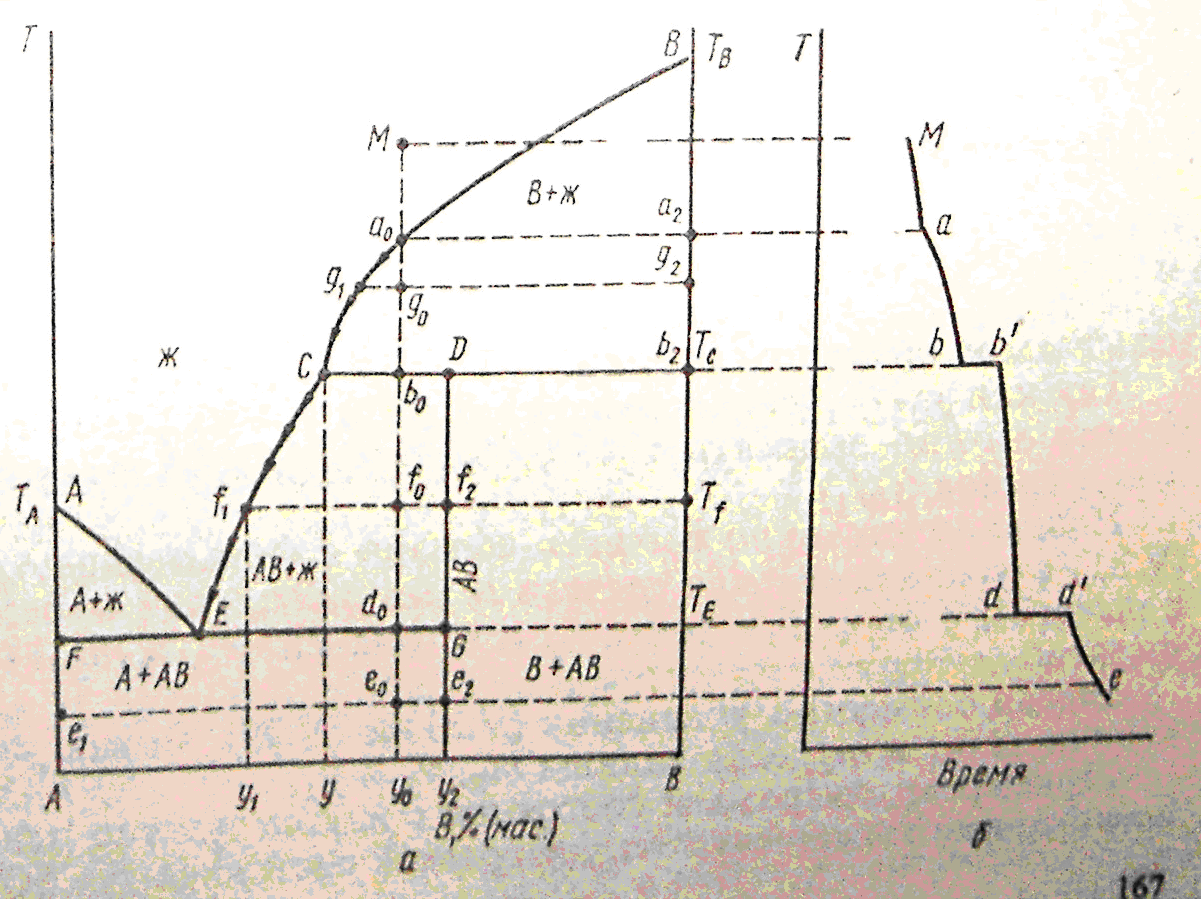
18Диаграммы плавкости систем с конгруэнтно и инконгруэнтно плавящимися соединениями.
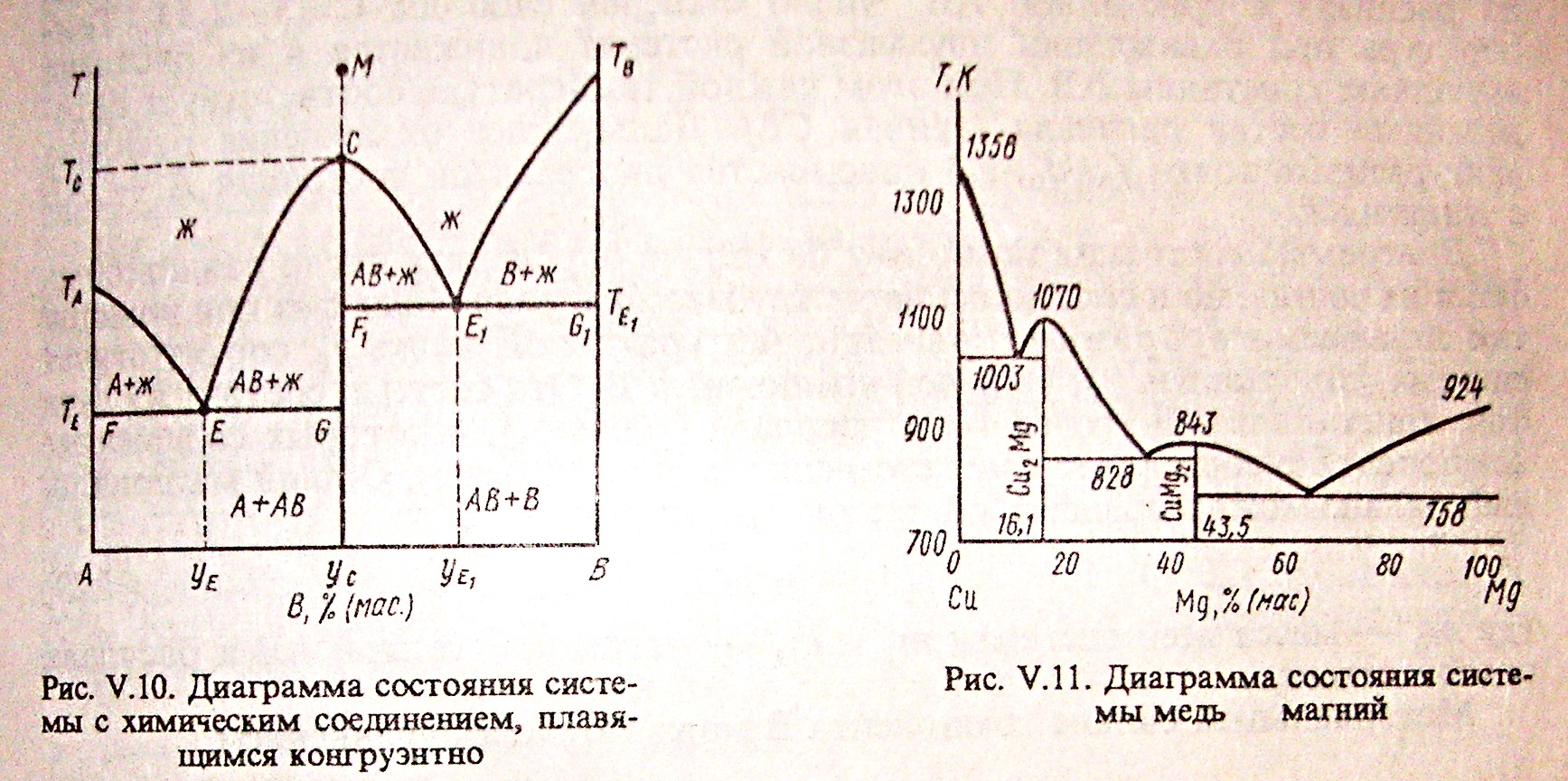
Если компоненты А и В могут образовывать тв. хим. соединение АВ, плавящееся без разложения, т.е. конгруэнтно, то на диаграмме состояния кривая ликвидуса образует максимумы в точке С, когда состав кристаллической фазы совпадает с составом жид. фазы. По обе стороны от точки С нах-ся эвтектики Е и Е1. Если состав системы находится между чистым компонентом А и химическим соединением АВ, то при эвтектической температуре ТЕ, расплав состава уЕ сосуществует с кристаллами А и АВ. Если состав системы лежит между хим. соед. АВ и компонентом В, то при ТЕ1 расплав состава уЕ1 сосуществует с кристаллами АВ и В. Т.о. рассмотренная диаграмма состояния – сочетание 2-х диаграмм состояния с эвтектикой А – АВ и АВ – В.
Процесс охлаждения расплава, заданного точкой М. При этом составе число независимых комп-ов = 1, т.к. система может быть образована только из одного хим. соед. АВ. При ТС из расплава выпадают кристаллы АВ (Ф=2) и число степ. своб. С=1-2+1=0, т.е. система безвариантна и кристаллизуется при постоянной температуре.

Хим. соед-ия при достижении определенной температуры начинают плавиться, распадаясь на кристаллическую и жидкую фазы, составы которых не совпадают. Если компоненты А и В образуют твердое химическое соединение АВ, плавящееся с разложением, т.е. инконгруэнтно, то АВ устойчиво только ниже ТС. При малейшем ↑ t-ры это твердое соединение распадается и образуются 2 фазы: кристаллы В и расплав состава у (точка С).При охлаждении расплава состава М в точке а0 начнется выделение кристаллов компонента В. В интервале температур от а0 до b0 сист. явл. 2-х фазной и одновариантной: С=2-2+1=1. В точке b0 при ТС начинается и продолжается кристаллизация соединение АВ, состав которого соответствует у2 (т. D). В равновесии 3 фазы: расплав, кристаллы АВ и В. С=2-3+1=0 – постоянство ТС, состава раствора у (т. С) и состава хим. соединения у2 (т.D).
Чтобы состав расплава не изменялся, одновременно с кристаллизацией АВ ранее выпавшие кристаллы В должны раств-ся, поддерживая постоянным соединение компонента В в расплаве. Т. С наз-ся перитектикой (переходной), ТС - перитектическая температура. В этой точке находятся в равновесии расплав и 2 тверд. фазы, но в отличается от эвтектики, (где одновременно выпадают 2 тв. фазы) одна тв. фаза выпадает, а другая растворяется. На кривой охлаждения наблюдается горизонтальный участок (bb’).
Процесс охлаждения в точке b0 заканчивается растворением всех ранее выпавших кристаллов В. Остается 2-х фазная система, состоящая из расплава и кристаллов АВ. При этом каждой температуре соответствует определенный состав расплава (СЕ). Дальнейшее охлаждение описывается диаграммой состояния А-АВ с эвтектикой.