
- •Оглавление
- •1.Факторы, влияющие на растворимость газов.
- •2.Зависимость растворимости газа от температуры.
- •3.Факторы,влияющие на растворимость газов в жидкостях
- •4.Типы растворов жидкостей в жидкостях, причины их разнообразия.
- •5.Идеальные растворы. Построение их диаграммы «давление – состав», температура кипения – состав.
- •6.Вывод зависимости давления насыщенного пара смеси от состава жидкой и паровой фаз.
- •7. Реальные р-ры жидкостей неограниченно растворимые друг в друге. Причины отклонения давления паров над раствором от з-на Рауля.
- •8.Диаграммы давление –состав и температура – состав для реaльных растворов
- •9.Первый з-н Конавалова
- •10.Методы разделения смесей. Ректификация.
- •11. Диаграмма состояния р-ров ,образующих азеотропы.2й з-н Коновалова.
- •12.Диаграмма «давление – состав» и «температура – состав» Жидкости, ограниченно растворимых друг в друге.
- •13.Диаграммы “Давление-состав” и “температура-состав” для жидкостей, взаимно нерастворимых друг в друге.
- •14. Закон распределения Шилова-Нернста. Экстракция.
- •15. Трехкомпанентные системы. Графическое представление. Определение методами Розебома и Гиббса.
- •16.Диаграмма плавкости 2-х компонентных систем с огранич-ной растворимостью в твердом состоянии. Эвтектика.
- •17. Дифферинциальный термический анализ (дта)
- •18Диаграммы плавкости систем с конгруэнтно и инконгруэнтно плавящимися соединениями.
- •19.Проводимость в газах, жидкостях и твердых телах. Электропроводность удельная и эквивалентная. Основные полож-я теории сильных эл-тов. Термодтнамика р-ров сильных эл-тов.
- •20. Скорость движ-ния иона,абсолютная ск-сть движ-я иона,подвижность.
- •21. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
- •23.Влияние различных факторов на электропроводность для р-ров сильных электролитов.
- •24.Уравнение Кольрауша для слабых и сильных электролитов. Числа переноса.
- •25. Ионная сила р-ра. Ионный радиус, ионная атмосфера. Электрофоретическое и релаксационное торможение. Эффект Вина,понятие дисперсии электропроводности.
- •26. Активности и коэффициенты активности электролитов. Вычисление средних коэффициентов активности ионов.
- •27. Кондуктометрическое титрование как метод определения точки эквивалентности при титровании, изменения состава растворов для расчета степени диссоциации, констант диссоциации.
- •28. Понятие об электродвижущих силах, полуэлементе, элементе. Термодинамический вывод уравнения для определения электродного потенциала, уравнение Нернста.
- •29. Термодинамика гальванических элементов.
- •30. Водородный скачок потенциала. Стандартные электродные потенциалы.
- •31. Виды гальванических элементов. Электроды 1-го и 2-го рода. Обратимые, необратимые цепи. Знаки эдс-элементов. Вычисление эдс обратимого гальванического элемента.
- •32. Окислительно-восстановительные электроды или редокс-элементы.
- •33. Химические цепи. Уравнение для расчета эдс.
- •34. Концентрационные цепи. Уравнение для расчета эдс
- •35. Диффузионный скачок потенциала.
- •36. Потенциометрическое титрование. Электрохимические методы определения рН растворов.
- •37. Основные понятия химической кинетики: молекулярность, скорость реакции (начальная, истинная и средняя), константа скорости.
- •38. Вывести уравнение Аррениуса. Энергия активации. Предэкспоненциальный множитель. Методы их определения.
- •39. Порядок реакции по реагенту и методы его экспериментального определения. Лимитирующая стадия химического процесса.
- •40. Вывод интегрального кинетического уравнения для необратимой и обратимой реакции первого порядка.
- •41. Вывод интегрального кинетического уравнения для необратимой реакции второго порядка.
- •42. Вывести уравнение кинетики для параллельных реакций.
- •43. Вывести уравнение кинетики для гомогенной необратимой последовательной реакции первого порядка
- •44. Вывести уравнение скорости процесса в потоке, режим идеального вытеснения в стационарных условиях.
- •45. Кинетика гомогенных реакций первого порядка, протекающих в условиях идеального перемешивания.
- •46. Теория активных соударений и расчет скорости по числу соударений.
- •47. Теория переходного состояния и вывод основного уравнения.
- •48. Связь константы скорости реакции с энтальпией и энтропией активации.
- •49.Цепные р-ии, основные понятия, основные стадии и типы р-ий.
- •50.Кинетика р-ий с неразветвленными цепями.
- •51.Вывод кинетических уравнений цепных р-ий в стационарном приближении
- •52.Пределы воспламенения и взрыва. Механизмы вопламенения.
- •53. Связь кинетики и макрокинетики при протекании экзотермических реакций (теория теплового взрыва)
- •54. Законы и кинетика фотохимических р-ий. Примеры р-ий с различным квантовым выходом. Сенсибилизированные р-ии.
- •55.Особенности кинетики р-ий в р-рах. Влияние природы р-рителя на скорость процесса, ур-ие Бренстеда.
- •56. Влияние ионной силы и давления на кинетику реакций в растворе.
- •57.Основные признаки катализа.
- •58.Общий и специфич. Кислотно-основ.Катализ.
- •59.Катализ комплексами переходных металлов и ферментатив.Катализ.
- •60.Кинетика гомогенных катал. Р-ций
- •61. Гетерогенный катализ. Понятие о катализаторах, носителях и промоторах..
- •62.Области протекания гетероген.Катал.Р-ций.
- •63.Температурная зависимость наблюдаемой скорости реакции
- •66.Кинетика гетерогенных каталитических реакций, проводимых в реакторе идеального вытеснения.
- •68.Основные теории катализа: мультиплетная, ансамблей, электронная, радикальная.
- •69. Основные принципы твердых катализаторов.
- •70.Топохимические реакции.
66.Кинетика гетерогенных каталитических реакций, проводимых в реакторе идеального вытеснения.
Реакторы проточного типа могут применяться двух типов: пустотелые или имеющие распределительные решетки. Процессы в таких реакторах проходят в потоке, в реакторе идеального вытеснения реакционной смеси с неподвижным слоем катализатора или в потоке. В этом случае через слой неподвижного шарикового или движущегося с малой скоростью катализатора сырье проходит в поршневом режима, то есть, когда предыдущий слой сырья вытесняет передний его фронт.
Скорость гетерогенной каталитической для режима идеального вытеснения
Гидродинамический РИВ реакционной смеси может соблюдаться для реактора, в котором отношение длины его к диаметру больше пятидесяти (l / d > 50). Уравнения скорости реакций, протекающей в потоке, можно получит на основе анализа уравнения потока массы веществ.
Гомогенный поток массы веществ в нестационарных условиях, находящийся под воздействием конвективной силы к в котором проходит химическая реакция:
![]() (1),где
(1),где
![]() - объемно-молекулярная концентрация,
NA, VA-мольная и объемная скорости подача
веществ,V - линейная скорость перемещения
потока веществ,
- объемно-молекулярная концентрация,
NA, VA-мольная и объемная скорости подача
веществ,V - линейная скорость перемещения
потока веществ,
w - скорость химической реакции в гомогенной системе, τ-время.
Для перехода к уравнению потока массы веществ через слой зернистого катализатора необходимо учитывать тот факт, что вещество перемещается только между зернами катализатора.
Вводим коэффициент
![]() ,
определяющий долю площади реактора,
свободной от катализатора.
,
определяющий долю площади реактора,
свободной от катализатора.
S0V-площадь единицы объема катализатора. Умножим уравнение (1) на /S0V
![]()
Введем обозначение![]()
Запашем концентрацию и лилейную скорость
через соотношения:
;
V=Va/Ps*χ. Ps-площадь раствора в сечении
Получим:
![]()
Для стащюиарных условий (для равномерной
подачи сырья в реактор) концентрация
вещества А не меняется со временем по
длине реактора И тогда первая производная
по времени будет равна нулю
![]()
Уравнение потока массы веществ для
стационарных условий:
![]()
Уравнение скорости химической реакции,
протекающей в потоке, в гетерогенной,
системе, для РИВ. Если количество
непрореагировавшего вещества А
обозначить как
![]() ,
тогда
,
тогда
![]() n0а –мольн.скорость подачи А.
n0а –мольн.скорость подачи А.
х-превращение, моль/моль. Это ураанв&ао скорости было выведено впервые АД,Баландиным и повторено с теоретическим выводом Г.М.Дакчевкоаым,
Скорость гетерогенной каталитической
реакции зависит от количества
сорбированного катализатором вещества,
от давления, темперы, природы катализатора,
наличия в реакционной смеси
астехиометрических компонентов и
других факторов. Скорость гетерогенной
каталитической реакции будет прямо
пропорциональна поверхностной
концентрации реагирующих веществ,
возведенных в степень соответствующих
порядку реакции. Для
![]() Уравнение кинетики.:
Уравнение кинетики.:
![]()
П-знак произведения., θ-относительные поверхностные концентрации веществ.
67.Связь м\у истинной и кажущ-ся энериями активации.
Если построить на основании экспер-ных
данных график завис-ти кажущ-ся константы
скорости k* от 1/T,то получ-ся прямая,опис-мая
ур-ем:lnk*=-E*/RT+lnc или dlnk*/dt=E*/RT2(1),где
E*-кажущ-ся Еа.Найдём завис-ть м\у Еа и
E*. k*=kK.Адсорбцион.коэф-т(константа
рав-сия) К равен отнош. констант скоростей
пр-сов адс-ции и десорб-ции:К=k1/k2, k*=k∙
k1/k2(2).Каждая из констант,входящих в
(2),явл-ся функцией тем-ры.Т.к.
k1=C’/√T(C’-величина постоянная),
k2=C”e-λ/RT(3)(C”-велич.постоян.,λ-т-та
адсорбции),k=Ce-E/RT(4).Константа скорости
пр-са адс-ции k1 с тем-рой измен-ся очень
мало по срав-ю с k и k2.Завис-тью k1 от
тем-ры можно пренебречь и считать,что
эта величина постоянная.Подставив (3)
и (4) в (2):k*=Ce-E/RT∙k1/(C’e-λ/RT)→lnk*=-E/RT+λ/RT+lnconst
(const=Ck1/C’). Дифференц-ем по
Т:dlnk*/dT=(E-λ)/RT2(5)/Сравнивая (5) и (1),видим:
Е*=Е-λ(6).Это выр-е хар-ет завис-ть кажущ-ся
Еа от истин. Е* меньше Еа на величину
т-ты адс-ции реагир.в-ва.Для простешей
р-ции А→В на пов-ти тв.К можно выделить
с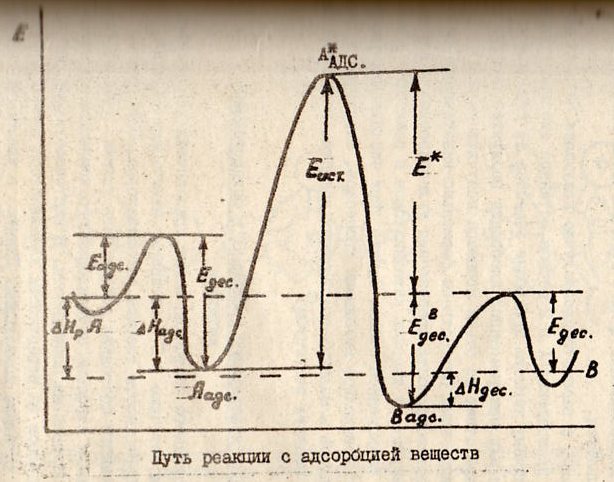 тадии:А→Аадс→А*адс
→Вадс→В. Вначале м-лы в-ва А адс-ся на
пов-ти тв.К,преодолевая энерг.барьер
Еадс.Выделяя избыток энергии в форме
т-ты адс-ции,м-ла может перейти в более
уст-вое адсор-ное сост.Аадс.На новом
кат-ком центре или под воздействием
актив.центра К м-ла А может перейти в
электронно-возбуждённое сост с переходом
на энергетический барьер высотою
Еист.(А*адс).Возбуждённые м-лы А,скатываясь
в ложбину продукта р-ции,превращсяв
прод.р-ции.При этом м-ла В переходит в
адсорбир.сост.Для десорбции м-лы В с
актив.ц. ей необх-мо преодолеть энергию
ЕВадс.После чего м-ла В может уйти с
каталит.центра в объём реакцион.смеси.
тадии:А→Аадс→А*адс
→Вадс→В. Вначале м-лы в-ва А адс-ся на
пов-ти тв.К,преодолевая энерг.барьер
Еадс.Выделяя избыток энергии в форме
т-ты адс-ции,м-ла может перейти в более
уст-вое адсор-ное сост.Аадс.На новом
кат-ком центре или под воздействием
актив.центра К м-ла А может перейти в
электронно-возбуждённое сост с переходом
на энергетический барьер высотою
Еист.(А*адс).Возбуждённые м-лы А,скатываясь
в ложбину продукта р-ции,превращсяв
прод.р-ции.При этом м-ла В переходит в
адсорбир.сост.Для десорбции м-лы В с
актив.ц. ей необх-мо преодолеть энергию
ЕВадс.После чего м-ла В может уйти с
каталит.центра в объём реакцион.смеси.
