
- •Оглавление
- •1.Факторы, влияющие на растворимость газов.
- •2.Зависимость растворимости газа от температуры.
- •3.Факторы,влияющие на растворимость газов в жидкостях
- •4.Типы растворов жидкостей в жидкостях, причины их разнообразия.
- •5.Идеальные растворы. Построение их диаграммы «давление – состав», температура кипения – состав.
- •6.Вывод зависимости давления насыщенного пара смеси от состава жидкой и паровой фаз.
- •7. Реальные р-ры жидкостей неограниченно растворимые друг в друге. Причины отклонения давления паров над раствором от з-на Рауля.
- •8.Диаграммы давление –состав и температура – состав для реaльных растворов
- •9.Первый з-н Конавалова
- •10.Методы разделения смесей. Ректификация.
- •11. Диаграмма состояния р-ров ,образующих азеотропы.2й з-н Коновалова.
- •12.Диаграмма «давление – состав» и «температура – состав» Жидкости, ограниченно растворимых друг в друге.
- •13.Диаграммы “Давление-состав” и “температура-состав” для жидкостей, взаимно нерастворимых друг в друге.
- •14. Закон распределения Шилова-Нернста. Экстракция.
- •15. Трехкомпанентные системы. Графическое представление. Определение методами Розебома и Гиббса.
- •16.Диаграмма плавкости 2-х компонентных систем с огранич-ной растворимостью в твердом состоянии. Эвтектика.
- •17. Дифферинциальный термический анализ (дта)
- •18Диаграммы плавкости систем с конгруэнтно и инконгруэнтно плавящимися соединениями.
- •19.Проводимость в газах, жидкостях и твердых телах. Электропроводность удельная и эквивалентная. Основные полож-я теории сильных эл-тов. Термодтнамика р-ров сильных эл-тов.
- •20. Скорость движ-ния иона,абсолютная ск-сть движ-я иона,подвижность.
- •21. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
- •23.Влияние различных факторов на электропроводность для р-ров сильных электролитов.
- •24.Уравнение Кольрауша для слабых и сильных электролитов. Числа переноса.
- •25. Ионная сила р-ра. Ионный радиус, ионная атмосфера. Электрофоретическое и релаксационное торможение. Эффект Вина,понятие дисперсии электропроводности.
- •26. Активности и коэффициенты активности электролитов. Вычисление средних коэффициентов активности ионов.
- •27. Кондуктометрическое титрование как метод определения точки эквивалентности при титровании, изменения состава растворов для расчета степени диссоциации, констант диссоциации.
- •28. Понятие об электродвижущих силах, полуэлементе, элементе. Термодинамический вывод уравнения для определения электродного потенциала, уравнение Нернста.
- •29. Термодинамика гальванических элементов.
- •30. Водородный скачок потенциала. Стандартные электродные потенциалы.
- •31. Виды гальванических элементов. Электроды 1-го и 2-го рода. Обратимые, необратимые цепи. Знаки эдс-элементов. Вычисление эдс обратимого гальванического элемента.
- •32. Окислительно-восстановительные электроды или редокс-элементы.
- •33. Химические цепи. Уравнение для расчета эдс.
- •34. Концентрационные цепи. Уравнение для расчета эдс
- •35. Диффузионный скачок потенциала.
- •36. Потенциометрическое титрование. Электрохимические методы определения рН растворов.
- •37. Основные понятия химической кинетики: молекулярность, скорость реакции (начальная, истинная и средняя), константа скорости.
- •38. Вывести уравнение Аррениуса. Энергия активации. Предэкспоненциальный множитель. Методы их определения.
- •39. Порядок реакции по реагенту и методы его экспериментального определения. Лимитирующая стадия химического процесса.
- •40. Вывод интегрального кинетического уравнения для необратимой и обратимой реакции первого порядка.
- •41. Вывод интегрального кинетического уравнения для необратимой реакции второго порядка.
- •42. Вывести уравнение кинетики для параллельных реакций.
- •43. Вывести уравнение кинетики для гомогенной необратимой последовательной реакции первого порядка
- •44. Вывести уравнение скорости процесса в потоке, режим идеального вытеснения в стационарных условиях.
- •45. Кинетика гомогенных реакций первого порядка, протекающих в условиях идеального перемешивания.
- •46. Теория активных соударений и расчет скорости по числу соударений.
- •47. Теория переходного состояния и вывод основного уравнения.
- •48. Связь константы скорости реакции с энтальпией и энтропией активации.
- •49.Цепные р-ии, основные понятия, основные стадии и типы р-ий.
- •50.Кинетика р-ий с неразветвленными цепями.
- •51.Вывод кинетических уравнений цепных р-ий в стационарном приближении
- •52.Пределы воспламенения и взрыва. Механизмы вопламенения.
- •53. Связь кинетики и макрокинетики при протекании экзотермических реакций (теория теплового взрыва)
- •54. Законы и кинетика фотохимических р-ий. Примеры р-ий с различным квантовым выходом. Сенсибилизированные р-ии.
- •55.Особенности кинетики р-ий в р-рах. Влияние природы р-рителя на скорость процесса, ур-ие Бренстеда.
- •56. Влияние ионной силы и давления на кинетику реакций в растворе.
- •57.Основные признаки катализа.
- •58.Общий и специфич. Кислотно-основ.Катализ.
- •59.Катализ комплексами переходных металлов и ферментатив.Катализ.
- •60.Кинетика гомогенных катал. Р-ций
- •61. Гетерогенный катализ. Понятие о катализаторах, носителях и промоторах..
- •62.Области протекания гетероген.Катал.Р-ций.
- •63.Температурная зависимость наблюдаемой скорости реакции
- •66.Кинетика гетерогенных каталитических реакций, проводимых в реакторе идеального вытеснения.
- •68.Основные теории катализа: мультиплетная, ансамблей, электронная, радикальная.
- •69. Основные принципы твердых катализаторов.
- •70.Топохимические реакции.
47. Теория переходного состояния и вывод основного уравнения.
В модели активного комплекса предполагается, что исходная конфигурация реагирующих частиц, обладающих достаточной энергией для преодоления барьера реакции, преобразуется при непрерывном изменении межатомных расстояний и соответствующей энергии системы в активный комплекс, который обязательно превращается в продукты реакции:
АА + В → {ААВ}
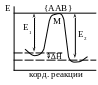 Для
превращения исходных молекул АА и В в
продукты они должны образовать активный
комплекс {ААВ}, в нем старые связи
разрыхлены и наметились новые, но их
конфигурация и энергия не соответствуют
стабильным молекулам.
Для
превращения исходных молекул АА и В в
продукты они должны образовать активный
комплекс {ААВ}, в нем старые связи
разрыхлены и наметились новые, но их
конфигурация и энергия не соответствуют
стабильным молекулам.
E1 и Е2 – энергия активации прямой и обратной реакций
∆Н = Е1-Е – теплота реакции
Вначале АА и В поднимаются до точки М, которая представляет собой энергетический перевал, затем активный комплекс распадается и молекулы А и АВ «скатываются вниз» в потенциальную яму.
Активный комплекс находится в состоянии равновесия с исходными веществами, причем одна из колебательных степеней свободы вырождается в поступательную по координатам реакции и дальше активный комплекс необратимо превращается в продукты. Прямой и обратный процессы с образованием активного комплекса протекают независимо друг от друга.
Скорость реакции согласно теории будет равна числу активных комплексов, проходящих через потенциальный барьер вдоль координаты реакции в единицу времени, в еденице реакционного пространства.
В соответствии с теорией, скорость реакции будет равна числу активированных комплексов, проходящих через потенциальный барьер вдоль координаты реакции в единицу времени, в единице реакционного пространства. Следует также учесть вероятность прохода через барьер со скоростью u*, введя так называемый трансмиссионный коэффициент χ:
r = χCК*/τ или r = χCК*u*/δ (3.10)
С другой стороны, скорость бимолекулярной реакции можно выразить, используя 1й постулат кинетики:
r = kCАCВ (3.11)
или, исключая скорость из уравнений 10 и 11, можно найти величину константы:
![]() (3.12)
(3.12)
В этом уравнении величины u*,δ и CК* нельзя определить экспериментально, но можно выразить через определяемые величины, используя аппарат статистической термодинамики для равновесных процессов. Так, концентрацию активированного комплекса находим из условия равновесия:
CК* = К*САCВ (3.13)
и получим выражение
k = χu*δ-1К* (3.14)
Скорость прохода активированного комплекс через барьер, выразим согласно молекулярно-кинетической теории:
![]() (3.15)
(3.15)
Выделим поступательную сумму по состояниям из выражения константы равновесия
QП*= δh-1(2πm*RT/NA)1/2, (3.16)
где h – постоянная Планка, и определим константу равновесия КС* без одной поступательной степени свободы как
Кс* = К*/QП* (3.17)
Подставим (3.15) - (3.17) в (3.14) и получим искомое выражение для константы скорости:
k =χRTh-1NA-1Кс* (3.18)
Для уточнения физического смысла используемых ранее терминов энергии активации, предэкспоненциального множителя k0, и стерического фактора преобразуем (3.18), выразив константу равновесия через энергию Гиббса
![]() ,
а энергию Гиббса - в виде
,
а энергию Гиббса - в виде
∆Go* = ∆Ho* - T∆So*
![]() (3.19)
(3.19)
Это – основное уравнение теории активированного комплекса.
Из уравнения (19) видно, что величина предэкспоненциального множителя
k0=χRTh-1NA-1.exp(∆So*/R) (3.20)
зависит от частоты колебаний активированного комплекса и изменения энтропии при его образовании.
Для нахождения связи между энергией активации и теплотой активации АК (∆Ho*) прологарифмируем (3.18)
![]() и возьмем производную по температуре:
и возьмем производную по температуре:
![]() (3.21)
(3.21)
Как видно из (3.21) энергия активации реакции Е равна сумме энтальпии активации активированного комплекса и RТ:
Е = ∆Ho*+ RТ (3.22)
Уравнение теории АК можно использовать для расчета предэкспоненциального множителя k0 в случае простых реакций (или оценки для сложных реакций).
Рассмотрим простой случай мономолекулярной реакции:
А A* B
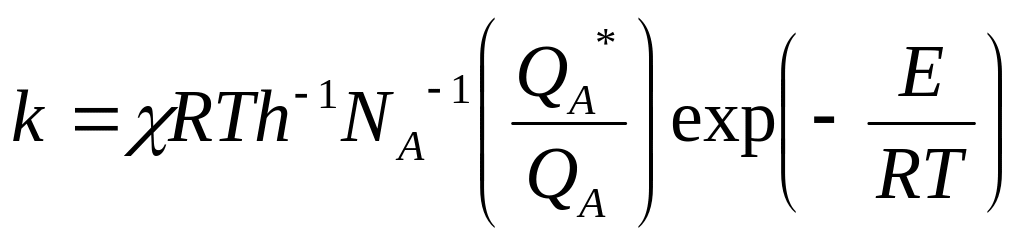 (3.23)
(3.23)
Поскольку суммы по состояниям для А и А* различаются на одну колебательную степень свободы, их отношение равно:
![]() (3.24)
(3.24)
величина
![]() <<
1 при Т > 1000K, и в этой области температур
<<
1 при Т > 1000K, и в этой области температур
![]() (3.25)
(3.25)
подставляя (3.24) в (3.23) получим:
![]() (3.26)
(3.26)
Откуда видно, что k0 = χν, т.е. предэкспоненциальный множитель по порядку величины равен частоте колебаний разрываемой связи. В табл. 4 приведены значения предэкспоненциального множителя типичных мономолекулярных реакций.
