
- •Оглавление
- •1.Факторы, влияющие на растворимость газов.
- •2.Зависимость растворимости газа от температуры.
- •3.Факторы,влияющие на растворимость газов в жидкостях
- •4.Типы растворов жидкостей в жидкостях, причины их разнообразия.
- •5.Идеальные растворы. Построение их диаграммы «давление – состав», температура кипения – состав.
- •6.Вывод зависимости давления насыщенного пара смеси от состава жидкой и паровой фаз.
- •7. Реальные р-ры жидкостей неограниченно растворимые друг в друге. Причины отклонения давления паров над раствором от з-на Рауля.
- •8.Диаграммы давление –состав и температура – состав для реaльных растворов
- •9.Первый з-н Конавалова
- •10.Методы разделения смесей. Ректификация.
- •11. Диаграмма состояния р-ров ,образующих азеотропы.2й з-н Коновалова.
- •12.Диаграмма «давление – состав» и «температура – состав» Жидкости, ограниченно растворимых друг в друге.
- •13.Диаграммы “Давление-состав” и “температура-состав” для жидкостей, взаимно нерастворимых друг в друге.
- •14. Закон распределения Шилова-Нернста. Экстракция.
- •15. Трехкомпанентные системы. Графическое представление. Определение методами Розебома и Гиббса.
- •16.Диаграмма плавкости 2-х компонентных систем с огранич-ной растворимостью в твердом состоянии. Эвтектика.
- •17. Дифферинциальный термический анализ (дта)
- •18Диаграммы плавкости систем с конгруэнтно и инконгруэнтно плавящимися соединениями.
- •19.Проводимость в газах, жидкостях и твердых телах. Электропроводность удельная и эквивалентная. Основные полож-я теории сильных эл-тов. Термодтнамика р-ров сильных эл-тов.
- •20. Скорость движ-ния иона,абсолютная ск-сть движ-я иона,подвижность.
- •21. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
- •23.Влияние различных факторов на электропроводность для р-ров сильных электролитов.
- •24.Уравнение Кольрауша для слабых и сильных электролитов. Числа переноса.
- •25. Ионная сила р-ра. Ионный радиус, ионная атмосфера. Электрофоретическое и релаксационное торможение. Эффект Вина,понятие дисперсии электропроводности.
- •26. Активности и коэффициенты активности электролитов. Вычисление средних коэффициентов активности ионов.
- •27. Кондуктометрическое титрование как метод определения точки эквивалентности при титровании, изменения состава растворов для расчета степени диссоциации, констант диссоциации.
- •28. Понятие об электродвижущих силах, полуэлементе, элементе. Термодинамический вывод уравнения для определения электродного потенциала, уравнение Нернста.
- •29. Термодинамика гальванических элементов.
- •30. Водородный скачок потенциала. Стандартные электродные потенциалы.
- •31. Виды гальванических элементов. Электроды 1-го и 2-го рода. Обратимые, необратимые цепи. Знаки эдс-элементов. Вычисление эдс обратимого гальванического элемента.
- •32. Окислительно-восстановительные электроды или редокс-элементы.
- •33. Химические цепи. Уравнение для расчета эдс.
- •34. Концентрационные цепи. Уравнение для расчета эдс
- •35. Диффузионный скачок потенциала.
- •36. Потенциометрическое титрование. Электрохимические методы определения рН растворов.
- •37. Основные понятия химической кинетики: молекулярность, скорость реакции (начальная, истинная и средняя), константа скорости.
- •38. Вывести уравнение Аррениуса. Энергия активации. Предэкспоненциальный множитель. Методы их определения.
- •39. Порядок реакции по реагенту и методы его экспериментального определения. Лимитирующая стадия химического процесса.
- •40. Вывод интегрального кинетического уравнения для необратимой и обратимой реакции первого порядка.
- •41. Вывод интегрального кинетического уравнения для необратимой реакции второго порядка.
- •42. Вывести уравнение кинетики для параллельных реакций.
- •43. Вывести уравнение кинетики для гомогенной необратимой последовательной реакции первого порядка
- •44. Вывести уравнение скорости процесса в потоке, режим идеального вытеснения в стационарных условиях.
- •45. Кинетика гомогенных реакций первого порядка, протекающих в условиях идеального перемешивания.
- •46. Теория активных соударений и расчет скорости по числу соударений.
- •47. Теория переходного состояния и вывод основного уравнения.
- •48. Связь константы скорости реакции с энтальпией и энтропией активации.
- •49.Цепные р-ии, основные понятия, основные стадии и типы р-ий.
- •50.Кинетика р-ий с неразветвленными цепями.
- •51.Вывод кинетических уравнений цепных р-ий в стационарном приближении
- •52.Пределы воспламенения и взрыва. Механизмы вопламенения.
- •53. Связь кинетики и макрокинетики при протекании экзотермических реакций (теория теплового взрыва)
- •54. Законы и кинетика фотохимических р-ий. Примеры р-ий с различным квантовым выходом. Сенсибилизированные р-ии.
- •55.Особенности кинетики р-ий в р-рах. Влияние природы р-рителя на скорость процесса, ур-ие Бренстеда.
- •56. Влияние ионной силы и давления на кинетику реакций в растворе.
- •57.Основные признаки катализа.
- •58.Общий и специфич. Кислотно-основ.Катализ.
- •59.Катализ комплексами переходных металлов и ферментатив.Катализ.
- •60.Кинетика гомогенных катал. Р-ций
- •61. Гетерогенный катализ. Понятие о катализаторах, носителях и промоторах..
- •62.Области протекания гетероген.Катал.Р-ций.
- •63.Температурная зависимость наблюдаемой скорости реакции
- •66.Кинетика гетерогенных каталитических реакций, проводимых в реакторе идеального вытеснения.
- •68.Основные теории катализа: мультиплетная, ансамблей, электронная, радикальная.
- •69. Основные принципы твердых катализаторов.
- •70.Топохимические реакции.
53. Связь кинетики и макрокинетики при протекании экзотермических реакций (теория теплового взрыва)
В случае экзотермической реакции, система не обладает устойчивостью к флуктуации температуры из-за наличия положительной . обратной связи. Например, если возрастает температура реакционной смеси, скорость реакции также возрастает, выделяется еще больше тепла, и реакционная смесь перегревается. Это может привести к тепловому взрыву при высоком значении теплоты реакции (DHR), поскольку отвод тепла (Q-) линейно зависит от температуры, а выделение тепла (Q+ ), как и скорость реакции, является экспоненциальной функцией температуры.
Теория теплового взрыва была разработана в работах Зельдовича и Франк-Каменецкого. Кратко рассмотрим анализ теплового режима в случае сильно экзотермической реакции.
В стационарном состоянии соблюдается тепловой баланс реакционной зоны, поскольку тепловыделение за счет реакции и отвод тепла сбалансированы Q+=Q-. Для реакции 1го порядка можно записать
![]() (4.10)
(4.10)
![]() (4.11)
(4.11)
где Cг – концентрация реагента в газовой фазе, at –коэффициент теплоотдачи, индексы ‘з’ и ‘о’ относятся к реакционной зоне и окружающей среде, соответственно. Зависимости Q+ и Q- нанесены на рис. 19. Ясно, что при низких температурах, когда наклон прямых теплоотдачи, т.е. at, больше, чем производная dQ+/dT, реализуется стационарное состояние и т.д., вплоть до некой критической температуры T*, в которой at=dQ+/dT, т.е. линия теплоотдачи становится касательной к кривой тепловыделения:
![]() (4.12)
(4.12)
Кроме того, в точке Т = T* еще выполняется условие теплового баланса, т.е. Q+ = Q- Поскольку эта точка является переходной между кинетической и диффузионной областями, имеется также заметный градиент концентрации, и для скорости реакции справедливо выражение
![]() ,
(4.13)
,
(4.13)
где km- коэффициент массопередачи. Используя известные из макрокинетики и теории подобия корреляции между at и km, в том числе числа Рейнольдса, Шмидта и Прандтля, найдем
km/at = 0,7/(cp r), (4.14)
где cp и r означают молярную теплоемкость и плотность газообразной смеси. Окончательное выражение для критической температуры T* имеет вид
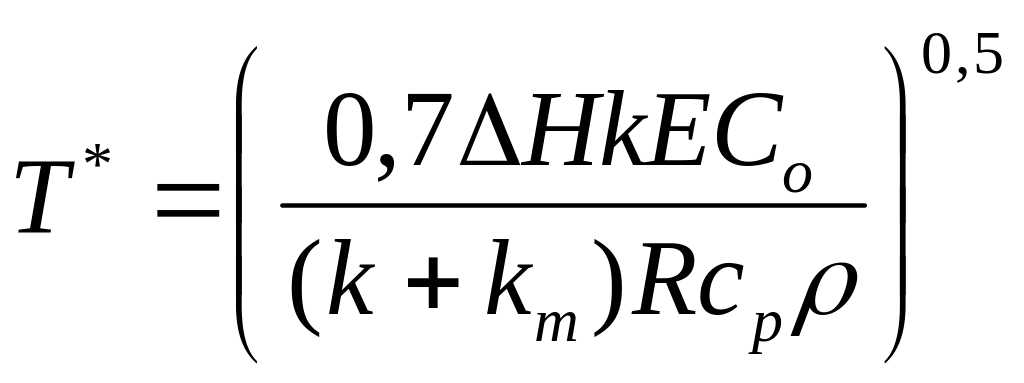 .
(4.15)
.
(4.15)
Следует подчеркнуть, что при температуре ≥T* стационарный режим в кинетической области уже невозможен, и система скачком (за время меньше 1 мин) переходит в диффузионную область, которая характеризуется весьма большим градиентом температуры DT= Tр –Tо. Этот самопроизвольный разогрев в реакционной зоне можно рассчитать в адиабатическом приближении, считая, что все тепло реакции идет на нагрев реакционной смеси.
![]() (4.16)
(4.16)
Оценим T* и DTад для реакции окисления этилена в этиленоксид, где DHR = 25 ккал/моль, E = 22 ккал/моль, cp = 4,4 кал/(моль.К), Cо/r = 0,1 и km/k = 11,5:
T* = 592K и DTад =25000.0,1/4,4 = 398K
Однако на самом деле самопроизвольный разогрев в реакционной зоне намного выше, поскольку при переходе в диффузионную область меняется механизм реакции, и вместо селективного процесса идет полное сгорание до диоксида углерода и воды. В этом случае нужно учесть существенно больший тепловой эффект горения (316 ккал/моль). Тогда оценка дает DTад ≥7000К, что означает тепловой взрыв в реакционной зоне.
