
- •Раздел 1 общеприкладная медицинская микробиология микробиология как наука
- •История развития микробиологии
- •Систематика и номенклатура микроорганизмов
- •Микроскопические методы исследования микроскопы и способы микроскопии
- •Методы приготовления мазков–препаратов из материала (культур) и способы их окрашивания
- •Морфология и ультраструктура прокариот эубактерии
- •Патогенные спирохеты
- •Актиномицеты
- •Риккетсии
- •Микоплазмы
- •Физиология микроорганизмов
- •Выделение чистых культур бактерий
- •Выделение и изучение культуральных свойств бактерий–аэробов
- •Особенности выделения и изучения культуральных свойств бактерий–анаэробов
- •Действие физических, химических и биологических факторов на микроорганизмы
- •Бактериофаги (фаги)
- •Стерилизация
- •Инфекция
- •Механизмы неспецифической резистентности
- •Антигены как индукторы приобретенного антимикробного иммунитета
- •Органы иммунитета и иммунокомпетентные клетки
- •Антитела (иммуноглобулины)
- •Процесс антителообразования
- •Аллергия (гиперчувствительность)
- •Патогенез и характер проявления анафилаксии и инфекционной аллергии
- •Иммунопрофилактика и иммунотерапия вакцины
- •Иммунные сыворотки (гамма–глобулины)
- •Серологические реакции иммунитета
- •Реакция агглютинации
- •Реакция преципитации
- •Реакция связывания комплемента
- •Реакция иммунофлюоресценции
- •Реакция торможения гемагглютинации
- •Раздел 2 инфекционная микробиология возбудители бактериальных инфекций пиогенные кокки
- •Общая характеристика патогенных энтеробактерий и вызываемых ими кишечных инфекций
- •Эшерихии
- •Возбудители брюшного тифа и паратифов а и в
- •Возбудители сальмонеллезов
- •Возбудители дизентерии
- •Холерный вибрион
- •Коринебактерии дифтерии
- •Возбудители туберкулеза и микобактериозов
- •Возбудитель сифилиса
- •Возбудители вирусных инфекций общая характеристика вирусов
- •Вирусы гриппа
- •Вирусы парагриппа
- •Аденовирусы
- •Вирусы гепатита
- •Спид и спид–ассоциированные инфекции
- •Возбудители протозойных болезней плазмодии малярии
- •Токсоплазмы
- •Трихомонады
- •Лямблии
- •Приложение устройство, оснащение и правила работы в микробиологических лабораториях
Риккетсии
Риккетсии – это многочисленная группа бактерий–паразитов, названная именем их первооткрывателя, американского ученого Г. Риккетса, который, установив риккетсиозную природу пятнистой лихорадки Скалистых гор Северной Америки, в 1910 г. погиб в результате внутрилабораторного заражения. Большая часть риккетсий является безвредными бактериями–симбионтами членистоногих. Некоторые виды вызывают заболевания у человека.
Рис.
13. Риккетсии:
а – кокковидные;
6 –
бактериальные;
в –
бациллярные; г
– нитевидные; д
–
внутриклеточные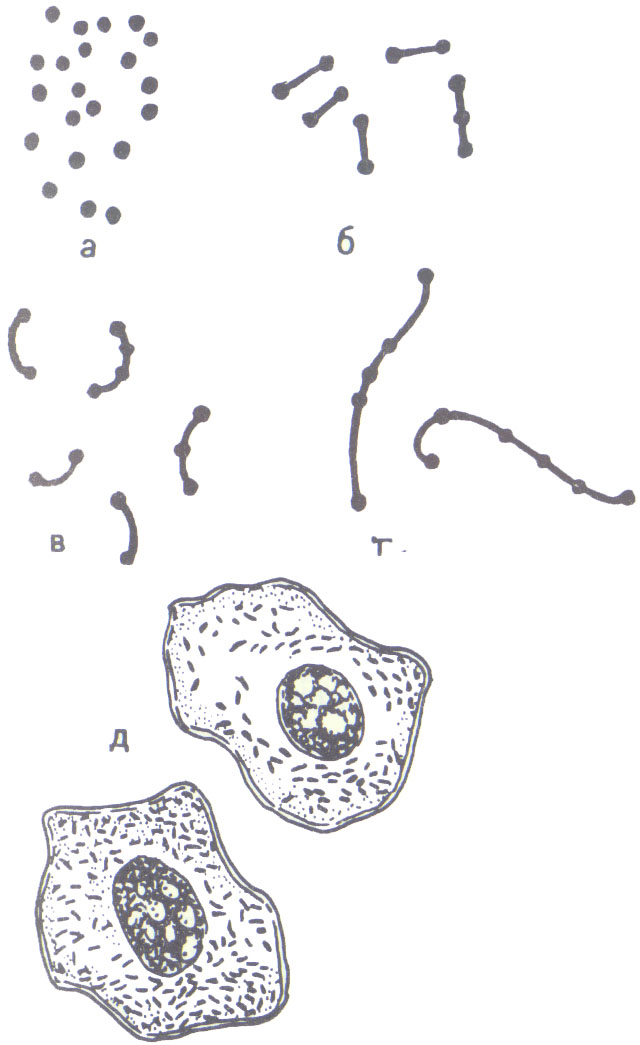
Основные способы окраски. По Граму риккетсий окрашиваются отрицательно. Для их дифференциации чаще применяется предложенная П.Ф. Здродовским облегченная модификация способа Пиля – Нельсена: окраска водным фуксином (5 мин) С последующей обработкой мазка 0,01 % раствором соляной кислоты (1 – 3 с) и докрашиванием 0,5 % метиленовым синим (10 с). Обладая относительной кислотоустойчивостью, риккетсий при этом окрашиваются в рубиново – красный цвет и легко обнаруживаются на фоне голубой цитоплазмы или синего ядра клеток. По Романовскому – Гимзе риккетсии окрашиваются в сиреневый цвет; при внеклеточном расположении часто имеют вид биполярных палочек или гантелек. Спор, капсул и жгутиков не образуют.
Микоплазмы
Вместо клеточной стенки микоплазмы покрыты трехслойной эластичной мембраной, состоящей из липопротеиновых соединений, фосфолипидов с включением стеринов, которых нет у бактерий и риккетсии. Содержат большое количество белка и нуклеиновых кислот; количество углеводов варьирует.
Рис.
14 Микоплазмы
Методы микроскопии. В световом микроскопе можно обнаружить лишь самые большие формы и виды микоплазм, размеры которых превышают 0,2 мкм в длину и в поперечнике. В живом состоянии их изучают в темном поле и фазово–контрастном микроскопе, ультраструктурные элементы выявляют при электронной микроскопии.
Физиология микроорганизмов
Физиология микроорганизмов изучает их метаболизм (обмен веществ), потребность в питательных веществах и ростовых факторах, способы приготовления питательных сред, условия культивирования (выращивания) , характер роста и биохимические свойства различных видов бактерий и микоплазм, а также методы стерилизации и дезинфекции.
Питательные среды. Питательные среды должны содержать основные органогены, другие зольные элементы, микроэлементы, факторы роста, иметь соответствующий рН, быть изотоничными и обладать определенным окислительно–восстановительным потенциалом.
Для нормальной жизнедеятельности бактерий и микоплазм необходимы четыре органогена: углерод, азот, водород и кислород. Наиболее важный из них – углерод. Им также нужны сера, фосфор, натрий, калий, кальций, магний, железо как зольные элементы. Для активации роста микроорганизмов в микродозах необходимы бор, молибден, цинк, кобальт, никель, марганец, медь, йод, бром и некоторые другие микроэлементы. Источником органогенов, макро– и микроэлементов в питательных средах являются экстрактивные вещества мяса, рыбы, овощей и вода, на которой их изготовляют. Микоплазмы и ряд бактерий (например, бруцеллы, коринебактерии) нуждаются в ростовых факторах, к которым относят аминокислоты, пуриновые и пиримидиновые основания, витамины. Для большинства бактерий рН питательных сред соответствует 7,2–7,4.
Готовят питательные среды из продуктов животного и растительного происхождения или химически чистых соединений.
Классификация сред. По консистенции питательные среды делят на жидкие, полужидкие и плотные. К жидким питательным средам принадлежат мясопептонный, сахарный, кровяной и желчный бульоны, пептонная вода, обезжиренное молоко. Для изготовления полужидких и плотных сред, которые готовятся на основе бульонов, прибавляют полисахарид агар (от 0,15 до 3 %), получаемый из морских водорослей, или желатину (10–15 %).
По составу питательные среды разделяют на простые, или обычные; специальные, к которым принадлежат сложные и селективные (избирательные) ; дифференциально–диагностические.
К простым средам относят мясопептонный бульон (МПБ) и мясопептонный агар (МПА). На них культивируют большинство патогенных и сапрофитных бактерий, как–то: кишечные бактерии, бациллы сибирской язвы, возбудитель чумы.
Специальные среды служат для выращивания микроорганизмов, не растущих на простых средах и часто нуждающихся в факторах роста. При этом сложные среды, как правило, готовят на основе МПБ и МПА, добавляя к ним углеводы (чаще глюкозу), кровь, сыворотку крови, асцитическую жидкость. Селективные среды применяют для выращивания определенного вида бактерий. Рост других видов микробов на них задерживается. Так, на 1 % щелочной пептонной воде с рН 7,8–8,2 быстро развивается холерный вибрион; на желчном бульоне – тифопаратифозные бактерии; на свернутой лошадиной сыворотке в считанные часы вырастают коринебактерии дифтерии.
Дифференциально–диагностические питательные среды предназначены для выявления сахаролитических, протеолитических свойств и агрессинов патогенных микроорганизмов. К ним относят среды Гисса, Эндо, Левина и Плоскирева. Ряд Гисса – это полужидкий питательный агар с индикатором ВР (водный голубой + розоловая кислота) и наличием какого–либо одного углевода, чаще всего глюкозы, мальтозы, маннита, сахарозы или лактозы. На этих средах, которые разливают по пробиркам столбиками, изучается спектр бактериальных гликозидаз. Сбраживание одного из углеводов сопровождается изменением цвета столбика агара и образованием пузырьков газа.
Протеолитическая активность бактерий на ряде Гисса изучается посевом культур в столбик мясопептонной желатины, на молоко и пептонную воду, на которой, в частности, определяются индолообразование (покраснение свисающей из–под пробки бумажки, пропитанной щавелевой кислотой), выделение сероводорода (почернение бумажки, смоченной уксуснокислым свинцом вследствие образования сульфита свинца) и аммиак (посинение лакмусовой бумажки).
Среды Эндо, Левина и Плоскирева – это обычный по консистенции питательный агар, в котором содержится лактоза и соответствующий им индикатор. На них удается отдифференцировать эшерихии, ферментирующие лактозу и формирующие цветные колонии, от сальмонелл и дизентерийных бактерий, не способных расщеплять ее и образующих бесцветные колонии.
Рис. 15
Микробиологический
шпатель (а),
градуированная (б)
и пастеровская (в)
пипетки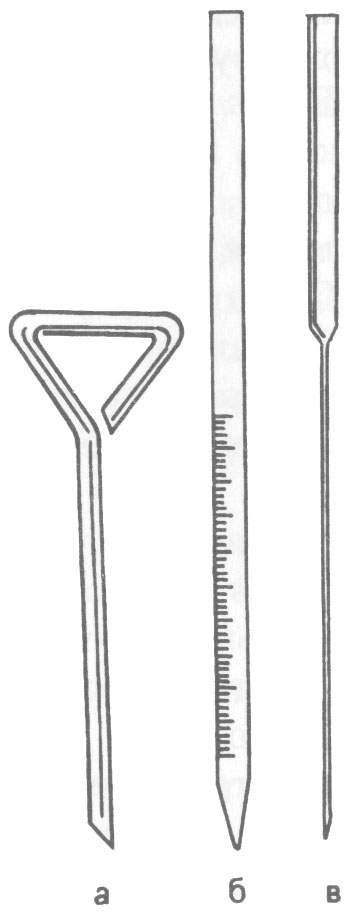
Для выращивания клеток тканей, используемых для культивирования вирусов, риккетсий, микоплазм и некоторых особенно требовательных к питательным веществам бактерий, используют среды 199, Игла и другие, содержащие такой полный набор веществ, который находится в межклеточной жидкости организма (аминокислоты, углеводы, витамины, определенный солевой состав и рН).
Посуда. Питательные среды предпочтительнее готовить в эмалированных кастрюлях. Новую стеклянную посуду кипятят в 1–2 % растворе соляной кислоты для нейтрализации растворимой щелочи, затем тщательно промывают проточной водой и сушат. Бывшую в употреблении посуду стерилизуют, моют в мыльном или содовом растворе, хорошо прополаскивают и сушат. Сухие флаконы, колбы, пробирки закрывают ватными тампонами (пробками).
Методы и техника посева материалов и культур микробов. Микроорганизмы культивируют (выращивают) на питательных средах, которые разливают в пробирки, колбы, флаконы, чашки Петри. Посев производят бактериальной петлей (иглой), шпателем, пастеровской или обычной градуированной пипеткой (рис. 15).
Выросшие на поверхности плотных сред изолированные макроскопические скопления биомасс, являющиеся продуктом размножения одной–един–ственной клетки, называемые колониями, представляют собой чистую культуру бактерий, которую, накопив на средах, используют для определения видовой принадлежности микроорганизма.
Посев бактериальной петлей на скошенную и жидкую среды. Пробирку с чистой культурой бактерий и стерильной средой берут в левую руку и держат пальцами в наклонном положении так, чтобы их содержимое не проливалось. В правую руку, как писчее перо, берут петлю и в вертикальном положении стерилизуют в пламени горелки. Пробки из пробирок вынимают одновременно, зажимают их между мизинцем и ладонью правой руки и тотчас же обжигают края открытых пробирок. Прокаленную петлю вводят в пробирку, охлаждают, прикасаются к культуре бактерий, быстро переносят ее в пробирку с незасеянной средой, ополаскивая петлю в бульоне или же зигзагообразными движениями распределяют по скошенной поверхности агара (рис. 16, а). Петлю извлекают, обжигают края пробирок и закрывают их проведенными через пламя пробками, затем бактериальную петлю стерилизуют, пробирки ставят в штатив.
Рис. 16 Посевы
материала (культуры) бактериальной
петлёй
на скошенную среду
(а)
и уколом в столбик среды (б)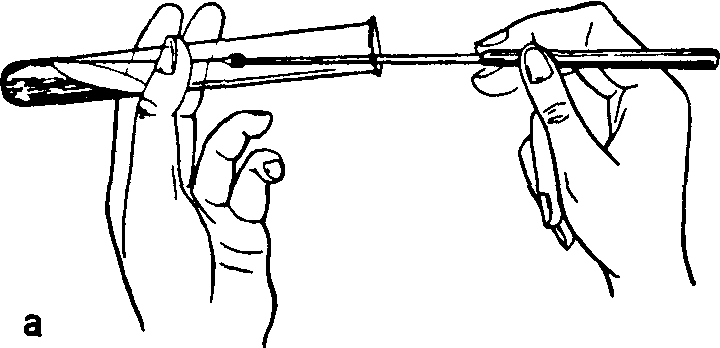
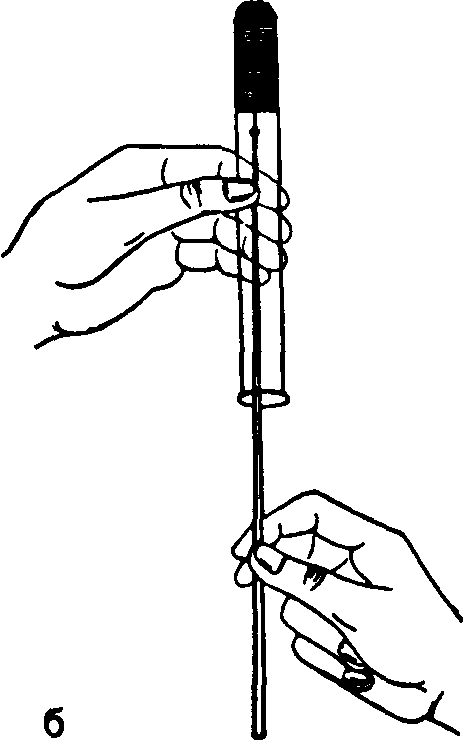
Посев градуированной или пастеровской пипеткой. Пробирки держат под небольшим углом, градуированную или пастеровскую пипетку проводят через пламя и, сняв пробки, опускают в пробирку, затем набирают определенное количество материала, переносят и выдувают его в питательную среду. Пробирки закрывают, а пипетки помещают в дезинфицирующий раствор.
Посев в чашки Петри с плотной питательной средой. Плотные питательные среды, например мясопептонный агар, разливают в чашки следующим образом: флакон (пробирку) с расплавленной средой берут в правую руку, левой вынимают пробку, обжигают горлышко. Большим и указательным пальцами левой руки приподнимают крышку чашки Петри и, не касаясь ее краев, вводят под нее горлышко, наливая 15–20 мл среды. Быстро закрывают флакон и крышку. Чашку Петри слегка покачивают для равномерного распределения среды и оставляют для застывания. Затем переносят ее в термостат, переворачивают вверх дном, снимают крышку и подсушивают в таком положении 15–20 мин.
Рис. 17.
Посев шпателем на питательную среду в
чашке Петри
Посев бактериальной петлей. Исследуемую жидкость набирают петлей и, не прикасаясь к стенке пробирки, удаляют излишнее ее количество. Чашку Петри с агаризованной средой помещают на «толе вверх дном. Донную часть чашки держат левой рукой вертикально, петледержатель – большим и указательным пальцами правой руки и легкими движениями наносят жидкость параллельными штрихами по всему диаметру поверхности среды.
