
- •1. Характеристика предмета коллоидной химии
- •1.1 Признаки объектов коллоидной химии
- •1.2 Количественные характеристики дисперсных систем
- •1.3 Энергетическая и геометрические характеристики поверхности
- •1.4 Классификация дисперсных систем
- •1.5 Методы получения коллоидных систем
- •1.6. Правило фаз Гиббса для дисперсных систем
- •2. Поверхностное натяжение
- •2.1 Термодинамические параметры поверхностного слоя
- •2.2 Экспериментальные методы определения поверхностного натяжения.
- •2.3 Внутренняя полная поверхностная энергия.
- •2.4 Температурная зависимость σ и полной внутренней поверхностной энергии.
- •2.5 Механизм процессов самопроизвольного уменьшения σ. Принцип Гиббса-Кюри.
- •2.6 Внутреннее давление. Уравнение Лапласа
- •2.7 Влияние дисперсности на реакционную способность
- •2.8 Влияние дисперсности на растворимость вещества
- •2.9 Влияние дисперсности на равновесие химической реакции.
- •2.10 Влияние дисперсности на температуру фазовых переходов.
- •2.11 Уравнение капиллярной конденсации
- •3. Термодинамика образования новой фазы.
- •3.1 Кинетика образования новой фазы в системе “ж – т”.
- •3.2 Управление степенью дисперсности.
- •4. Двойной электрический слой. Механизм его образования.
- •4.1 Строение дэс
- •4.2 Примеры д.Э.С. И строение мицеллы
- •4.3 Термодинамика образования д.Э.С. Уравнение Габриэль-Липмана
- •5. Адсорбция. Зависимость от параметров системы
- •5.1 Типы адсорбции
- •5.2 Ионный обмен
- •5.3 Фундаментальные адсорбционные уравнения Гиббса
- •5.4 Адсорбция на границе ж-г
- •5.5 Уравнение Шишковского
- •5.6 Изотерма адсорбции Ленгмюра
- •5.7 Многокомпонентная адсорбция из газовой фазы.
- •5.8 Учет неэквивалентности адсорбционных центров
- •5.9. Капиллярные явления. Формула Жюрена
- •5.10 Адсорбция на пористых телах.
- •5.11 Адсорбция на микропористых телах.
- •5.12 Селективная адсорбция из растворов
- •6. Электрокинетические явления
- •6.1 Электроосмос
- •6.2 Электрофорез
- •7. Адгезия. Механизм процессов адгезии
- •7.1 Смачивание. Краевой угол
- •7.2 Связь работы адгезии с краевым углом
- •7.3 Эффект Марагони.
- •7.4 Правило Антонова
- •8. Флотация
- •9. Рассеяние света ультромикрогетерогенными частицами
- •10. Устойчивость дисперсных систем.
- •10.1 Седиментационная устойчивость дисперсных систем
- •10.2 Седиментационный анализ.
- •I метод.
- •10.3 Механические методы седиментации
- •10.4 Агрегативная устойчивость дисперсных систем
- •10.5 Кинетика коагуляции.
- •10.6 Коагуляция золей электролитами
- •10.7 Условие термодинамической устойчивости дисперсных систем
- •11. Эмульсии. Их стабилизация и разрушение.
- •12. Пены, стабилизация и разрушение.
- •13. Аэрозоли. Устойчивость и разрушение.
- •14. Суспензии. Обеспечение их устойчивости.
- •15. Гели
- •16. Экспериментальные методы изучения поверхностей.
5.6 Изотерма адсорбции Ленгмюра
(ам. уч. Ирвинг Ленгмюр, Нобел. Прем.)
Фундаментальным вкладом в учение об адсорбции является изотерма Ленгмюра. Она позволяет учесть отклонения от закона Генри, связанные с ограниченной поверхности адсорбента. Вывод уравнения Ленгмюра базируется на трех постулатах:
1. Адсорбция локализована на отдельных адсорбционных центрах, каждый из которых взаимодействует только с 1 молекулой адсорбата, образуя мономолекулярный слой.
2. Адсорбционные центры энергетически эквипотенциальны, а поверхность эквипотенциальна.
3. Адсорбируемые молекулы не взаимодействуют друг с другом.
Рассмотрим адсорбцию как квазихимическую реакцию
![]()
![]() -
адсорбционный центр
-
адсорбционный центр
![]() -
Адсорбционный комплекс
-
Адсорбционный комплекс
![]() ;
; ![]() -
величина адсорбции
-
величина адсорбции
![]() ;
; ![]() -
число адсорбционных центров
-
число адсорбционных центров
![]() -емкость
адсорбционного монослоя, число
адсорбционных центров на ед. площади
поверхности или массы
-емкость
адсорбционного монослоя, число
адсорбционных центров на ед. площади
поверхности или массы
![]()
![]()
![]() -
уравнение изотермы Ленгмюра
-
уравнение изотермы Ленгмюра
Для газов: ![]()
К и КР характеризуют энергию взаимодействия адсорбата с адсорбентом (чем больше К, тем сильнее взаимодействие).
![]() -
степень заполнения поверхности
адсорбента
-
степень заполнения поверхности
адсорбента
![]()
При С→0 ![]() ;
; ![]() -
изотерм Генри
-
изотерм Генри
Т.е. уравнение Ленгмюра является более общим соотношением, включающим в себя уравнение Генри.
При больших С или
Р КС>>1;
![]() и
и
![]()
Это отвечает насыщению адсорбата. Отсюда
![]()
![]() -
площадь, занимаемая одной молекулой
-
площадь, занимаемая одной молекулой
Уравнение Ленгмюра очень часто решается Графически. Для этого оно приводится к линейной форме
![]()
5.7 Многокомпонентная адсорбция из газовой фазы.
При адсорбции газов из смесей концентрация адсорбционных центров является общей для всех адсорбирующихся компонентов.
![]() ;
;
![]() ;
; ![]() ;
; ![]()
![]() ,
для газов С ~ Р :
,
для газов С ~ Р : ![]()
![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
т.д.
;
т.д.
![]() ;
; 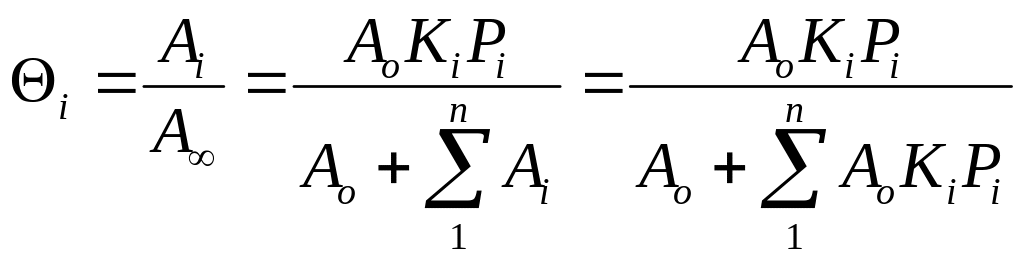 ;
;
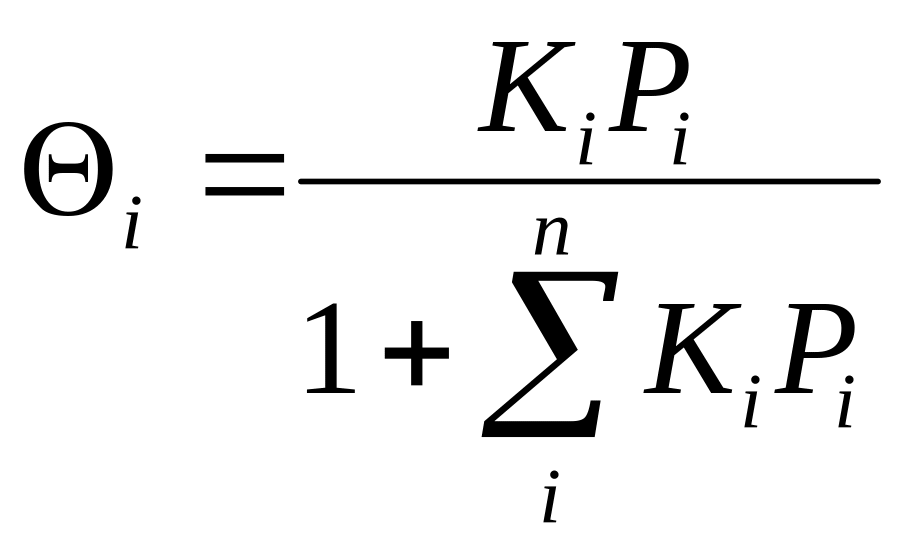
При адсорбции
газов из смеси увеличение парциального
давления одного компонента подавляет
адсорбцию других и тем сильнее, чем
больше
![]()
5.8 Учет неэквивалентности адсорбционных центров
На реальных твердых телах из-за неоднородности их геометрии адсорбционные центры энергетически неэквивалентны.
Темкин, приняв линейное распределение адсорбционных центров по энергиям (теплотам адсорбции) и используя уравнение Ленгмюра, получил уравнение для средней степени заполнения адсорбента.
![]() ;
; ![]() ,
где
,
где
α – const, характеризующая линейное расширение.
![]() - const
в уравнении Ленгмюра, отвечающая мах
теплоте адсорбции. Уравнение называется
логарифмической изотермой адсорбции.
- const
в уравнении Ленгмюра, отвечающая мах
теплоте адсорбции. Уравнение называется
логарифмической изотермой адсорбции.
Зельдовичем (1949-1956), исходя из предположения экспоненциального распределения адсорбционных центров по энергиям для средних заполнений получено уравнение
![]() ,
K,
n
– const
,
K,
n
– const
Это уравнение было ранее эмпирически найдено Фрейндлихом Гербертом (нем.) и носит его имя, оно широко используется в инженерной практике.
В линейной форме:
![]() Графически
в координатах
Графически
в координатах
![]() легко определяются обе константы.
легко определяются обе константы.
Полимолекулярная адсорбция.
Уравнение Ленгмюра можно использовать только в предположении образования мономолекулярного слоя адсорбата, т.е., как правило при хемосорбции, физической адсорбции газов при малых «р» и «Т» и часто при адсорбции из растворов. Ограничение в его использовании для других систем связано с невозможностью правильно оценить К и .
Однако, в большинстве случаев мономолекулярная адсорбция не компенсирует всю избыточную поверхностную энергию, поэтому поверхностные силы могут влиять на 2й, 3й, и последующие адсорбционные слои. Действительно, во многих случаях встречаются изотермы адсорбции, на которых отсутствует участок, отвечающий насыщению поверхности адсорбента адсорбатом. Для объяснения характера таких изотерм возникла потребность в других теориях адсорбции.
В точке «В» изотерма круто поднимается вверх, что указывает, что адсорбция после образования мономолекулярного слоя не прекращается. Для объяснения этого в 1915 году Поляни предложил теорию полимолекулярной адсорбции. Ее основные положения:
Адсорбция обусловлена чисто физическими силами
Адсорбционные силы образуют вблизи поверхности непрерывное силовое поле
Адсорбционные силы действуют на сравнительно большом расстоянии, образуя адсорбционный объем.
Действие адсорбционного поля приводит к возможности образования нескольких слоев адсорбируемых молекул. Газообразные продукты в них за счет сжатия могут конденсироваться в жидкость
Однако, уравнение изотермы адсорбции выведено не было.
Современная теория полимолекулярной адсорбции применительно к адсорбции паров была предложена Брунауэром, Эмметом, Теллером и получил название теории БЭТ. По этой теории адсорбционная фаза может быть представлена как совокупность адсорбционных компонентов – молекулярных цепочек, начинающихся молекулами первого слоя. Цепочки не взаимодействуют собой. Сходство с теорией Ленгмюра в наличии активных центров. Процесс адсорбции это серия последовательных квазихимических реакций
![]() ;
; ![]() ;
; ![]() ;
;
![]() ;
; ![]() ;
; 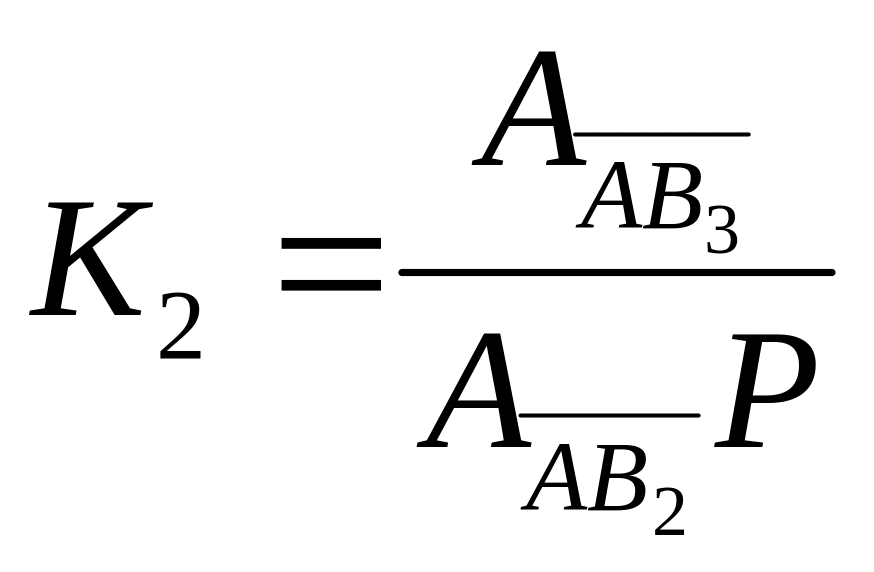 ;
;
![]() ;
; ![]() ;
; ![]() ;
;
Авторы теории приняли, что во всех случаях кроме 1 между собой взаимодействуют молекулы адсорбата как при конденсации, т.е. К1= К2= К3= …=КL, где КL- const конденсации пара
![]() ;
;
где РS – давление насыщенного пара
кроме того
![]() -
const,
отношение констант адсорбции и
конденсации
-
const,
отношение констант адсорбции и
конденсации
![]() ;
;
при P/PS<<1 – уравнение Ленгмюра
P/PS→0 (P→0) – уравнение Генри
Лучшее совпадение 0,05<P/PS<0,3
Линейная форма
уравнения
![]() широко
используется для Sуд:
Используются
широко
используется для Sуд:
Используются
азот |
аргон |
криптон |
0,162нм2 |
0,135нм2 |
0,195нм2 |
т.к. они отличаются слабым межмолекулярным взаимодействием.
