
- •1. Характеристика предмета коллоидной химии
- •1.1 Признаки объектов коллоидной химии
- •1.2 Количественные характеристики дисперсных систем
- •1.3 Энергетическая и геометрические характеристики поверхности
- •1.4 Классификация дисперсных систем
- •1.5 Методы получения коллоидных систем
- •1.6. Правило фаз Гиббса для дисперсных систем
- •2. Поверхностное натяжение
- •2.1 Термодинамические параметры поверхностного слоя
- •2.2 Экспериментальные методы определения поверхностного натяжения.
- •2.3 Внутренняя полная поверхностная энергия.
- •2.4 Температурная зависимость σ и полной внутренней поверхностной энергии.
- •2.5 Механизм процессов самопроизвольного уменьшения σ. Принцип Гиббса-Кюри.
- •2.6 Внутреннее давление. Уравнение Лапласа
- •2.7 Влияние дисперсности на реакционную способность
- •2.8 Влияние дисперсности на растворимость вещества
- •2.9 Влияние дисперсности на равновесие химической реакции.
- •2.10 Влияние дисперсности на температуру фазовых переходов.
- •2.11 Уравнение капиллярной конденсации
- •3. Термодинамика образования новой фазы.
- •3.1 Кинетика образования новой фазы в системе “ж – т”.
- •3.2 Управление степенью дисперсности.
- •4. Двойной электрический слой. Механизм его образования.
- •4.1 Строение дэс
- •4.2 Примеры д.Э.С. И строение мицеллы
- •4.3 Термодинамика образования д.Э.С. Уравнение Габриэль-Липмана
- •5. Адсорбция. Зависимость от параметров системы
- •5.1 Типы адсорбции
- •5.2 Ионный обмен
- •5.3 Фундаментальные адсорбционные уравнения Гиббса
- •5.4 Адсорбция на границе ж-г
- •5.5 Уравнение Шишковского
- •5.6 Изотерма адсорбции Ленгмюра
- •5.7 Многокомпонентная адсорбция из газовой фазы.
- •5.8 Учет неэквивалентности адсорбционных центров
- •5.9. Капиллярные явления. Формула Жюрена
- •5.10 Адсорбция на пористых телах.
- •5.11 Адсорбция на микропористых телах.
- •5.12 Селективная адсорбция из растворов
- •6. Электрокинетические явления
- •6.1 Электроосмос
- •6.2 Электрофорез
- •7. Адгезия. Механизм процессов адгезии
- •7.1 Смачивание. Краевой угол
- •7.2 Связь работы адгезии с краевым углом
- •7.3 Эффект Марагони.
- •7.4 Правило Антонова
- •8. Флотация
- •9. Рассеяние света ультромикрогетерогенными частицами
- •10. Устойчивость дисперсных систем.
- •10.1 Седиментационная устойчивость дисперсных систем
- •10.2 Седиментационный анализ.
- •I метод.
- •10.3 Механические методы седиментации
- •10.4 Агрегативная устойчивость дисперсных систем
- •10.5 Кинетика коагуляции.
- •10.6 Коагуляция золей электролитами
- •10.7 Условие термодинамической устойчивости дисперсных систем
- •11. Эмульсии. Их стабилизация и разрушение.
- •12. Пены, стабилизация и разрушение.
- •13. Аэрозоли. Устойчивость и разрушение.
- •14. Суспензии. Обеспечение их устойчивости.
- •15. Гели
- •16. Экспериментальные методы изучения поверхностей.
1.5 Методы получения коллоидных систем
Т.к. коллоиды это не особый класс веществ, а состояние, присущее всем веществам, рассмотрим методы обеспечивающее достижение этого состояния. Все методы разделяются на 2 группы:
А. Диспергационные (вещества тонко измельчаются – диспергируют в состав дисперсионной среды)
Б. Конденсационные (коллоидное состояние возникает в результате объединения молекул или ионов вещества)
Диспергационные
1.Механическое дробление (все природные коллоидные системы). Шаровые мельницы дают d от 2-3 до 50-70 мкм. Коллоидные мельницы – за счет высоких скоростей вращения ротора в пространстве между ротором и корпусом за счет трения достигается измельчение вещества до d < 1мкм.
2.Ультрозвуковое дробление – за счет захлопывания возникающих в жидкости полостей, возникают ударные микроволны (кавитация). Частота колебания до 800 тыс./сек.
3.Электрическое дробление (в вольтовой дуге или высокочастотным разрядом) (Сведберг)
4.Химическое дробление – пептизация
Fe(OH)2 + NaCl → Fe(OH)2Cl + NaOH
Конденсационные
А.Физические 1.Конденсация пара в газовой среде (туман).
2.Конденсация пара в жидкости (ртуть в холодной воде), золи металлов в электрической дуге
3.Конденсация частиц при замене растворителя (канифоль – замена спирта на воду)
4.Совместная конденсация веществ не растворимых друг в друге (золи металлов Al, Na, K в органических растворителях) – испарение и совместная конденсация в вакууме.
Б.Химические (называются по типу химической реакции)
1.Восстановление 2HAuCl4 + 3H2O2 → 2Au + 8HCl + 3O2 (метод Зигмунди)
↘золь золи Ag, Pt, Hg, Bi, Cu
2 .Гидролиз
FeCl3
+ 3H2O
→ Fe(OH)3
+3HCl
Al2(OH)5Cl
+ H2O
→ 2Al(OH)3
+HCl
очистка воды коагуляцией
.Гидролиз
FeCl3
+ 3H2O
→ Fe(OH)3
+3HCl
Al2(OH)5Cl
+ H2O
→ 2Al(OH)3
+HCl
очистка воды коагуляцией
3 .Окисление-восстановление
3O2
+ 2H2S
→ 3S
+ 2H2O
.Окисление-восстановление
3O2
+ 2H2S
→ 3S
+ 2H2O
гидрозоль
4 .Реакция обмена AgNO3 + KJ → AgJ + KNO3 аэрозоль
Для повышения степени дисперсности системы:
1. Смешивают очень разбавленные растворы С<10-4 моль/л
2. Введение специальных веществ (стабилизаторов), которые уменьшают слипание, создавая защитную прослойку (мыло, желатин)
1.6. Правило фаз Гиббса для дисперсных систем
В физ. химии правило фаз Гиббса имело вид
F = к+ф+2, где под 2 понимают термодинамически интенсивные переменные P,T, т.е. таким образом определяется число степеней свободы или вариантность системы. F – число независимых переменных, которые можно изменять в некоторых пределах так, чтобы число и природа фаз оставались прежними. Наименьшее число переменных описывает состояние системы. Для газа F=2
Рассмотрим теперь трехкомпонентную гетерогенную систему бензол-вода-ПАВ. Здесь F=3-2=1, P,T – const, 1 – количество ПАВ. Но, если
1.цилиндр 2.противень
Как распределится ПАВ в этих случаях? S1<S2; Sуд1<Sуд2;
1.mпПАВ,ц<mпПАВ,пр;
2.cvПАВ,ц>cvПАВ,пр
т.е. изменеие Sуд или Д привело к изменению равновесия в системе, т.е. система получила дополнительную степень свободы.
Отсюда Д (Sуд) является самостоятельным термодинамическим параметром системы, изменение которого вызывает соответствующие изменения других равновесных свойств системы. Sуд является интенсивным признаком системы. Ее можно характеризовать как количество поверхности, приходящимся на 1 обьема. Отсюда: правило фаз Гиббса для дисперсных систем может быть записано: F=к+ф+3, где под 3 понимают P,T,S.
1.7 Молекулярно-кинетические свойства свободно-дисперсных систем.
В 1827г. Английский ботаник Роберт Броун исследуя споры папоротника в воде обратил внимание на их хаотические движения, которые зависели от их размера и температуры. Только в конце 19в. Гуи и Экспер связали это с тепловым движением молекул. Фактически это открытие доказывало существование атомов и молекул.
Экспер попытался
количественно описать эти движения,
используя уравнения кинетической
энергии частиц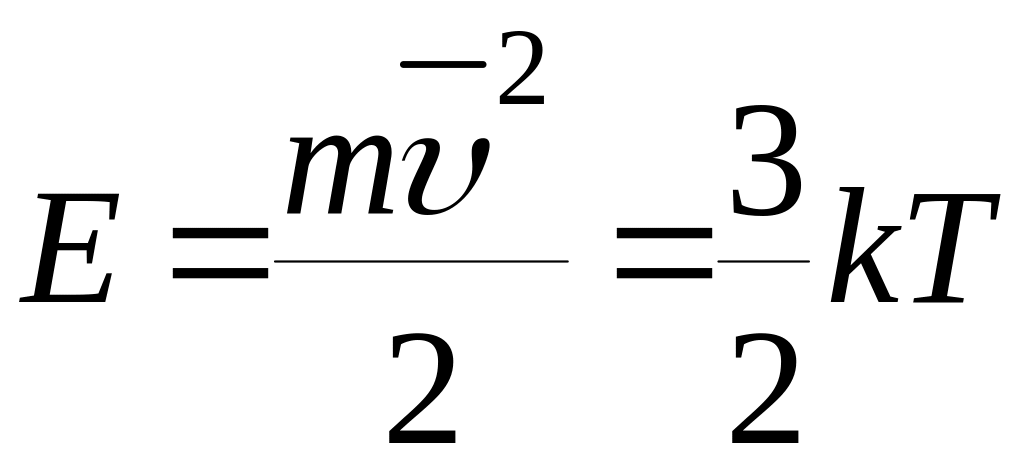 ,
k
– const
Больцмана.
,
k
– const
Больцмана.
Однако вычисления давали значения перемещений в 1000 раз больших, (4000 мкм/с вместо 4мкм/с) чем экспериментальные.
Это можно было объяснить используя только законы статической физики. В 1 сек. частицы испытывают до 1020 толчков и перемещение частиц является источником их результирующего воздействия.
 Теоретически
обосновали броуновское движение Эйнштейн
(1905) и Смолуховский (1906) – независимо
друг от друга. Оба они приняли представление
о среднем сдвиге частицы в двух координатах
«x»
и «y»
как их проекции движения на плоскости.
Теоретически
обосновали броуновское движение Эйнштейн
(1905) и Смолуховский (1906) – независимо
друг от друга. Оба они приняли представление
о среднем сдвиге частицы в двух координатах
«x»
и «y»
как их проекции движения на плоскости.
Учитывая равновероятность отклонения от осей «x» и «y» (∟45˚) имеем
![]() ,
,
![]() или
или
![]() ;
;
![]()
Они установили
также количественную связь между кв.
средним сдвигом
![]() и
коэффициентом диффузии Д.
и
коэффициентом диффузии Д.
1. С1
< С2
. Хаотичность броуновского движения
приводит к равной вероятности перехода
частиц из 1 в 2, т.е. половина частиц
переместится вправо, половина влево.
![]()
![]()
![]()
Градиент конц. (с1 - с2) может быть выражен:
![]() ,
подставив
,
подставив
![]()
Из первого закона
Фика
![]()
Приравняем:
![]()
Уравнение Эйнштейна для диффузии:
![]() ,
,
где В – коэффициент трения;
![]() - закон Стокса
- закон Стокса
![]() - закон
Эйнштейна-Смолуховского,
- закон
Эйнштейна-Смолуховского,
т.е. частицы перемещаются тем сильнее чем выше Т, τ и меньше η и r.
Экспериментально это уравнение было доказано Сведбергом (1909), Перреном (1910), Бойлем (1909), Милликеном (1910).
Сведберг – измерил сдвиг частиц коллоидного Ag от τ и η, что совпало с уравнением
Перрен – впервые экспериментально на системе гуммигут-H2O определил NA
Бойль – на табачном дыме, используя закон Энштейна-Смоулховского, определил заряд частиц аэрозоля.
Милликен – использовал систему масляного тумана, экспериментально определил заряд «e» очень точно.
ВЫВОДЫ:
Доказательство справедливости закона Эйнштейна-Смоулковского для коллоидных систем привела к фундаментальным выводам о применимости к истинным коллоидным системам законов молекулярно-кинетической теории, законов связанных с энтропией, т.е. коллоидные системы обладают свойствами гетерогенно-дисперсных систем и истинных растворов.
