
- •Обухов и.Л., Панин а.Н., Груздев к.Н., Васильев д.А.
- •Обухов и. Л., Панин а. Н., Груздев к. Н., Васильев д. А.
- •Введение
- •Историческая справка
- •Возбудитель болезни
- •Эпизоотологические данные
- •Патогенез
- •Клинические признаки
- •Патологоанатомические изменения
- •Диагностика
- •Иммунитет
- •Профилактика и лечение
- •Мероприятия по профилактике и борьбе с орнитозом птиц
- •Эпидемиология
- •Профилактика заболеваний людей
- •Заключение
- •Список основной использованной литературы
- •Приложение наставление по применению набора компонентов «ХламиОрн» для выявления антигенов рода Chlamydia методом прямой иммунофлуоресценции
- •Методические указания по индикации chlamydia psittaci методом полимеразной цепной реакции
- •1. Введение
- •2.Сущность метода
- •3. Область применения
- •4. Количество реактивов и их концентрации
- •5. Этапы работы
- •5.1. Этап 1. Подготовка проб (выделение днк).
- •Предварительная обработка материала:
- •Состав набора для выделения днк «днк-сорб-пцр»:
- •Порядок работы:
- •5.2. Этап 2. Постановка пцр состав набора для проведения пцр-амплификации:
- •Необходимое оборудование:
- •Порядок работы:
- •5.3. Этап 3. Электрофоретический анализ продуктов амплификации
- •Необходимое оборудование:
- •Состав набора (на 100 анализов):
- •Порядок работы:
- •6. Учет и интерпретация результатов
- •Содержание
Патологоанатомические изменения
Аутопсия и гистологические данные недостаточно характерны, чтобы дифференцировать хламидиоз от других системных заболеваний. Тяжесть поражений, обнаруживаемых у птиц с хламидиозом, зависит от ряда факторов, включая вирулентность штамма, восприимчивость хозяина и смешанную инфекцию.
Обычно наблюдают увеличение селезенки, которая содержит белые некротические очаги или петехиальные (точечные) кровоизлияния на своей поверхности. Печень, как правило, увеличена, рыхлая, желтоватая либо зеленая по цвету, а на поверхности капсулы или среза наблюдаются небольшие некротические очаги. Оболочки альвеолярных мешочков могут утолщаться и покрываться густым, желтоватым фибринозо-гнойным экссудатом. Легкие обычно гиперемированы, и в основном имеет место диффузная гиперемия. В перикарде иногда идет выраженный воспалительный процесс, который может быть гнойным, серозным или фибринозным по характеру. Гиперемия может быть выражена и в кишечнике, особенно на серозной поверхности (Grimes, Wyrick, 1991).
При острых случаях хламидиоза имеют место незначительные гистопатологические поражения. Степень гистологических поражений зависит от вирулентности штамма, продолжительности заболевания и восприимчивости хозяина. Распространена сопутствующая патология, вызываемая другими инфекционными возбудителями. Можно выявить изменение архитектуры селезенки, связанное с гистиоцитозом (гиперемия ретикулярно-эндотелиальных клеток). Могут иметь место лимфоидная гиперплазия и плазмоцитоз, иногда наблюдают некротические участки. В печени часто возникают перипортальные гетерофильные и мононуклеарные инфильтраты. При острой форме обычно возникает многоочаговый коагуляционный некроз. При хронической – имеет место гиперплазия и гистиоцитоз желчных протоков. Увеличение активности клеток Купфера клинически совпадает с моноцитозом, наблюдаемым при хронических инфекциях. Может иметь место гемосидероз. При хронических печеночных инфекциях выявляют значительный фиброз и мононуклеарные инфильтраты. Поражения альвеолярных мешочков являются результатом инфильтрации мононуклеарных клеток (особенно макрофагов) и гетерофилов. Альвеолярные мешочки могут утолщаться вследствие пролиферации эпителия и соединительной ткани. Легочная патология незначительная. Однако можно наблюдать легкий пневмонит. Миокардит может быть разлитым, и иногда выявляются большие области некроза, видимые невооруженным глазом. В кишечнике часто наблюдают плазматический, лимфоцитический энтерит, клинически связываемый с наличием белых кровяных клеток в стуле. В почках может также иметь место некроз и воспалительные инфильтраты. Может развиться заболевание надпочечников. Редко отмечается поражения головного мозга. Исследование спинного мозга выявляет значительное увеличение клеток гранулоцитарного ряда (McDonald, Bayer, 1981).
Диагностика
Для выявления орнитоза у птиц и человека, а также подтверждения диагноза этой болезни, наибольшее применение в России имели: РСК (реакция связывания комплемента) и внутрикожная проба с орнитином (ВКП) (Гладковский А.П. и др., 1964).
Одним из основных моментов, препятствующих объективной оценке серологических методов диагностики является, так называемый, «сероположительный фон» (Шаткин А.А., Мавров И.И., 1983), который обусловлен широким распространением среди животных и людей хламидийной инфекции, часто протекающей бессимптомно.
В последнее время в связи с широким использованием антибиотиков РСК в значительной степени потеряла свою диагностическую ценность (Федоров А.И. и др., 1974). Влияние антибиотикотерапии обнаруживает себя поздним появлением КС антител в крови больных, низким титром реакций и частым отсутствием его нарастания в динамике (Федоров А.И. и др., 1974; Вишнякова Л.А., 1976). Нередко антитела вовсе не выявляются, следовательно, отрицательная РСК орнитоз не исключает. Соответственно при лечении больных антибиотиками для лабораторного подтверждения диагноза орнитоза посредством РСК необходимо принимать во внимание диагностическую ценность и низких титров РСК (при условии соответствующей орнитозу клинике заболевания), тем не менее, следует учитывать, что эта реакция в низких титрах наблюдается и у здоровых лиц (Вишнякова Л.А., 1976). При постановке диагноза птице на орнитоз парные сыворотки должны давать минимум четырехкратное повышение титров, а если в наличии только один образец сыворотки серологию необходимо подтверждать прямыми методами диагностики (Grimes, 1989).
Как известно, РСК распознает как IgM, так и IgG, однако, после лечения птицы титр антител может сохраняться от умеренных до высоких (1/128 до 1/256) в течение нескольких месяцев до нескольких лет. Также хотелось бы отметить трудоемкость процедуры взятия крови у птиц, в особенности у экзотических и декоративных. Таким образом, тесты обнаружения антихламидиальных антител более целесообразны для исследования сезонности эпизоотического процесса орнитоза в популяциях птиц и для эпидемиологического изучения птичьего хламидиоза, чем для диагностики этой инфекции (Grimes, 1989).
Определенным недостатком ВКП является отсутствие выраженной кожной реакции (инфильтрации, гиперемии) у многих больных орнитозом лиц (Ильинский Ю.А., 1974), что при отсутствии должного опыта оценки реакции может повлечь диагностическую ошибку. Ряд авторов считает, что ВКП дает положительную реакцию у больных другими заболеваниями, в частности: инфекционными заболеваниями нехламидийной этиологии (вирусным гепатитом, бруцеллезом), так и неинфекционными болезнями, которым свойственны выраженные изменения в иммунной системе организма с возможными аллергическими проявлениями (Минеев А.М., 1971; Казанцев А.П., 1973).
При сопоставлении ИФА-метода выявления антител и прямых методов детекции хламидий, как правило, наблюдается высокий процент дискорданных результатов. Так, при анализе методом АГ-ИФА проб, полученных от 426 сероположительных попугаев, было обнаружено лишь 5,2% выделителей возбудителя (Gerbermann et al., 1991). Согласно другим данным, у 30% сероположительных попугаев, импортированных в ФРГ, удалось выделить бактерии вида C. psittaci в культуре клеток, хотя только одной птице был поставлен диагноз «острый пситтакоз». В то же время эпидемиологическое обследование в группах внешне здоровых дневных хищных птиц показало высокую долю носительства специфических к хламидииям антител (75-78,6%) (Gerbermann et al., 1990). Следовательно, положительные результаты, полученные методом АТ-ИФА, не являются доказательством активного инфекционного процесса и требуют обязательного подтверждения каким-либо прямым методом. Кроме того, эффективность карантинных мероприятий при возникновении угрозы рассеивания инфекции носителями прямо зависит от выбора такого метода диагностики, который позволил бы не только выявить асимптоматичных носителей, но и проследить за их лечением. В подобных ситуациях в связи с тем, что антитела к хламидиям имеют тенденцию достаточно долго сохраняться в крови животных после перенесенной инфекции, предпочтение должно отдаваться методам прямого обнаружения возбудителя (Обухов И.Л. и др., 1996).
Традиционным прямым методом диагностики является выявление морфологических структур хламидий непосредственно в пораженных клетках (цитоплазматические включения) при окраске соскобных препаратов по Романовскому-Гимзе или по Стемпу. Источником первичного материала являются соскобы слизистой конъюнктивы или клоаки, получаемые одноразовым зондом, имеющим ватный тампон с повышенной адсорбцией. Обязательным условием при взятии соскобов – полное исключение травматических манипуляций. Соскобы берут при легком надавливании на слизистую оболочку, избегая появления примеси крови. При приготовлении препаратов для микроскопического исследования соскобный материал распределяют на обезжиренных стеклах и подвергают обработке, соответствующей последующему методу окраске. По Романовскому-Гимзе – хламидии темно-фиолетового цвета на синем фоне; по Стемпу – хламидии имеют ярко-красный цвет на зеленоватом фоне.
Однако, несмотря на простоту и доступность микроскопии, а также возможность получения информации о сопутствующей бактериальной флоре и цитоплазматических изменениях в пораженной ткани, существуют значительные недостатки этого метода. Обычно в окрашенных соскобных препаратах определяются детрит, слизь, сопутствующая бактериальная флора, которые затрудняют просмотр и являются причиной ложноположительных заключений. Также цитологические методы недостаточно чувствительны и специфичны для постановки диагноза на орнитоз и требуют обязательного подтверждения.
Одним из наиболее важных прямых методов выявления хламидий считается выделение возбудителя в культуре клеток. Данный подход является общепризнанным эталоном для других методов, однако, не лишен недостатков, существенно затрудняющих его широкое использование в практических лабораториях ветеринарной службы. Прежде всего, это высокий риск инфицирования персонала, и, следовательно, необходимость проведения работ по выделению возбудителя только в специальной режимной лаборатории.
Кроме того, культуральный метод трудоемок и занимает много времени. Успех исследования во многом зависит от того, как скоро данная проба была доставлена в лабораторию. Тем более, необходимо учитывать, что для транспортировки необходимы специальные транспортные среды и часто трудно соблюдаемые условия доставки образцов (охлаждение, добавление антибиотиков, предварительная очистка материала от токсичных для клеток веществ и т.д.).
Требование наличия живого возбудителя в анализируемом образце значительно снижает показатели чувствительности при проведении испытаний этого метода на заведомо положительных образцах. Так, в настоящее время культуральный метод все чаще применяется в общей схеме анализа, только как первый этап накопления специфических антигенов, которые затем выявляются методами иммуноферментного анализа или иммунофлуоресценции, что существенно увеличивает показатели специфичности и практически не влияет на чувствительность.
В настоящее время выпускается диагностический тест «ХламиОрн» для идентификации С. psittaci методом прямой иммунофлуоресценции (ПИФ) в клиническом материале от больных животных. Моноклональные антитела к группоспецифичному хламидиальному липополисахаридному антигену, выявляют С. psittaci в клинических образцах больных хламидиозом животных. По результатам широких производственных испытаний диагностическая специфичность данной тест-системы на патматериале от различных видов птиц и млекопитающих составила 95,5% и чувствительность 87% (Обухов И.Л., Нагиева Ф.Г., 1997). Диагностикум «ХламиОрн» позволяет выявлять не только корпускулярные антигены, входящие в состав морфологических структур возбудителя, но и растворимые, содержащиеся во включениях. Препарат может быть использован в любой лаборатории, оснащенной люминесцентным микроскопом.
Рис.4
Хламидийные антигены в эпителиальных клетках конъюнктивы голубя, показанные методом ПИФ. 2000

Преимуществами использования теста «ХламиОрн» с моноклональными антителами характеризуются следующими параметрами:
а) быстротой – вся диагностическая процедура с использованием моноклональных антител в среднем от момента забора материала до постановки диагноза занимает не более 40 мин.;
б) возможностью интерпретации результатов на основе регистрации элементарных и ретикулярных телец, расположенных внутри- и внеклеточно при сохранении высокой степени чувствительности и специфичности;
в) простой техники проведения анализа.
Однако широкий спектр клинических проявлений и нередко непатогномоничность клинической симптоматологии затрудняет лабораторную диагностику хламидиоза традиционными общепринятыми методами. Поэтому сегодня одним из наиболее перспективных подходов к прямой диагностике инфекций следует считать специфическую амплификацию нуклеиновых кислот in vitro и, в частности, наиболее разработанный вариант такой амплификации – метод полимеразной цепной реакции (ПЦР), позволяющий в пробирке всего за несколько часов произвести изолированное умножение (амплификацию) любого гена или его фрагмента во много миллионов раз (Обухов И.Л. и др., 1996). Достоинства и недостатки культурального метода по сравнению с ПЦР представлены в таблице 4.
Таблица 4.
Сравнение культурального метода и ПЦР при обнаружении хламидий
|
Недостатки |
Метод исследования |
Преимущества | ||
|
Необходимость сохранения жизнеспособности возбудителя при транспортировке. Получение результата в течение 5-7 суток. Необходимость проведения работы в режимной лаборатории. Высокая стоимость анализа. |
Культуральный |
Возможность определения чувствительности микроорганизмов к антибиотикам | ||
|
Возможность контаминации компонентов тестирующей системы и инструментария. |
ПЦР |
Позволяет определять единичные копии возбудителя. Получение результата в течение одного рабочего дня. Сравнительная простота отбора и подготовки исследуемого материала. Отсутствие необходимости в специальных условиях при транспортировке. Исключение возможности инфицирования персонала в процессе проведения анализа. Низкая стоимость анализа. | ||
ПЦР, являясь самым чувствительным на сегодняшний день методом прямого обнаружения хламидий, не требует иммунологического ответа на проникновение возбудителя в организм хозяина, что дает возможность следить за ранними стадиями развития инфекции. Для выявления патогенных микроорганизмов методом ПЦР не требуется их размножения, следовательно, так можно диагностировать инфекцию в латентной стадии, а также детектировать некультивируемые формы. Необходимо также отметить, простоту отбора материала для проведения ПЦР-диагностики на орнитоз, т.к. можно достоверно судить об инфицированности птицы по исследованию фекалий или клоачных соскобов (Обухов И.Л., Груздев К.Н., 1995; Обухов И.Л. и др., 1997).
Для амплификации специфического ДНК-фрагмента методом ПЦР достаточно знать нуклеотидную последовательность двух коротких участков ДНК, окаймляющих фрагмент-мишень. На основе этих последовательностей химически синтезируются два олигонуклеотида (праймера), которые необходимы для инициации полимеризации ДНК в каждом цикле ПЦР. Длина праймеров (обычно 20-30 нуклеотидов) должна быть такой, чтобы их последовательность была статистически уникальна и не встречалась в других участках ДНК, присутствующей в реакционной смеси. ПЦР включает серию повторяющихся циклов, каждый из которых начинается со стадии денатурации молекулы ДНК (рис. 5).
Рис.5
Схема ПЦР-анализа клинического материала от инфицированного хламидиями животного.
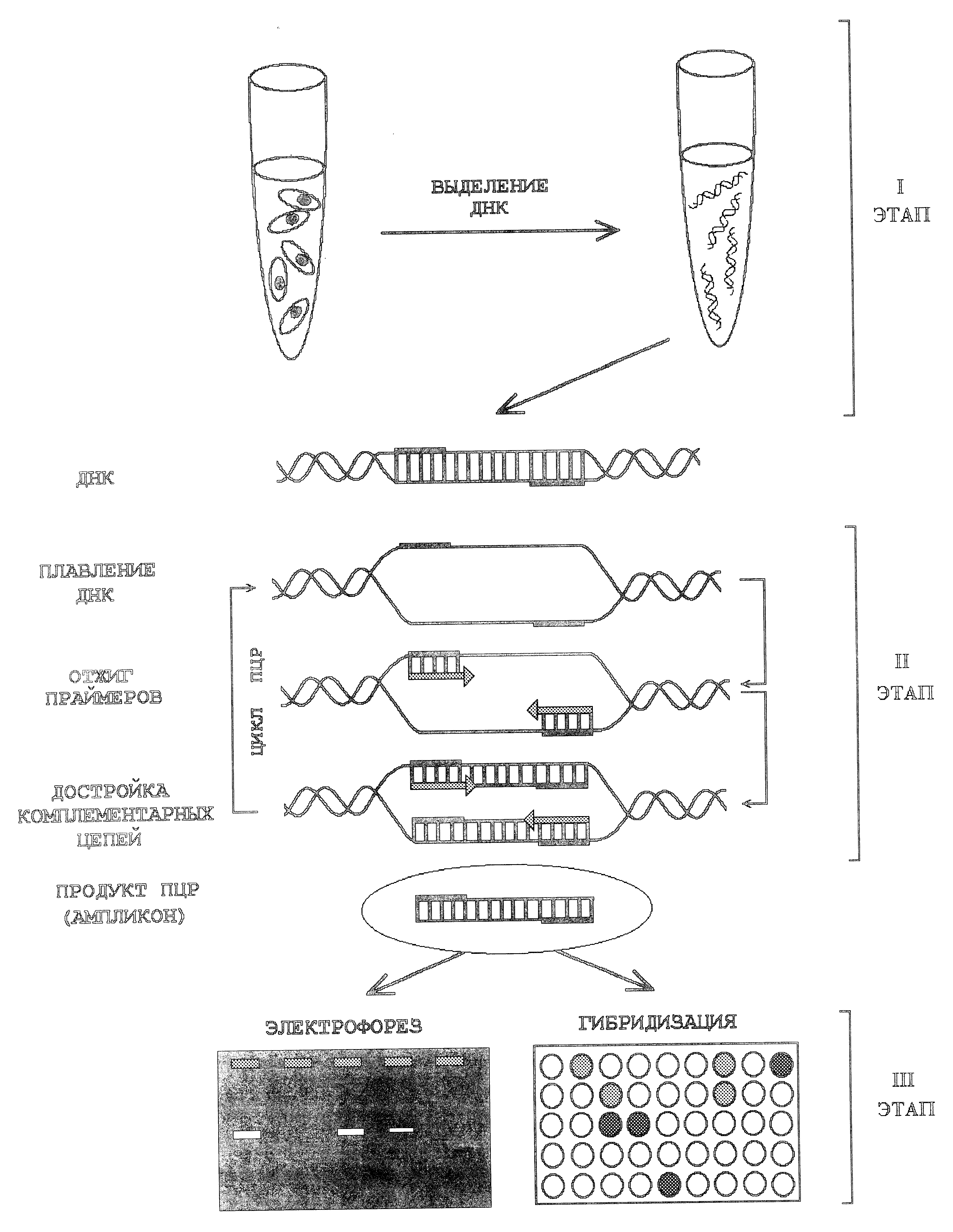
Этапы ПЦР-метода: I – подготовка проб к проведению ПЦР (очистка ДНК от ингибиторов ДНК-полимеразы и концентрирование); II – ПЦР–амплификация; III – регистрация результатов (электрофоретическая или гибридизационно–ферментная детекция продуктов ПЦР).
На первой стадии при нагревании реакционной смеси до 96 °С разрываются водородные связи, соединяющие спиральные цепи. На второй стадии температуру реакционной смеси понижают до заранее определенных значений, соответствующих температуре отжига (присоединения) праймеров, что приводит к комплементарному их взаимодействию с последовательностями, окаймляющими фрагмент-мишень. Третьей стадией является элонгация (достройка) праймеров в сторону фрагмента-мишени под действием ДНК-полимеразы. Продолжительность реакции обычно составляет 30-40 циклов. Поскольку число молекул ДНК удваивается в каждом цикле, то многократное их повторение приводит к экспоненциальному нарастанию (амплификации) количества специфических фрагментов ДНК (ампликонов). Так, если один цикл продолжается менее 3 минут, то менее чем через 2 часа, можно получить около миллиарда копий определяемой последовательности ДНК. Начиная со второго цикла, в реакционной смеси накапливаются специфические продукты амплификации, так называемые «ампликоны», ограниченные по длине двумя праймерами. Именно этот продукт реакции затем выявляют (детекция) методом электрофореза или гибридизации с меченным ДНК-зондом (Обухов И.Л.и др., 1996).
На сегодняшний день производятся тест-системы для выявления C. psittaci и C. pecorum методом ПЦР, которые обладают 100% специфичностью и чувствительностью 10 копий ДНК на 1 мл образца (Обухов И.Л., 1994). Таким образом, ПЦР превосходит все биохимические и иммуноферментные методы лабораторной диагностики инфекций, в частности хламидиоза, т.к. позволяет определять единичные копии инфекционного возбудителя в исследуемом образце клинического материала.
При работе методом ПЦР в лаборатории специалист сталкивается с целым рядом проблем. Наиболее важной проблемой, имеющей существенное значение, является контаминация компонентов реакции и инструментария ранее амплифицированным материалом. Поэтому при проведении ПЦР анализа требуется территориальное разделение выполнения отдельных процедур в лаборатории на 3 зоны. Первая зона предназначена для выделения ДНК из биологического материала, вторая зона – для проведения ПЦР, и в третьей зоне находится оборудование для детекции продуктов амплификации (Панин А.Н., Обухов И.Л., Шипулин Г.А., Груздев К.Н., 1997).
Диагностическая чувствительность и специфичность ПЦР, зачастую превосходит культуральный метод, называемым «золотым стандартом» для выделения хламидий. Тем более, если учесть продолжительность процедуры выращивания культуры клеток (до нескольких недель), то преимущество метода ПЦР становится несомненным, т.к. ПЦР-анализ проводится в течение 4-5 часов и для его проведения используется любой материал.
