
- •Часть II. Частная патология
- •Раздел 3. Патология исполнительных систем и органов
- •Глава 22. Общие сведения о патологии
- •22.1. Введение
- •22.2. Классификация нарушений системы крови
- •22.3. Основные типовые формы патологии системы крови
- •Белой крови; 4) системы тромбоцитов, 5) системы гемостаза (свертывающей, противосвертывающей и фибринолитической систем крови). Эти расстройства могут быть как изолированными, так и сочетанными.
- •22.4. Особенности патологии системы крови
- •22.5. Нарушения объема крови и соотношения форменных элементов и плазмы крови
- •Глава 23. Патология системы красной крови
- •23.1. Качественные изменения эритроцитов крови
- •23.2. Количественные нарушения эритроцитов в крови
- •23.2.1. Эритроцитозы. Их виды и характеристика
- •Относительные эритроцитозы бывают гемоконцентрационными и перераспределительными.
- •23.2.2. Анемии. Классификация. Виды. Характеристика
- •Классификация анемий
- •Постгеморрагические анемии
- •Гемолитические анемии
- •Приобретенные га (экзоэритроцитарные)
- •Наследственные га (эндоэритроцитарные)
- •Анемии вследствие нарушения кровообразования ( дизэритропоэтические анемии)
- •Железодефицитные анемии
- •В12- и фолиеводефицитная анемия
- •Гипо - и апластические анемии
- •23.3. Основные принципы терапии анемий
- •Глава 24. Патология системы белой крови Введение
- •Классификация патологии системы белой крови
- •Этиология нарушений системы белой крови
- •24.1. Качественные нарушения лейкоцитов крови
- •24.2. Количественные нарушения лейкоцитов в крови
- •24.2.1. Лейкоцитозы и их характеристика
- •Классификация лейкоцитозов
- •24.3. Характеристика основных клинических форм патологии системы белой крови
- •Агранулоцитоз
- •Лейкемоидные реакции
- •24.4. Принципы терапии заболеваний и синдромов системы белой крови
- •Глава 25. Гемобластозы
- •Общие нарушения при гемобластозах
- •25.1. Гематосаркомы и их характеристика
- •Лимфогранулематоз (болезнь Ходжкена)
- •Миеломная болезнь
- •25.2. Лейкозы и их характеристика
- •Патогенез лейкозов
- •25.2.1. Классификация лейкозов
- •Лейкемоидные реакции
- •25.2.2. Острые лейкозы. Характеристика. Принципы лечения
- •Отличие лейкемоидных реакций от лейкозов
- •Общая характеристика некоторых видов острых лейкозов
- •Клиническая картина разных видов острых лейкозов
- •Стадии развития острых лейкозов
- •Морфологическая анаплазия клеток крови при острых лейкозах
- •Принципы лечения острых лейкозов
- •25.2.3. Хронические лейкозы. Характеристика. Принципы лечения
- •Хронический миелолейкоз
- •Лечение хронического миелолейкоза
- •Хронический лимфолейкоз
- •Лечение хронического лимфолейкоза
- •Глава 26. Типовые формы и механизмы нарушений гемостаза
- •26.1. Гемостаза и основные его механизмы
- •26.1.1. Тромбоцитарно-сосудистый гемостаз
- •26.1.2. Коагуляционный гемостаз
- •Повреждение сосудистойстенки
- •26.1.3. Антикоагулянтная система крови
- •26.1.4. Фибринолитическая система крови
- •26.2. Тромбофилия и ее механизмы
- •26.2.1. Изменения тромбогенной и тромборезистентной активности сосудистой стенки
- •26.2.2. Повышение функциональной активности тромбоцитов и тромбоцитозы
- •26.2.3. Гиперкоагуляция и ее механизмы
- •26.2.3.1. Увеличение содержания прокоагулянтов в крови
- •26.2.3.2. Снижение антикоагулянтной активности крови
- •26.2.3.3. Угнетение фибринолиза
- •26.2.4. Гипокоагуляция и ее механизмы
- •26.2.4.1. Тромбоцитопении
- •26.2.4.2. Тромбоцитопатии
- •26.2.4.3. Дефицит плазменных прокоагулянтов
- •26.2.4.4. Повышение антикоагулянтной активности крови
- •26.2.4.5. Гиперфибринолиз
- •26.2.4.6. Основные типы кровоточивости
- •26.3. Синдром диссеминированного внутрисосудистого свертывания крови
- •26.3.1. Механизмы развития двс-синдрома
- •26.3.2. Хронический двс-синдром
- •26.4. Обследование больных с изменениями в системе гемостаза
- •26.5. Основные принципы терапии нарушений гемостаза
- •Лечение различных форм геморрагических синдромов
- •Глава 27. Патология сердечно-сосудистой системы. Недостаточность кровообращения. КОронарная недостаточность
- •27.2.Недостаточность кровообращения
- •3. По выраженности признаков недостаточности кровообращения:
- •27.3. Коронарная недостаточность
- •27.3.1. Виды КороНарной недостаточности
- •27.3.2. Причины Коронарной Недостаточности
- •27.3.3. Механизмы повреждения сердца при коронарной недостаточности
- •Расстройство процессов энергообеспечения кардиомиоцитов
- •Повреждение мембран и ферментов кардиомиоцитов
- •Дисбаланс ионов и жидкости в кардиомиоцитах
- •Расстройство механизмов регуляции работы сердца
- •Динамика изменений активности механизмов регуляции сердца
- •Эффекты постокклюзионной реперфузии миокарда
- •27.3.4.ИзменениЯ основных показателей функции сердца
- •27.3.5.Принципы терапии коронарной недостаточности
- •Глава 28. Сердечная недостаточность
- •28.1. Этиология Сердечной недостаточности
- •Факторы, непосредственно повреждающие сердце бывают:
- •Факторы, обусловливающие функциональную перегрузку сердца
- •28.2. Виды сердечной недостаточности
- •28.3. Общий патогенез развития
- •Механизмы компенсации сниженной сократительной функции сердца
- •Механизмы декомпенсации гипертрофированного сердца
- •Повреждение мембранного аппарата ферментных систем кардиомиоцитов
- •Нарушение содержания и соотношения между отдельными ионами внутри и вне клеток миокарда
- •Нарушения в генетической программе и/или механизмах её реализации
- •Расстройства нейрогуморальной регуляции сердца
- •28.4. Нарушения функций сердца и центральной гемодинамики при сердечной недостаточности
- •28.5. Принципы нормализации функциЙ сердца
- •Принципы, цели и группы фармакологических препаратов, применяемых для нормализации функции сердца при его недостаточности
- •Глава 29. Нарушения ритма сердца (аритмии) Введение
- •29.1. Виды аритмий. Их этиология и патогенез
- •29.1.1. Аритмии, возникающие в результате нарушений автоматизма
- •Виды аритмий, развивающихся в результате нарушений автоматизма
- •Изменения показателей гемодинамики при синусовых аритмиях
- •Изменения коронарного кровотока при синусовых аритмиях
- •Гетеротопные аритмии. Их характеристика
- •Нарушения системной гемодинамики при гетеротопных аритмиях
- •Нарушения коронарного кровотока при гетеротопных аритмиях
- •29.1.2. Аритмии, возникающие в результате нарушений проводимости
- •Характеристика основных расстройств проводимости
- •Расстройства гемодинамики при аритмиях в результате нарушения проведения электрического импульса
- •Расстройства коронарного кровотока при аритмиях в результате нарушения проведения возбуждения
- •29.1.3. Аритмии, возникающие в результате сочетанных нарушений возбудимости и проводимости
- •Повторная циркуляция возбуждения по замкнутому контуру
- •29.2. Принципы терапии нарушений ритма сердца
- •Глава 30. Нарушения системного уровня Артериального давления
- •Виды артериальных гипертензий (аг)
- •1) Нейрогенные:
- •5) Смешанные.
- •31.1.1. Характеристика основных видов артериальных гипертензий
- •Центрогенные аг
- •Причины центрогенных аг
- •Патогенез центрогенных аг
- •1) Аг, обусловленные нарушением высшей нервной деятельности (неврозом).
- •2) Аг, обусловленные органическими повреждениями структур мозга, участвующих в регуляции уровня ад.
- •Цереброишемическая гипертензия
- •Рефлекторные аг
- •«Условнорефлекторные» нейрогенные аг
- •Безусловнорефлекторные аг
- •1) Развивающиеся в результате хронического раздражения экстеро- и интерорецепторов, нервных стволов или центров.
- •2) Формирующиеся вследствие прекращения афферентной импульсации, оказывающей тормозящее («сдерживающее», «депрессорное») влияние на тоническую прессорную активность кардиовазомоторного центра.
- •Эндокринные аг
- •Аг при патологии надпочечников
- •Кортикостериоидные надпочечникоовые аг
- •Минералокортикоидные аг
- •Глюкокортикоидные аг
- •«Катехоламиновые» надпочечниковые аг
- •Аг при гипертиреоидных состояниях
- •Аг при расстройствах эндокринных функций гипоталамо-гипофизарной системы
- •Аг при гиперпродукция кортиколиберина (кл) и актг
- •Аг при других эндокринопатиях
- •Метаболические аг
- •Почечные аг
- •Вазоренальная аг
- •Ренопривная аг
- •Гипоксические аг
- •Гемические аг
- •Гипертоническая болезнь (эссенциальная гипертензия)
- •Общая этиология гб
- •Основные звенья патогенеза гб
- •Смешанные аг
- •Характеристика Местных аг
- •30.1.2. Принципы лечения артериальных гипертензий
- •2) При эндокринных аг необходимо:
- •3) При гипоксических (метаболических) аг целесообразно:
- •4) При гемических аг необходимо:
- •5) При местных аг целесообразно:
- •30.2. Артериальные гипотензии
- •30.2.1. Характеристика основных видов хронических артериальных гипотензий
- •Нейрогенные центрогенные артериальные гипотензии
- •Артериальные гипотензии, обусловленные нарушением высшей нервной деятельности
- •Артериальные гипотензии, обусловленные органическими изменениями в центральных (диэнцефально-гипоталамических) и периферических структурах, участвующих в регуляции ад
- •Рефлекторные артериальные гипотензии
- •Эндокринные артериальные гипотензии
- •Артериальные гипотензии надпочечникового происхождения
- •Артериальные гипотензии при поражении гипофиза
- •Артериальная гипотензия при гипотиреоидных состояниях
- •Артериальные гипотензии, вызванные нарушением метаболизма веществ с гипо- и гипертензивным действием
- •30.2.2. Принципы лечения артериальных гипотензий
- •Глава 31. Патология лимфатической системы
- •31.1. Введение
- •31.2. Транспорт гуморов в организме
- •31.3. Образование тканевой жидкости
- •31.4. Внесосудистое звено гуморального транспота
- •31.5. Таможенная функция интерстиция
- •31.6. Лимфообразование. Механизмы нарушений
- •31.7. Недостаточность транспорта лимфы
- •31.8. Нарушения свертывемости лимфы
- •31.9. Лимфатический отек
- •31.10. Нарушения функций лимфатических узлов
- •31.11. Лимфатическая система при различных видах патологии
- •31.11.1. Влияние перегревания организма
- •31.11.2. Влияние переохлаждения организма
- •31.11.3. Роль лимфатической системы в патогенезе воспаления
- •31.11.4. Роль лимфатической системы в патогенезе атеросклероза
- •31.11.5. Роль лимфатической системы в патогенезе опухолевого процесса
- •31.12. Возможности управления функциями лимфатической системы
- •31.12.1. Эндолимфатическая терапия
- •31.12.2. Лечебные воздействия на интерстициальный гуморальный транспорт и лимфатический дренаж тканей
- •31.12.3. Воздействия на транспорт лимфы
- •31.12.9. Воздействия на функции лимфатических узлов
- •31.12.13. Экстракорпоральная обработка лимфы
- •31.12.14. Эксклюзивные методы лечения конкретных заболеваний
- •31.12.15. Эндоэкологическая реабилитация на клеточно-организменном уровне
- •31.13. Заключение
31.5. Таможенная функция интерстиция
Непосредственная среда обитания клеток призвана обеспечивать постоянство условий их существования. Здесь фильтруется тканевая жидкость и отделяются ненужные клеткам «плевела» от необходимых им питательных «зерен». Оптимальные условия поддерживает «таможенная» функция внеклеточных тканей. Она дозирует прохождения к клеткам нужных им продуктов и этим дополняет функцию гематотканевого барьера. Ненужные клеткам вещества с потоком тканевой жидкости уходят в сосудистую систему.
Н
Рисунок
31. 2. Микроорган. 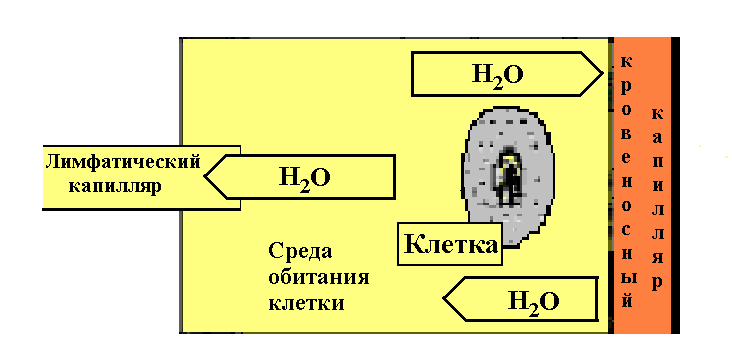 еразрывная
связь метаболизма клетки с транспортом
метаболитов в окружающих ее тканях
(рис. 31.2.) заставляет рассматривать
клетку и окружающие ее ткани как единый
морфо-функциональный блок. Последний
получил термин микрооргана. Позиция
микрооргана предопределила изменение
фундаментальной концепции –«любая
патология есть патология клеток» на
концепцию – «любая
патология есть патология микрооргана».
Соответственно концепция «терапии
клеток» была модифицирована в концепцию
«терапии микрооргана».
Эта позиция стала основанием для создания
соответствующих лечебных средств и
методов.
еразрывная
связь метаболизма клетки с транспортом
метаболитов в окружающих ее тканях
(рис. 31.2.) заставляет рассматривать
клетку и окружающие ее ткани как единый
морфо-функциональный блок. Последний
получил термин микрооргана. Позиция
микрооргана предопределила изменение
фундаментальной концепции –«любая
патология есть патология клеток» на
концепцию – «любая
патология есть патология микрооргана».
Соответственно концепция «терапии
клеток» была модифицирована в концепцию
«терапии микрооргана».
Эта позиция стала основанием для создания
соответствующих лечебных средств и
методов.
Еще в девятнадцатом веке И.И.Мечников выдвинул гипотезу «гистерезиса протоплазмы», согласно которой одним из основных механизмов старения организма является отставание темпов удаления поступающих в ткани веществ от темпов их поступления в них. Позже выяснилось, что такое отставание зависит от угнетения таможенной функции окружающих клеточно-тканевых структур и играет ключевую роль не только в механизме старения, но и в патогенезе многих заболеваний. Этот же механизм лежит в основе преимущественного накопления в указанном секторе токсичных веществ, поступивших и/или образовавшихся в организме вследствие эколого-эндоэкологического неблагополучия. Учитывая сказанное, микроорган назван «Ахилессовой пятой человечества».
31.6. Лимфообразование. Механизмы нарушений
Лимфообразование – один из ключевых этапов гуморального транспорта. Как синоним используют термин «лимфатический дренаж». Нарушение образования лимфы может быть самостоятельным и может вызываться нарушениями транспорта в капиллярах крови, в интерстиции и/или в лимфососудистом русле. Чаще всего причиной являются патологические процессы вне сосудистой системы (воспаление, опухоль, травма и др.).
Различают общее (системное) и местное (регионарное, локальное) нарушения лимфообразования.
Общее уменьшение образования лимфы проявляется при обезвоживании, кровопотере, шоке, кахексии. В менее острой форме оно возникает по причине возрастного уменьшения числа функционирующих кровеносных и лимфатических сосудов.
Общее увеличение образования лимфы возникает как реакция на физическую нагрузку, может наблюдаться при введении крови, кровезаменяющих растворов или препаратов, стимулирующих лимфатический дренаж.
Местное нарушение образования лимфы может возникнуть как проявление собственной патологии лимфатической системы, но чаще является непременным компонентом любого локального патологического процесса (воспаление, некроз, инфаркт, опухолевый рост, тромбоз, венозная недостаточность и др.). Оно влияет на развитие заболевания и может предопределить его исход.
Неадекватность функции образования лимфы — несоответствие лимфообразования, даже если оно возросло, той потребности, которую испытывает организм, орган или ткань в сложившейся физиологической или патологической ситуации.
Основные силы, участвующие в образовании тканевой жидкости и лимфы и их соотношение в физиологических условиях математически отобразил Е. Starling (1896). Предложенные им формулы (1, 2) позволили перейти от эмпирических рассуждений о механизмах лимфообразования к их количественной характеристике.
Согласно формуле № 1: ПТ=КФК(ДСТ – КОСОСТ), где
ПТ — объем фильтрата (включая входящие в него ингредиенты), проходящего через стенки кровеносных капилляров (мл/мин х 100 г ткани); КФК — коэффициент фильтрации стенки кровеносных капилляров (мл/мин х 100 г ткани х мм рт. ст.); ДСТ — градиент капиллярного (ДС) и тканевого (ДТ) гидростатического давления (мм рт. ст.); КОС— коэффициент ограничения проницаемости белка через стенку кровеносного капилляра (при 0 - ограничения нет, свыше 0 и менее 1 — различная степень ограничений, при 1 – полное непрохождение); OCT — градиент коллоидно-осмотического давления плазмы (ОС) и тканей (ОТ) х (мм рт. ст.);
Согласно формуле № 2: ПЛ= КФЛ (ДТЛ – КОЛ ОТЛ), где
ПЛ — объем фильтрата (включая все входящие в него ингредиенты), проходящего из тканей в лимфатические капилляры (мл/мин х 100 г ткани); КФЛ — коэффициент фильтрации стенки лимфатического капилляра (мл/мин х 100 г ткани х мм рт. ст.); ДТЛ — градиент тканевого (ДТ) и эндолимфатического (Дл) гидростатического давления (мм рт. ст.); КОЛ — коэффициент ограничения проницаемости белка через стенку лимфатического капилляра (при 0 — ограничения нет, при свыше 0 и менее 1 — разная степень ограничения, при 1 – полное непрохождение); ОТЛ — градиент тканевого (От) и эндолимфатического (Ол) коллоидно-осмотического давления (мм рт. ст.).
Нарушения Пт и Пл могут быть результатом патологических сдвигов в любом звене гуморального транспорта. Величина КФК в различных тканях не одинакова. Например, в перфузируемых скелетных мышцах она составляет 0,0015 мл/мин х 100 г ткани х мм рт. ст., а в мышце сердца — 0,32 мл/мин х 100 г х мм рт. ст. Неодинакова она и в разных зонах одного и того же органа. На величину КФК влияют сдвиги, возникшие в интерстиции и клетках эндотелия при ишемических и дистрофических нарушениях. Показано, что увеличение КФК, как правило, таит угрозу развития отека.
Величина ДСТ чрезвычайно изменчива даже в одной ткани (колебания в пределах 10—30 мм рт. ст). В случаях выключения из циркуляции части капилляров (периодическое в норме и стабильное при патологии) Д СТ в регионе становится нулевым. Величина ДС при увеличении венозного давления возрастает, что ведет к расширению межэндотелиальных щелей, повышению ДСТ, росту КФК, усилению фильтрации и повышению образования тканевой жидкости.
О![]() дной
из мишеней воздействия наДС
и, следовательно,
на ДСТ
являются рецепторы сосудов. В экспериментах
на животных введение
1-адреномиметиков
(приводящее к констрикторной
реакции артериальных сосудов
и уменьшению капиллярного кровотока)
ведет к цепной реакции падения Сходно
действуют -адреноблокаторы,
вызывающие расширение
венул и усиление оттока крови из тканей.
Введение -адреноблокаторов
и -адреномиметиков
дает противоположный ответ.
Однако получаемые в экспериментах
подобные эффекты не всегда реализуется
в клинике, что объясняется
многофакторным действием указанных
веществ и разным состоянием организма.
дной
из мишеней воздействия наДС
и, следовательно,
на ДСТ
являются рецепторы сосудов. В экспериментах
на животных введение
1-адреномиметиков
(приводящее к констрикторной
реакции артериальных сосудов
и уменьшению капиллярного кровотока)
ведет к цепной реакции падения Сходно
действуют -адреноблокаторы,
вызывающие расширение
венул и усиление оттока крови из тканей.
Введение -адреноблокаторов
и -адреномиметиков
дает противоположный ответ.
Однако получаемые в экспериментах
подобные эффекты не всегда реализуется
в клинике, что объясняется
многофакторным действием указанных
веществ и разным состоянием организма.
Величина ДТ при использовании разных методов колеблется от -7 до +2 мм рт. ст. Превышение этих пределов свидетельствует о гипергидратации тканей, что ведет к поломке механизмов внутритканевого гуморальноготранспорта и отеку.
Величина КОС, играет важную роль в физиологических условиях, особое значение приобретает при патологии. Так, потеря или уменьшение способности ограничивать приток плазменных белков в ткани, ведет к повышению их содержания в последних (а, значит – к увеличению внутритканевого онкотического давления). Это способствует росту От, задержке в тканях воды и развитию в них отека.
Величина ДСТ в большой мере зависит от ОС. В норме она варьирует от 20 до 30 мм рт. ст. Увеличение ОС ведет к задержке жидкости в кровеносной системе и уменьшению ПТ. Снижение ОС ведет к обратному эффекту.
Величина ОТ представляет сумму внутритканевого онкотического и осмотического давлений и определяется спецификой регионального строения ткани и степенью их повреждения при патологии. Чем сильнее повреждение, тем выраженнее накопление продуктов, повышающих ОТ и ПТ, вплоть до развития отека.
Величина КфЛ (в соответствии с формулой Старлинга №2), характеризует поэтапное (фазное) прохождение тканевой жидкости через стенку лимфатического капилляра. Решающая роль в этом процессе принадлежит эндотелиальным клеткам. Последние функционируют подобно клапанам, реализуя фазу открытия, когда в капилляре образуются зияющие межэндотелиальные щели, и фазу закрытия, когда путь жидкости в лимфатический капилляр полностью перекрывается. Во время фазы открытия в лимфатическом капилляре возникает разряжение, создающее эффект «всасывания» тканевой жидкости. Отграничение проникшей в лимфатический капилляр фракции тканевой жидкости от оставшейся в тканях знаменует этап образования первичной лимфы. Естественно, что любой патологический процесс в тканях приводит к нарушению процесса лимфообразования.
Клапанная функция эндотелиальных клеток предопределена морфологически. Стенка лимфатического капилляра связана с окружающей соединительной тканью тончайшими волокнами, так называемыми, стропными филаментами. Их натяжение и ослабление подчинено перепадам (ДТ). Сдвиг в сторону положительного давления сопровождается накоплением жидкости в тканях. Формируется сначала скрытый, а затем - явный отек.
Теоретически, коллоидноосмотическое давление в лимфатическом капилляре (Ол) в фазе открытия «входных клапанов» должно быть равно коллоидноосмотическому давлению в ткани (От). Однако электронномикроскопические исследования показали, что концентрация белков в капиллярной лимфе примерно в 3 раза больше, чем в соединительной ткани.. Это явление можно объяснить более интенсивным, по сравнению с водой, поступлением в лимфатические капилляры белка и/или просачиванием из них в ткани безбелковой части лимфы, что ведет к ее сгущению. Последнее явление отмечено и в более крупных лимфатических сосудах. Показано, что частицы углерода мигрируют из лимфатических капилляров и сосудов в окружающие соединительные ткани. Так как их перемещение возможно только с молекулами воды, это количественно характеризует ее выход. Замедление лимфооттока и лимфостаз усугубляют выход воды из сосудов и сгущение лимфы, что, естественно, отражается на ее образовании.
