
- •Міністерство освіти і науки, молоді та спорту України
- •Навчальний посібник до вивчення курсу «Основи проектування хімічних виробництв»
- •Оглавление
- •Глава 1 основные этапы и организация проектирования
- •Глава 2 состав исходных данных и основные стадии
- •Глава 3 системы автоматизированного проектирования 78
- •Глава 4 введение в проектирование 90
- •Глава 5 выбор и разработка технологической схемы
- •Глава 6 выбор технологического оборудования
- •Глава 7 уравнения материального баланса технологи-
- •Глава 8 технологический расчет основной и
- •Глава 9 тепловой расчет основного оборудования 141
- •Глава 10 гидравлические расчеты 166
- •Глава 11 механический расчет 175
- •Глава 12 конструкционные материалы в химическом
- •Глава 13 оформление отдельных элементов химической
- •Глава 14 трубопроводы и трубопроводная арматура 224
- •Глава 15 вспомогательное оборудование химических
- •Введение
- •Глава 1 основные этапы и организация проектирования химических производств
- •1.1. Перспективный план и технико-экономическое обоснование
- •1.2. Задание на проектирование
- •1.3. Выбор района размещения предприятия и площадки строительства
- •1.3. «Роза ветров» района размещения предприятия и площадки строительства
- •1.4. Основные принципы проектирования зданий и сооружений химической промышленности
- •1.5. Разработка проектной документации по охране окружающей среды
- •1.5.1. Экологическое прогнозирование
- •1.5.2. Разработка прогноза загрязнения воздуха
- •1.5.3. Прогнозирование состояния поверхностных и подземных вод
- •1.5.4. Прогноз воздействия объекта при возможных авариях
- •1.6. Технологический процесс как основа промышленного проектирования
- •1.7. Генеральный план химических предприятий
- •1.8. Типы промышленных зданий
- •1.8.1 Основные элементы конструкции производственных зданий и их назначение
- •1.8.2 Одноэтажные промышленные здания
- •1.8.3. Многоэтажные здания
- •1.8.4. Вспомогательные здания и помещения химических предприятий
- •1.8.5. Склады промышленных предприятий
- •1.9. Инженерные сооружения
- •1.10. Специальные вопросы проектирования химических предприятий
- •Глава 2 состав исходных данных и основные стадии
- •2.2 Виды конструкторских документов
- •2.3. Содержание разделов исходных данных для проектирования промышленного химического производства
- •Раздел 1. Общие сведения и технология
- •Раздел 2. Характеристика выполненных научно-исследовательских и опытных работ, положенных в основу исходных данных для проектирования
- •Раздел 3. Технико-экономическое обоснование рекомендуемого метода производства. Перспективы производства и потребления
- •Раздел 4. Патентный формуляр
- •Раздел 5. Техническая характеристика исходного сырья, вспомогательных материалов, основных и конечных продуктов. Целевое назначение и области применения основных продуктов
- •Раздел 6. Физико-химические корстанты и свойства исходных,
- •Раздел 7. Химизм, физико-химические основы и принципиальная
- •Раздел 8. Рабочие и технологические параметры производства
- •Раздел 9. Материальный баланс производства
- •Раздел 10. Технологическая характеристика побочных продуктов и
- •Раздел 11. Математическое описание технологических процессов и
- •Раздел 12. Данные для расчета, конструирования и выбора основного промышленного технологического оборудования и защиты строительных конструкций
- •Раздел 13. Рекомендации для проектирования автоматизации
- •Раздел 14. Аналитический контроль производства
- •Раздел 15. Методы и технологические параметры очистки химически и механически загрязненных сточных вод, обезвреживания газовых выбросов и ликвидации вредных отходов
- •Раздел 16. Мероприятия по технике безопасности, промсанитарии и противопожарной профилактике
- •Раздел 17. Указатель отчетов и рекомендуемой литературы по
- •2.4 Проектирование в системе подготовки
- •2.4.1 Курсовое проектирование
- •2.4.2. Дипломное проектирование
- •Глава 3 системы автоматизированного проектирования
- •3.1. История развития сапр
- •3.2. Основные принципы создания сапр
- •3.3 Применение эвм для автоматизации процесса пректирования
- •3.4. Автоматическое изготовление чертежей
- •3.5 Основные преимущества автоматизации проектирования.
- •3.6. Основные требования к сапр
- •3.7. Связь сапр с производством, расширение области применения
- •Глава 4 введение в проектирование
- •4.1. Проектно-сметная документация
- •4.2. Технико-экономическое обоснование проекта
- •4.2.1. Исходные положения
- •4.2.2. Обоснование способа производства химической продукции
- •4.2.3. Экономика строительства предприятия и производства продукции
- •Глава 5 выбор и разработка технологической схемы производства
- •5.1. Общие положения
- •5.2. Последовательность разработки технологической схемы
- •5.3. Принципиальная технологическая схема
- •5.4. Размещение технологического оборудования
- •Глава 6 выбор технологического оборудования химических производств
- •6.1. Основные типы химических реакторов
- •6.2. Химические факторы, влияющие на выбор реактора
- •6.2.1. Реакции расщепления
- •6.2.2 Реакции полимеризации
- •6.2.3. Параллельные реакции
- •6.2.4. Комбинация реактора смешения с реактором вытеснения
- •6.3. Эскизная конструктивная разработка основной химической аппаратуры
- •6.3.1. Общие положения
- •6.3.2. Реакторы
- •6.4. Оптимизация процессов химической технологии
- •Глава 7 уравнения материального баланса технологического процесса
- •7.1. Стехиометрические расчеты
- •7.2. Общее уравнение баланса массы
- •7.3. Практический материальный баланс
- •7.4. Физико-химические основы технологического процесса
- •Глава8 технологический расчет основной и вспомогательной аппаратуры
- •8.1. Общие положения
- •8.2. Расчет объемов реакторов
- •8.2.1. Основные положения химической кинетики
- •8.2.2. Расчет идеальных реакторов
- •8.3. Определение объемов аппарата
- •Глава 9 тепловой расчет основного оборудования
- •9.1. Общее уравнение баланса энергии
- •9.2. Практический тепловой баланс
- •9.3. Теплообмен в реакторах
- •9.4. Расчет энтальпий и теплоемкостей
- •9.5. Расчет реактора периодического действия
- •9.6. Степень термодинамического совершенства технологических процессов
- •Глава 10 гидравлические расчеты
- •10.1. Расчет диаметра трубопровода
- •10.2. Расчет гидравлических сопротивлений в трубопроводе
- •10.3. Гидравлическое сопротивление кожухотрубчатых теплообменников
- •10.4. Подбор насосов
- •Глава 11 механический расчет
- •11.1. Расчет сварных химических аппаратов
- •11.1.1. Основные расчетные параметры
- •11.1.2. Расчет на механическую прочность
- •11.1.3 Требования к конструированию.
- •11.1.4 Расчет цилиндрических обечаек.
- •11.1.6. Подбор стандартных элементов
- •11.2. Расчет толстостенных аппаратов
- •Глава 12 конструкционные материалы в химическом машиностроении
- •12.1. Виды конструкционных материалов
- •12.2. Коррозия металлов и сплавов
- •12.2.1. Виды коррозии
- •12.2.2. Виды коррозионных разрушений
- •12.2.3. Способы борьбы с коррозией
- •12.3. Влияние материала на конструкцию аппарата и способ его изготовления
- •12.3.1. Конструкционные особенности аппаратов из высоколегированных сталей
- •12.3.2. Конструктивные особенности эмалированных аппаратов
- •12.3.3. Конструктивные особенности аппаратов из цветных металлов
- •12.3.4. Конструктивные особенности аппаратов из пластмасс
- •Глава 13 оформление отдельных элементов химической аппаратуры
- •13.1. Оформление поверхности теплообмена
- •13.2. Перемешивающие устройства
- •13.3. Уплотнения вращающихся деталей
- •Глава 14 трубопроводы и трубопроводная арматура
- •Глава 15 вспомогательное оборудование химических заводов
- •15.1. Виды вспомогательного оборудования
- •15.2. Транспортные средства
- •15.2.1. Классификация транспортных средств для твердых материалов
- •15.2.2. Машины для транспортировки жидкостей и газов
- •Список рекомендованой литературы
- •1Вимоги до оформлення розрахунково-пояснювальної записки та графічної частини
- •1.1 Загальні вимоги
- •1.2 Вимоги до тексту
- •1.2.10. Оформлення ілюстрацій і додатків.
- •1.3 Оформлення графічної частини
- •2 Склад розрахунково-пояснювальної записки
- •3 Стандартизація і метрологія
- •4 Матеріалоємність і ресурсозбереження
- •5 Будівельна частина
- •5.1 Вибір майданчика для будівництва
- •5.2 Пов’язування технологічної лінії з об’ємно-планувальним рішенням промислової будови
- •5.3 Вибір конструктивного рішення будівлі
- •5.4 Допоміжні будівлі і приміщення
6.4. Оптимизация процессов химической технологии
Оптимизация предполагает достижения наилучших или определение наибо-
лее благоприятных условий проведения химического процесса. При оптимизации химико-технологических систем (ХТС) качество функционирования систем опре-
деляют с помощью критериев, или показателей эффективности, под которыми понимают числовые характеристики системы, оценивающие степень её приспособления к выполнению поставленных перед ней задач.
Основные показатели эффективности ХТС следующие:
- технологические показатели;
- качественные показатели выпускаемой продукции;
- экономические показатели.
Показателями эффективности отдельных аппаратов, узлов, отделений чаше всего являются технологические критерии - удельная производительность, выход целевого продукта, КПД и т.д.
Технологическими критериями эффективности являются степень конверсии, селективность (доля превращенного исходного реагента, израсходованная на обра-
зование данного продукта), выход продукта.
Различают две стадии оптимизации: статическую и динамическую. В зависимости от характера рассматриваемых математических моделей применяются различные математические методы оптимизации: аналитические, методы математического программирования, градиентные и статистические.
Пример 6.1. Параметр оптимизации - степень конверсии. В реакторе смешения протекает гетерогенно-каталитическая реакция гидрирования
А+ Н2 → В,
которая подчиняется кинетическому уравнению
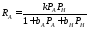
Объем реактора Vр=10м3; давление P0 = 7МПа ; температура T=250оС. Суммарная скорость подачи реагентов 10 кмоль/с, коэффициенты bА= 10 МПа-1 и
bH = 10 МПа-1. Константа скорости реакции k =30кмоль/(м3 с МПа2).
Найти соотношение исходных реагентов, при которых степень конверсии вещества А (ХA) будет максимальной.
Решение: Для того чтобы выразить парциальные давления веществ через сте-
пень конверсии соединения А, составим парциальный мольный баланс:
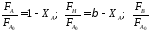 =XA,
где
=XA,
где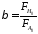
Тогда
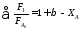
Здесь FB, FА, FH, FАо - производительность по целевому продукту В и по исходным веществам А и Н соответственно.
Парциальные давления реагирующих веществ составляют:

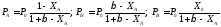
Характеристическое уравнение реактора идеального смешения имеет вид
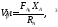
Поэтому
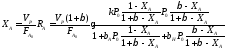
Ввиду сложности аналитического решения полученного уравнения поиск β, соответствующего максимальной степени конверсии, проводят путем оптимизации функции вида
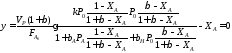
методом золотого сечения в диапазоне β от 1 до 3.
Ниже представлены численные значения XА при заданных β.
|
β |
1,00 |
1,20 |
1,40 |
1,60 |
1,80 |
2,00 |
|
ХА |
0,946 |
0,900 |
0,969 |
0,963 |
0,968 |
0,962 |
Максимальная степень конверсии ХА = 0,969 достигнута при избытке β= 1,40
Глава 7 уравнения материального баланса технологического процесса
7.1. Стехиометрические расчеты
Все количественные соотношения при расчете химических процессов основаны на стехиометрии реакций. Количество вещества при таких расчетах удобнее выражать в молях, или производных единицах (кмоль, ммоль, и т.д.). Моль является одной из основных единиц СИ. Один моль любого вещества соответствует его количеству, численно равному молекулярной массе. Поэтому молекулярную массу в этом случае следует считать величиной размерной с единицами: г/моль, кг/кмоль, кг/моль. Так, например, молекулярная масса азота 28 г/моль, 28 кг/кмоль, но 0,028 кг/моль.
Массовые и мольные количества вещества связаны известными соотношениями
NА = mА/МА; mА = NА МА,
где NА - количество компонента А, моль; mA - масса этого компонента, кг;
МА - молекулярная масса компонента А, кг/моль.
При непрерывных процессах поток вещества А можно выражать его моль-
ным количеством в единицу времени
WA = NA/τ,
где WA — мольный поток компонента А, моль/с; τ — время, с.
Для простой реакции, протекающей практически необратимо, обычно стехиомет
рическое уравнение записывается в виде
vAА + vBВ = vRR + vSS.
Однако удобнее записывать стехиометрическое уравнение в виде алгебраическо
го, принимая при этом, что стехиометрические коэффициенты реагентов отрицательны, а продуктов реакции положительны:
Тогда для каждой простой реакции можно записать следующие равенства:

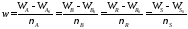
Индекс «0» относится к начальному количеству компонента.
Эти равенства дают основание получить следующие уравнения материального баланса по компоненту для простой реакции:

Пример 7.1. Реакция гидрирования фенола до циклогексанола протекает по урав-
нению
С6Н5ОН + ЗН2 = С6Н11ОН, или А + ЗВ = R.
Вычислить количество образовавшегося продукта, если начальное количество компонента А было 235 кг, а конечное - 18,8 кг
Решение: Запишем реакцию в виде
R - А - ЗВ = 0.
Молекулярные массы компонентов: МА = 94 кг/кмоль, МВ = 2 кг/кмоль и
МR = 100 кг/кмоль. Тогда мольные количества фенола в начале и в конце реакции будут:
NA0 = 235/94 = 2,5; NA0 = 18,8/94 =0,2; n = (0,2 - 2,5)/(-1) = 2,3.
Количество образовавшегося циклогексанола будет равно
NR = 0 +1∙2,3 = 2,3 кмоль или mR = 100∙2,3 = 230 кг.
Определение стехиометрически независимых реакций в их системе при материальных и тепловых расчётах реакционных аппаратов необходимо для исключения реакций, являющихся суммой или разностью некоторых из них. Такую оценку наиболее просто можно осуществить по критерию Грама.
Чтобы не проводить излишних расчетов, следует оценить, является ли система стехиометрически зависимой. Для этих целей необходимо:
- транспонировать исходную матрицу системы реакций;
- умножить исходную матрицу на транспонированную;
- вычислить определитель полученной квадратной матрицы.
Если этот определитель равен нулю, то система реакций стехиометрически зависима.
Пример 7.2. Имеем систему реакций:
FеО + Н2 = Fе + Н2O;
Fе2О3+ 3Н2 = 2Fе + 3Н2O;
FеО + Fе2O3 + 4Н2 = 3Fе + 4Н2O.
Эта система стехиометрически зависима, так как третья реакция является суммой двух других. Составим матрицу
|
FеО |
Fе2O3 |
H2 |
Fе |
H2O |
|
-1 |
0 |
-1 |
1 |
1 |
|
0 |
-1 |
-3 |
2 |
3 |
|
-1 |
-1 |
-4 |
3 |
4 |
Определитель равен нулю. При отбрасывании третьей реакции определитель равен 28, т.е. две первых реакции стехиометрически независимы.

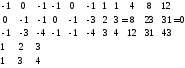
Для удаления стехиометрически зависимых реакций в системе необходимо составить матрицу системы. Допустим для системы реакций:
4NН3 + 5О2 = 4NО + 6Н2O; 4NH3+ 3О2 = 6Н2O + 2N2;
4NН3 + 6Н2O = 5N2+ 6Н2O;
O2 + 2NO = 2NO2; 2NO = O2 + N2; 2O2 + N2 = 2NO2,
можно составить матрицу:
|
NH3 |
O2 |
NO |
Н2O |
N2 |
NO2 |
|
-4 |
-5 |
4 |
6 |
0 |
0 |
|
-4 |
-3 |
0 |
6 |
2 |
0 |
|
-4 |
0 |
-6 |
6 |
5 |
0 |
|
0 |
-1 |
-2 |
0 |
0 |
2 |
|
0 |
1 |
-2 |
0 |
1 |
0 |
|
0 |
-2 |
0 |
0 |
-1 |
2 |
По сути, к данной матрице следует применить преобразование Гаусса. Заменим вторую и третью строку их разностями с первой и умножим на 2, разделим на 5 третью строку, которую вычтем из второй. Затем умножим четвертую и пятую строку на 2 и вычтем их из второй:
|
-4 -5 |
4 |
6 |
0 |
0 |
|
-4 |
-5 |
4 |
6 |
0 |
0 |
|
0 -2 |
4 |
0 |
-2 |
0 |
|
0 |
-2 |
4 |
0 |
-2 |
0 |
|
0 0 |
0 |
0 |
0 |
0 |
|
0 |
0 |
0 |
0 |
0 |
0 |
|
0 -1 |
-2 |
0 |
0 |
2 |
|
0 |
0 |
8 |
0 |
-2 |
-4 |
|
0 1 |
-2 |
0 |
1 |
0 |
|
0 |
1 |
-2 |
0 |
1 |
0 |
|
0 -2 |
0 |
0 |
-1 |
2 |
|
0 |
-2 |
0 |
0 |
-1 |
2 |
Умножим пятую строку на - 2 и вычтем ее из второй, а также вычтем из второй строки шестую. Умножив затем шестую строку на 2 и вычитая ее из четвертой, получим окончательно
|
4 |
-5 |
4 |
6 |
0 |
0 |
|
0 |
-2 |
4 |
0 |
-2 |
0 |
|
0 |
0 |
0 |
0 |
0 |
0 |
|
0 |
0 |
8 |
0 |
-2 |
-4 |
|
0 |
0 |
0 |
0 |
0 |
0 |
|
0 |
0 |
0 |
0 |
0 |
0 |
Отсюда видно, что третья, пятая и шестая реакции являются стехиометрически зависимыми. Окончательно система примет вид, если для простоты расчетов подставить вместо полученной четвертой реакции ее разность со второй
4NH3 + 5O2 = 4NO + 6Н2O; 2NO = N2 + O2; 2NО + О2 = 2NO2
Одновременно с числом стехиометрически независимых реакций определяется равное ему число ключевых веществ, по которым можно составить материальный баланс реакций. В простой реакции основное вещество одно. В сложных реакциях выбор независимых реакций и основных веществ взаимосвязан и определяется тем, чтобы в каждой независимой реакции участвовало хотя бы одно основное вещество и, кроме того, выбранные основные вещества участвовали бы в одной или в некотором минимуме реакций. Так, в предыдущем примере в качестве основных можно выбрать аммиак, азот и диоксид азота.
Для каждой из независимых реакций можно записать:
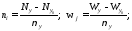
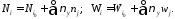
Здесь i - индекс, соответствующий веществу, j - индекс, соответствующий номеру реакции.
