
- •Міністерство освіти і науки, молоді та спорту України
- •Навчальний посібник до вивчення курсу «Основи проектування хімічних виробництв»
- •Оглавление
- •Глава 1 основные этапы и организация проектирования
- •Глава 2 состав исходных данных и основные стадии
- •Глава 3 системы автоматизированного проектирования 78
- •Глава 4 введение в проектирование 90
- •Глава 5 выбор и разработка технологической схемы
- •Глава 6 выбор технологического оборудования
- •Глава 7 уравнения материального баланса технологи-
- •Глава 8 технологический расчет основной и
- •Глава 9 тепловой расчет основного оборудования 141
- •Глава 10 гидравлические расчеты 166
- •Глава 11 механический расчет 175
- •Глава 12 конструкционные материалы в химическом
- •Глава 13 оформление отдельных элементов химической
- •Глава 14 трубопроводы и трубопроводная арматура 224
- •Глава 15 вспомогательное оборудование химических
- •Введение
- •Глава 1 основные этапы и организация проектирования химических производств
- •1.1. Перспективный план и технико-экономическое обоснование
- •1.2. Задание на проектирование
- •1.3. Выбор района размещения предприятия и площадки строительства
- •1.3. «Роза ветров» района размещения предприятия и площадки строительства
- •1.4. Основные принципы проектирования зданий и сооружений химической промышленности
- •1.5. Разработка проектной документации по охране окружающей среды
- •1.5.1. Экологическое прогнозирование
- •1.5.2. Разработка прогноза загрязнения воздуха
- •1.5.3. Прогнозирование состояния поверхностных и подземных вод
- •1.5.4. Прогноз воздействия объекта при возможных авариях
- •1.6. Технологический процесс как основа промышленного проектирования
- •1.7. Генеральный план химических предприятий
- •1.8. Типы промышленных зданий
- •1.8.1 Основные элементы конструкции производственных зданий и их назначение
- •1.8.2 Одноэтажные промышленные здания
- •1.8.3. Многоэтажные здания
- •1.8.4. Вспомогательные здания и помещения химических предприятий
- •1.8.5. Склады промышленных предприятий
- •1.9. Инженерные сооружения
- •1.10. Специальные вопросы проектирования химических предприятий
- •Глава 2 состав исходных данных и основные стадии
- •2.2 Виды конструкторских документов
- •2.3. Содержание разделов исходных данных для проектирования промышленного химического производства
- •Раздел 1. Общие сведения и технология
- •Раздел 2. Характеристика выполненных научно-исследовательских и опытных работ, положенных в основу исходных данных для проектирования
- •Раздел 3. Технико-экономическое обоснование рекомендуемого метода производства. Перспективы производства и потребления
- •Раздел 4. Патентный формуляр
- •Раздел 5. Техническая характеристика исходного сырья, вспомогательных материалов, основных и конечных продуктов. Целевое назначение и области применения основных продуктов
- •Раздел 6. Физико-химические корстанты и свойства исходных,
- •Раздел 7. Химизм, физико-химические основы и принципиальная
- •Раздел 8. Рабочие и технологические параметры производства
- •Раздел 9. Материальный баланс производства
- •Раздел 10. Технологическая характеристика побочных продуктов и
- •Раздел 11. Математическое описание технологических процессов и
- •Раздел 12. Данные для расчета, конструирования и выбора основного промышленного технологического оборудования и защиты строительных конструкций
- •Раздел 13. Рекомендации для проектирования автоматизации
- •Раздел 14. Аналитический контроль производства
- •Раздел 15. Методы и технологические параметры очистки химически и механически загрязненных сточных вод, обезвреживания газовых выбросов и ликвидации вредных отходов
- •Раздел 16. Мероприятия по технике безопасности, промсанитарии и противопожарной профилактике
- •Раздел 17. Указатель отчетов и рекомендуемой литературы по
- •2.4 Проектирование в системе подготовки
- •2.4.1 Курсовое проектирование
- •2.4.2. Дипломное проектирование
- •Глава 3 системы автоматизированного проектирования
- •3.1. История развития сапр
- •3.2. Основные принципы создания сапр
- •3.3 Применение эвм для автоматизации процесса пректирования
- •3.4. Автоматическое изготовление чертежей
- •3.5 Основные преимущества автоматизации проектирования.
- •3.6. Основные требования к сапр
- •3.7. Связь сапр с производством, расширение области применения
- •Глава 4 введение в проектирование
- •4.1. Проектно-сметная документация
- •4.2. Технико-экономическое обоснование проекта
- •4.2.1. Исходные положения
- •4.2.2. Обоснование способа производства химической продукции
- •4.2.3. Экономика строительства предприятия и производства продукции
- •Глава 5 выбор и разработка технологической схемы производства
- •5.1. Общие положения
- •5.2. Последовательность разработки технологической схемы
- •5.3. Принципиальная технологическая схема
- •5.4. Размещение технологического оборудования
- •Глава 6 выбор технологического оборудования химических производств
- •6.1. Основные типы химических реакторов
- •6.2. Химические факторы, влияющие на выбор реактора
- •6.2.1. Реакции расщепления
- •6.2.2 Реакции полимеризации
- •6.2.3. Параллельные реакции
- •6.2.4. Комбинация реактора смешения с реактором вытеснения
- •6.3. Эскизная конструктивная разработка основной химической аппаратуры
- •6.3.1. Общие положения
- •6.3.2. Реакторы
- •6.4. Оптимизация процессов химической технологии
- •Глава 7 уравнения материального баланса технологического процесса
- •7.1. Стехиометрические расчеты
- •7.2. Общее уравнение баланса массы
- •7.3. Практический материальный баланс
- •7.4. Физико-химические основы технологического процесса
- •Глава8 технологический расчет основной и вспомогательной аппаратуры
- •8.1. Общие положения
- •8.2. Расчет объемов реакторов
- •8.2.1. Основные положения химической кинетики
- •8.2.2. Расчет идеальных реакторов
- •8.3. Определение объемов аппарата
- •Глава 9 тепловой расчет основного оборудования
- •9.1. Общее уравнение баланса энергии
- •9.2. Практический тепловой баланс
- •9.3. Теплообмен в реакторах
- •9.4. Расчет энтальпий и теплоемкостей
- •9.5. Расчет реактора периодического действия
- •9.6. Степень термодинамического совершенства технологических процессов
- •Глава 10 гидравлические расчеты
- •10.1. Расчет диаметра трубопровода
- •10.2. Расчет гидравлических сопротивлений в трубопроводе
- •10.3. Гидравлическое сопротивление кожухотрубчатых теплообменников
- •10.4. Подбор насосов
- •Глава 11 механический расчет
- •11.1. Расчет сварных химических аппаратов
- •11.1.1. Основные расчетные параметры
- •11.1.2. Расчет на механическую прочность
- •11.1.3 Требования к конструированию.
- •11.1.4 Расчет цилиндрических обечаек.
- •11.1.6. Подбор стандартных элементов
- •11.2. Расчет толстостенных аппаратов
- •Глава 12 конструкционные материалы в химическом машиностроении
- •12.1. Виды конструкционных материалов
- •12.2. Коррозия металлов и сплавов
- •12.2.1. Виды коррозии
- •12.2.2. Виды коррозионных разрушений
- •12.2.3. Способы борьбы с коррозией
- •12.3. Влияние материала на конструкцию аппарата и способ его изготовления
- •12.3.1. Конструкционные особенности аппаратов из высоколегированных сталей
- •12.3.2. Конструктивные особенности эмалированных аппаратов
- •12.3.3. Конструктивные особенности аппаратов из цветных металлов
- •12.3.4. Конструктивные особенности аппаратов из пластмасс
- •Глава 13 оформление отдельных элементов химической аппаратуры
- •13.1. Оформление поверхности теплообмена
- •13.2. Перемешивающие устройства
- •13.3. Уплотнения вращающихся деталей
- •Глава 14 трубопроводы и трубопроводная арматура
- •Глава 15 вспомогательное оборудование химических заводов
- •15.1. Виды вспомогательного оборудования
- •15.2. Транспортные средства
- •15.2.1. Классификация транспортных средств для твердых материалов
- •15.2.2. Машины для транспортировки жидкостей и газов
- •Список рекомендованой литературы
- •1Вимоги до оформлення розрахунково-пояснювальної записки та графічної частини
- •1.1 Загальні вимоги
- •1.2 Вимоги до тексту
- •1.2.10. Оформлення ілюстрацій і додатків.
- •1.3 Оформлення графічної частини
- •2 Склад розрахунково-пояснювальної записки
- •3 Стандартизація і метрологія
- •4 Матеріалоємність і ресурсозбереження
- •5 Будівельна частина
- •5.1 Вибір майданчика для будівництва
- •5.2 Пов’язування технологічної лінії з об’ємно-планувальним рішенням промислової будови
- •5.3 Вибір конструктивного рішення будівлі
- •5.4 Допоміжні будівлі і приміщення
9.6. Степень термодинамического совершенства технологических процессов
Применение прогрессивных энергосберегающих технологических схем и повышение энерготехнологической эффективности оборудования являются важными задачами химического производства.
При разработке высокоэффективных и малоэнергоемких технологий и оборудования большое значение имеют вопросы использования вторичных ресурсов и утилизации побочных энергоресурсов, под которыми понимают неиспользованный в технологическом процессе энергетический потенциал всех продуктов и отходов. Например, применение котлов-утилизаторов, которые позволяют использовать теплоту отходящих газов для производства пара или подогрева воды. Другим примером может служить использование теплоты, полученной за счет охлаждения химически очищенной водой элементов, расположенных в высокотемпературной зоне (например, печи). При этом охлаждаемые поверхности используются в качестве испарителей для получения водяного пара.
Первым шагом по пути модернизации любого процесса является анализ степени его совершенства и сопоставление его с другими вариантами процессов, предназначенных для данной цели.
Объективная оценка степени энергетического совершенства любого технологического процесса и агрегата может быть сделана лишь на основе термодинамического анализа.
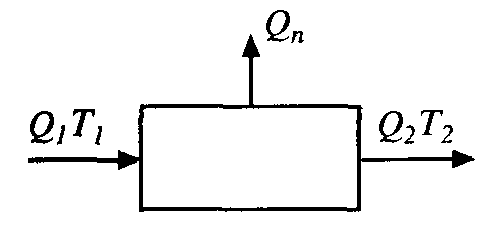
Простейшим из них является энергетический метод - на основе первого закона термодинамики. Например, энергетический баланс тепловой установки (рис. 9.4) можно записать следующим образом:
Q1 = Q2 + Qn
где Qn - энергия, которая не используется в технологической системе.
|
Рис. 9.4. Схема тепловых потоков |
Если предположить, что Qn = 0, а Q2= Q1 то тепловой (энергетический) коэффициент полезного действия (КПД) η = Q2/Q1 = 1. Известно, что любой процесс, независимо от того, как он будет технологически оформлен, при правильном подсчете всех |
энергетических потоков имеет коэффициент полезного действия близкий к еди-
нице, и нет смысла в его совершенствовании. Кроме того, из данного уравнения энергетического баланса неясно, используется энергия где-то или нет.
Таким образом, энергетический баланс не дает полной информации, преж-
де всего о качественных изменениях, происходящих в системе. При составлении энергетического баланса невозможно объективно учесть вторичные энергоресурсы (ВЭР). Если ВЭР вычесть из суммы общих энергозатрат, то расход энергозатрат будет заниженным, а если их вообще не учитывать, то энергозатраты получаются сильно завышенными. Кроме того, при комплексном производстве невозможно правильно распределить затраты энергии на различные виды продукции.
Для оценки степени совершенства технологического процесса следует использовать энергетический анализ на основе второго закона термодинамики и степень совершенства процесса понимать как степень его обратимости.
В обратимом процессе сумма энергии потоков, подведенных к системе, равна сумме потоков энергии, отведенных от нее:
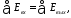
тогда коэффициент полезного действия в обратимом процессе
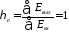
В любом реальном процессе вследствие его необратимости

и тогда
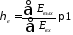
Таким образом, в реальных процессах эксергетический коэффициент полезного действия (ηe) всегда меньше единицы, на величину эксергетических потерь (∆D)
∆D
=
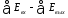
По
существу,
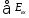 является суммой всех энергетических
затрат на осуществление данного процесса,
а
является суммой всех энергетических
затрат на осуществление данного процесса,
а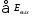 - обобщенная валовая производительность
агрегата.
- обобщенная валовая производительность
агрегата.
Таким образом, ηe отражает степень совершенства любого процесса: будь то производство энергии или другой технологический процесс.
В табл. 9.12 приведены значения энергетических (тепловых) и эксергетических коэффициентов полезного действия электрических машин и тепловых установок.
Таблица 9.12. Сравнение энергетических и эксергетических КПД
|
Вид установки (машины) |
Энергетический, η0 |
Эксергетический, ηe |
|
Электродвигатель |
0,85 - 0,95 |
0,90 |
|
Электрогенератор |
0,96 - 0,99 |
0,98 |
|
Паровой котел |
0,88 - 0,92 |
0,49 |
|
Газовая печь |
0,60 - 0,85 |
0,13 |
|
Печь на жидком топливе |
0,45 - 0,70 |
0,11 |
Из таблицы видно, что менее совершенными являются тепловые процессы, для которых значения эксергетических коэффициентов полезного действия в 2-5 раз ниже энергетических коэффициентов полезного действия. Для того чтобы составить эксергетический баланс типового химико-технологического процесса, необходимо перечислить основные виды энергии:
- теплового процесса [Еq ];
- вещества [Еb];
- химическая [Ех];
- нулевая [Е0].
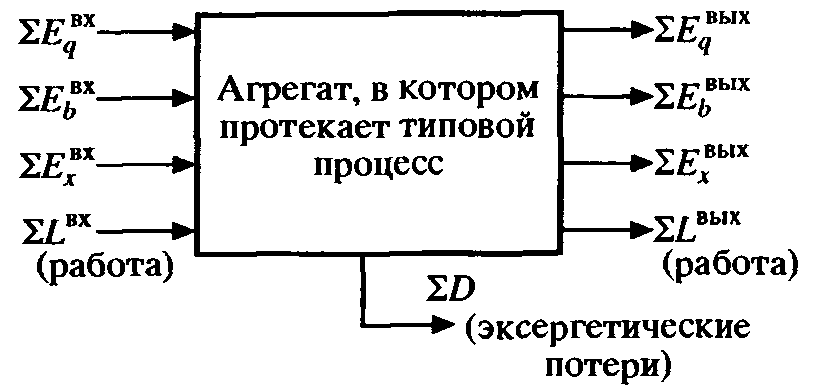
Схема эксергетического баланса показана на рис. 9.5. Для такой системы уравнение эксергетического баланса можно записать в следующем виде:
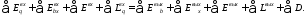
|
Рис. 9.5. Схема эксергетического баланса |
В общем виде эксергетический коэффициент полезного действия
Если
да уравнение эксергетического баланса примет вид: |
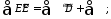
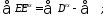
и
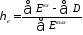
Для приближенной оценки степени совершенства процессов можно использовать эксергетические потери, которые делятся на внутренние и внешние:
- внутренние потери эксергии связаны с необратимостью процессов, протекающих внутри системы (потери при дросселировании, трении, при наличии гидравлических сопротивлений);
- внешние потери эксергии связаны с условиями сопряжения системы с окружа-
ющей средой (выброс продуктов производства в окружающую среду, плохая изоляция системы и т.д.).
Внутренние потери чаше всего связаны с несовершенством машин и аппаратов, а внешние - с несоответствием между процессом и условиями его проведения.
Практическое значение такого разделения эксергетических потерь связано с раз-
личными способами уменьшения внутренних и внешних потерь.
Ниже приводится пример использования эксергетических потерь для оценки степени совершенства типового технологического процесса и его технологического оформления.
Пример 9.9. Условия проведения процесса в реакторе:
- сырье поступает в реактор при температуре t1 = 195 °С;
- продукты реакции выходят из реактора с температурой t2 = 185 С;
- исходная температура сырья tисх = 30 °С;
- теплоемкость сырья и продуктов реакции не меняется;
- епловыми потерями в окружающую среду пренебрегаем;
- конечная температура продуктов реакции tкон = 30 °С;
- емпература сухого насыщенного пара tп = 200 °С;
- процесс конденсации пара изотермический;
- количество тепла, необходимое для нагревания сырья от tисх до t1 равно 1 МДж;
- температура в котле-утилизаторе tку = 150 °С;
- потери эксергии в реакторе для всех схем одинаковы.
Решение: Так как потери эксергии в реакторе одинаковы, для оценки технологических схем достаточно определить потери эксергии за счет теплообмена в теплообменниках (D∆T).
Расчет производится по формулам:
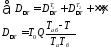
где Т0 = 298 К; Q - теплота, передаваемая от одного теплоносителя со средней температурой Тa к другому - со средней температурой Тб.
Теплота, необходимая для нагревания сырья, по условию равна 1 МДж, теплоту, необходимую для охлаждения продуктов реакции от t2 до tкон, определяют по формуле:
Qохл = mc(tк – tн)
где tн и tк - температуры теплоносителя на входе и выходе.
Так как теплоемкость (с) и масса (m) продуктов реакции равны теплоемкости и массе сырья, то произведение m∙с можно определить по формуле
Qнагр = mc(t1+tисх) = 1,
Откуда mc = 1/(t1 - tисх).
Тогда количество теплоты на охлаждение
Qохл = mc(t2 - tисх) = (t2 - tисх)/ (t1 - tисх) = 0,939 МДж.
Отметим, что сумма ΣQ = Qнагр + Qохл = 1 + 0,939 = 1,939 МДж сохраняется постоянной во всех схемах.
Рассчитаем потери эксергии для первого варианта технологической схемы (рис. 9.6).
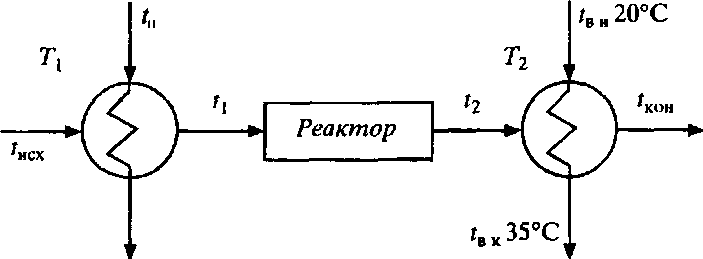
Рис. 9.6. Технологическая схема 1: T1 и T2 - теплообменники;
tвн и tвк - начальная и конечная температура охлаждающей воды
Потери эксергии в теплообменнике T1 равны
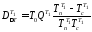
где QT1 = Qнагр = 1 МДж.
Средняя температура сырья
Тс = (tисх + t1)/2 + 273 = (30 +195)/2 + 273 = 386 К.
Температура греюшего пара не меняется, так как идет процесс конденсации пара
Тп = tп + 273 = 200 + 273 = 473 К;
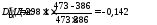
В теплообменнике Т2
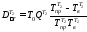
где QT2 = Qохл = 0,939 МДж.
Средняя температура продуктов реакции
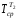 =
(t2
+ tкон)/2
+ 273 = 1852+ 30 + 273 = 380 К,
=
(t2
+ tкон)/2
+ 273 = 1852+ 30 + 273 = 380 К,
а средняя температура воды
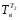 =
(20 + 35)/2 +273 = 300К;
=
(20 + 35)/2 +273 = 300К;
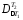 =
298∙0,939
(380 – 300)/(380∙300)
= 0,196 МДж.
=
298∙0,939
(380 – 300)/(380∙300)
= 0,196 МДж.
Общие потери эксергии по первой схеме равняются:
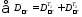 =
0,142 + 0,196 = 0,338 МДж.
=
0,142 + 0,196 = 0,338 МДж.
Потери эксергии, отнесенные к сумме теплот на нагревание и охлаждение продуктов реакции (Dc) сырья, равны
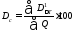 =
(0,338/1,939)∙100
= 17,4%
=
(0,338/1,939)∙100
= 17,4%
Второй вариант технологической схемы включает котел-утилизатор и возмож-
ность использования теплоты конденсата водяного пара для подогрева исходно-
го сырья (рис. 9.7).
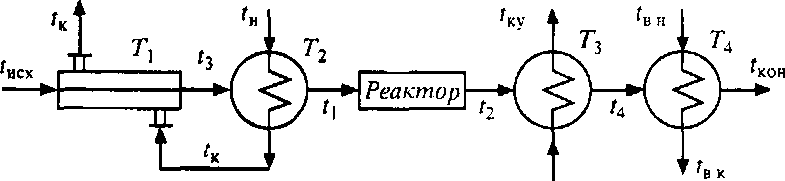
Рис. 9.7. Технологическая схема 2
Для расчета потерь эксергии необходимо определить количество передаваемой в каждом теплообменнике теплоты и температуры t3 и t4.
Как следует из условий, общее количество теплоты, передаваемой в теплообмен-
никах T1 и T2, равно 1 МДж. Принимаем, что распределение теплоты по этим теп
лообменникам прямо пропорционально количеству теплоты, отдаваемой килограммом конденсирующегося пара при его охлаждении от tп до температуры конденсата на выходе из теплообменника T1 – (tк), т.е. Q2/Q1 = 3/1.
Считая, что теплоносители в теплообменнике T1 движутся противотоком, примем Tк на десять градусов выше, чем температура другого теплоносителя на входе (tисх).
Tк = tисх+ 10 = 30+ 10 = 40 °С.
Для 1 кг пара теплота конденсации, по справочным данным, составляет при
200 °С 1938 кДж/кг; теплота охлаждения конденсата
 (tн
- tк)
= 4,19∙(200
- 40) = 670 кДж/кг.
(tн
- tк)
= 4,19∙(200
- 40) = 670 кДж/кг.
Отсюда, количество теплоты, передаваемое в каждом теплообменнике, составит:
в
теплообменнике Т1
-
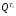 =
670 кДж/кг;
=
670 кДж/кг;
в
теплообменнике Т2
-
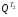 =1938
кДж/кг.
=1938
кДж/кг.
Определяем температуру t3 из уравнения:
t3
= tисх
+
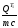 = 30 + 0,25(185 - 30) = 71°С.
= 30 + 0,25(185 - 30) = 71°С.
Потери эксергии в теплообменнике T1 определяем из уравнения:
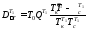
где
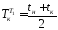 +273
= (200+40)/2 + 273 = 393 К - усредненная температура
конденсата;
+273
= (200+40)/2 + 273 = 393 К - усредненная температура
конденсата;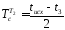 + 273 = (30+71)/2 + 273 = 323 К - усредненная температура
сырья.
+ 273 = (30+71)/2 + 273 = 323 К - усредненная температура
сырья.
Отсюда следует, что
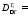 298∙0.25(393
– 323)/(393∙323)
= 0,041 МДж.
298∙0.25(393
– 323)/(393∙323)
= 0,041 МДж.
Потери эксергии в теплообменнике Т2
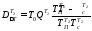
где
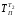 =tП
+ 273 = 200 + 273 = 473 К;
=tП
+ 273 = 200 + 273 = 473 К;
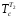 =
(t3+t1)/2+
273 = (71 +195)/2 + 273 = 406 К.
=
(t3+t1)/2+
273 = (71 +195)/2 + 273 = 406 К.
Отсюда следует, что
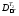 =
298∙0,75
(473 – 406)/(473∙406)
= 0,078 МДж
=
298∙0,75
(473 – 406)/(473∙406)
= 0,078 МДж
Примем температуру t4 на 20 °С выше, чем температура воды в котле-утилизато-
ре, т.е. t4 = tку + 20 = 170 °С. Тогда количество теплоты, передаваемое в каждом тепюобменнике Т3 и Т4, будет равно соответственно
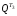 =
m
с (t2
– t4)
= (185 - 170)/(195 – 30) = 0,091 МДж,
=
m
с (t2
– t4)
= (185 - 170)/(195 – 30) = 0,091 МДж,
 =
m
с (t4
- tкон)
= (170 - 30)/(195 – 30) = 0,848 МДж.
=
m
с (t4
- tкон)
= (170 - 30)/(195 – 30) = 0,848 МДж.
Проверяем общую сумму теплот
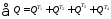 =
0,25+0,75+0,091+0,848 = 1,939 МДж
=
0,25+0,75+0,091+0,848 = 1,939 МДж
Потери эксергии в теплообменнике Т3
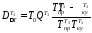
где
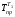 = (t2
+ t4)/2
+ 273 = (185 + 170)/2 = 450К,
= (t2
+ t4)/2
+ 273 = (185 + 170)/2 = 450К,
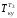 =
tку
+ 273 = 150 + 273 = 423 К,
=
tку
+ 273 = 150 + 273 = 423 К,
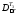 =
298∙0,091(450
– 423)/( 450∙423)
= 0,004 МДж
=
298∙0,091(450
– 423)/( 450∙423)
= 0,004 МДж
Потери эксергии в теплообменнике Т4
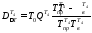
где
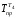 = (t4+tкон)/2
+ 273 = (170 + 30)/2 + 273 = 373K,
= (t4+tкон)/2
+ 273 = (170 + 30)/2 + 273 = 373K,
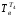 =
(tвн+tвк)/2
+273 = (20 + 35)/2+ 273 = 300 К,
=
(tвн+tвк)/2
+273 = (20 + 35)/2+ 273 = 300 К,
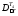 =
298∙0,848(373
– 300)/(373∙300)
= 0,165 МДж
=
298∙0,848(373
– 300)/(373∙300)
= 0,165 МДж
Общая сумма потерь эксергии во второй схеме равна
 =
0,041 + 0,078 + 0,004 + 0,165 = 0,288 МДж
=
0,041 + 0,078 + 0,004 + 0,165 = 0,288 МДж
Отношение потерь эксергии во второй схеме
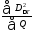 =
(0,288/1,939)100% = 14,8%
=
(0,288/1,939)100% = 14,8%
Как показали расчеты, более совершенной с точки зрения использования энергии является второй вариант технологической схемы.
Необходимо отметить, что реальные схемы утилизации тепла сложнее и могут быть многоступенчатыми (рис. 9.8).
Существуют три группы методов экономии энергетических ресурсов:
1) Методы, связанные с увеличением поверхностей аппарата, времени протекания реакции, использованием более активных катализаторов, что позволяет приблизиться к равновесному состоянию на выходе из аппарата.
2) Методы, основанные на изменении технологического режима и не связанные с изменением технологической схемы, что может привести к увеличению габаритов аппарата.
3) Методы, требующие наряду с приемами, изложенными выше, изменение технологической схемы.
При разработке технологической схемы необходимо производить совместный анализ энергетического и эксергетического балансов с целью установления уровня возврата и возможности использования электрической, тепловой и меха
нической энергии с существенным сокращением потребляемой извне энергии.
Кроме того, при выборе относительного варианта технологической схемы должны быть учтены технико-экономические показатели.
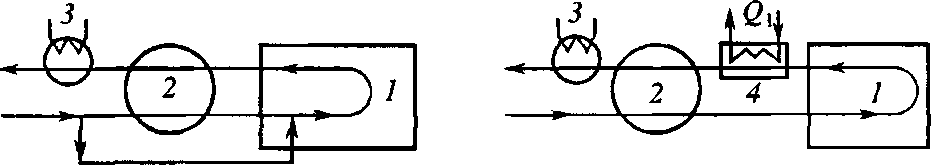
a б
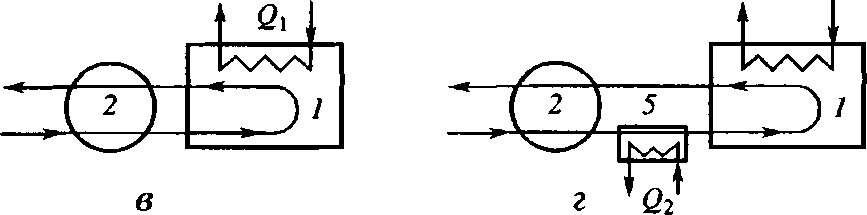
Рис. 9.8. Схемы использования тепла реакций:
а - с холодным байпасом; б - с отводом тепла реакции в выносном аппарате; в - с отводом тепла непосредственно из реактора; г - с предварительным подогревом реактивов; 1 - реактор; 2 - теплообменник; 3 - холодильник; 4 - аппарат для использования тепла реакции; 5 - подогреватель реагентов

 .
. = 0, то
= 0, то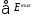 = 0, тог-
= 0, тог-