
colloid_grig
.pdfз
1.ВведеНИ~1
В курсе «Поверхностные явления и дисперсные систе
МЫ» рассматриваются процессы, протекающие на границе
раздела фаз и влияние свойств границ на состояние дисперс
ных систем (устойчивость, коагуляция).
Под дисперсной системой понимается гетерогенная сис
тема, в которой одна или несколько фаз находится в измель ченном (диспергированном) состоянии. Измельченную фазу
назывa:кYt дисперсной фазой, а среду, в которой она находиг-
_ |
w |
ся - дисперсионнои средои.
Молекулы вещества находящиеся на границе раздела
фаз по термодинамическим свойствам отличаются от таковых в объеме, даже для однокомпонентиой системы в силу разной интенсивности молекулярного поля соседствующих фаз. Это
приводит к тому, ЧТО они втягиваются в фазу с более интен
сивным молекулярным полем, .в результате чего вдоль грани
цы раздела возникаer натяжение, которое на границе раздела
конденсированной и газообраз~ой фаз называется поверхно
стным натяжением «О), а на границ~ двух конденсированных
фаз - межфазныIM «01-2».
При увеличении границы раздела фаз молекулы из глу
бины фазы должны переместиться на границу раздела фаз, т.е. переЙТи из более глубокой потенциальной ямы в более
мелкую. на зто затрачиваerся работа против молекулярных
сц т.е. для увеличения границы раздел фаз затрачивается
работа. Работа необходимая для увеличения поверхности
раздела на единицу при постоянном объеме и температуре и
будет определением поверхностного натяжения.
Следовательно, размерность поверхностного натяжения
[а] = ДжJ"; ИЛИ эрг/см2.
Работу по увеличению поверхности раздела на величину
площади SПЛ при Р и Т постоянных равную свобоДНОЙ энер
гии поверхностного слоя можно выразигь как |
|
БW = FS(P,T) = аSIШ |
(1) |
Одновременно поверхностное натяжение можно рас
сматривать, как вектор -- силу, приложенную к единице дли
ны контура, ограничивающеro поверхность. Все это наглядно
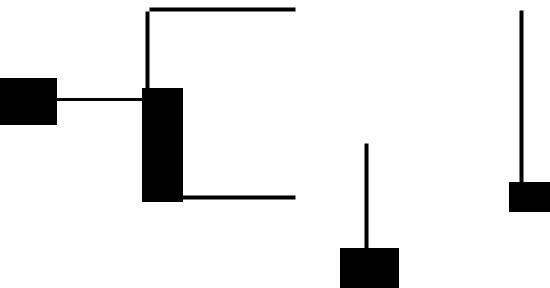
4
можно представить на опьгге Дюпре (рис. 1) по растяжению
пленки (2) с силой f при перемещении ПОДВИЖНОЙ перемычки
на некоторое расстояние бх
~'I |
g |
, |
~~i 8 |
f |
f
. }JC\ 1
Рис. 1
в ЭТОМ случае
|
oW ::::; f2b6x = fcrSпл |
(2), |
а |
а = оW/8Snл = f |
(3) |
Очевидно, что ОСНОВНыми признаками объектов колло
идной (дисперсной) системы будет ее гетерогенность и ДИС
персность. Причем первая является качественной характери
стикой, а вторая - количественной. Последняя обычно опре
деляется тремя параметрами: d - размером частицы, D = l/d обратной величиной или дисперсностью и удельной поверх-
ностью
Sуд = SI-2N |
(4) |
где SI..2 - поверхность частицы, V - ее объеМ. |
|
для сферы |
|
Sуд == 6/d |
(5) |
Таким образом, объектом изучения являются все гетеро
генные системы, особенно обладающие сильно развитой по
верхностью.
Иными словами курс «Поверхностные явления и дис-
v |
~ |
персные системы) изучает своиства и взаимодеиствия между
макроскопическими частицами. Человечество использовало
такие объекты еще с древних времен (гончарное ПРОИЗВОДСТ ВО, выделка KO~ земледелие и др.). Научное изучение этой
дисциплины И выделение её, как самостоятельной области
ХИМИИ произошло после работ итальянца Ф. Сельми и осо бенно английского ученого Т. Грема в 1861 г. Последний чет-

4
можно представить на onbrre Дюпре (рис. 1) по растяжению
пленки (2) с силой f при перемещении ПОДВИЖНОЙ перемычки на некоторое расстояние бх
-~
>*1
1 f
I
Рис. 1
в этом случае |
|
|
|
БW = t2Ьбх = fаSпл |
(2), |
а |
(J == БW/оSпл = f |
(3) |
Очевидно, что основными признаками объектов колло
ИДНОЙ (дисперсной) системы будer ее гетерогенность и дис
персиость. Причем первая является качественной характери
СТИКОЙ) а вторая - количественной. ПоследЮIЯ обычно опре
деляется тремя параметрами: d - размером частицы, D = l/d
обратной величиной или дисперсностью и удельной поверх-
ностью
Sуд = Sl-2N |
(4) |
где Sl-2 - поверхность частицы, V - ее объем. |
|
для сферы |
|
Sуд = 6/d |
(5) |
Таким образом, объектом изучения ЯВЛЯЮТСЯ все гегеро
генные системы, особенно обладающие сильно развитой по
~ерхностью.
ИRЫМИ словами курс «Поверхностные явления и дис-
., |
u |
персные системы» изучает своиства и взаимодеиствия между
макроскопическими частицами. Человечество использовало
такие объекты еще с древних времен (гончарное производст
ВО, выделка кож, земледелие и др.). Научное изучение ЭТОЙ
ДИСЦИIlЛИНbl И выделение её, как самостоятельной области
ХИМИИ произошло после работ итальянца Ф. Сельми и осо
бенно английского ученого Т. Грема в 1861 г. Последний чет-
5
](0 сформулировал различие между истинными растворами и
дисперсными системами (КОЛЛОИДНЫМИ растворами). Так как
основными объектами исследования были растворы клея, то
такие растворы он назвал КОЛЛОИДНЫМИ (от греческого «col8.»
- .клей). В настоящее время эта наука включает более широ-
v
КИИ диапазон дисперсности, охватывая прапически все гете-
рогенные системы. Отметим в зак.гiючение, что коллоидные
~
растворы отличаются от истинных совокупностью своиств,
которые обычно называют коллоидно-химическими:
1.Малая ПОДВИЖНОСТЬ, частиц в КОЛЛОИДНЫХ растворах по сравнению с молекулами в ИСТИННЫХ растворов (молеку
лярно-кинетические свойства)
2.Большая способность частиц к рассеянию света по
сравнению с молекулами истинного раствора (оптические
свойства).
3.Способность частиц перемещаться в электрического
поле в отличие от незаряженнъrx молекул истинного раствора
(электрические свойства).
4.Способность частиц удерживаться в отличие от моле
кул (кроме молекул ВМС) полупроницаемыми мембранами~ способность к диализу.
5.0граниченная устоЙЧИвосгь растворов во времени.
2. Кл8~СИфИКациSl дисперсных ~истем.
Дисперсные системы чрезвы~чайно разнообразны, по этому целесообразно их классифицировать по некоторым
признакам:
1. По степени дисперсности.
2. По агрегатному состоянию з. ПО ПОДВИЖНОСГИ дисперсной фазы.
4. По взаимодействшо дисперсной фазы с дисперсион-
...- ~
нои средои
1. По степени дисперсности обычно рассматривают зависи
мость удельной поверхности Sуд от радиуса дисперсной час
ТИЦЫ, (рис.2)

6
|
|
|
:r |
|
..... |
|
|
|
|
|
|
|
|
||
|
|
|
|
'! |
|
|
|
|
|
|
|
..... |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис~2
1. Системы, в которых размер частиц npедставлен в диа
пазоне 10·9-10·1 M~ называют ультрадисперсными, коллоид
НЫМИ или золями.
п. в Диапазоне 10·7_10·S м - микрогетерогенными.
IП. В диапазоне больше 10·5 М - грубодисперсныи•.
Основную классификацию проводsrr по агрегатному состоя
нию дUcnepcHoй фазы - первый символ, и по состоянию дUc
nерсuонnой среды, - второй символ. Поскольку ОСНОвных аг-
..,
регатных СОСТОянии три, ТО, возможно., представить девять
групп..табл. 1
|
|
|
|
Табл.l |
|
|
|
УСАО8вое |
|
ар , |
... |
|
|
odoa....... |
Ианави. CIIcтt811 JI |
||
|
|
сист...... |
|
|
|
|
|
|
ь V |
, |
|
|
|
|
Tгr |
|
|
|
Жи.u.а |
|
|
|
|
Гаsooбрu· |
ггr |
|
|
|
_.,. |
|
|
~"'I. |
|
ТаерАа. |
ТIЖ. |
|
|
|
ЖвJUtаR |
|
|
|
|
Газообраз |
|
|
|
|
на. |
|
|
fазообраl-:. Т.ера•• |
т/г |
|||
ва. |
|
~HДKa. |
'1КJr |
|
|
|
Га300БР88.. |
~ г/г |
|
- |
|
на. |
- |
|
v |
• |
|||
|
|
|||
|
|
|
||
T.epAlle feltepore.Bile CJlcreJlbl: 1dI..
иерuы. CПJIа..., C1IТ8JUlWt 6етОа, 811·
nosицвоRИ9е .aтep.~
!<ап1l4Jl_риы.e е.ете....: ~AJWCnr.
впорвстых ~8Х1 8 ••eo(Кleвras;
почв... rpyaтbl
Лор_стке тела: .aco~вты R хат.
J'lизатор.. • rаэu
СуспензИ1l н 3011.: npOIIWlWletnnIe-
eyeneвa8B. ПУ'nЪDЫ, ..ееа. nanbl,
MJlbl
Эмульсии: DрИJICJUlа. иефть. ире_Н.
молохо
|
|
|
о |
Газовые 9l1Ул.ьсии • lteКbI: фnотаuн ... |
|||
и..е, |
ПРОТИВОuо.арвые. |
IDIJIlIlUIIe- |
|
пены |
|
|
|
hрозOJlМ (UЫJIJJ, JDiIlN), |
пороlD10l |
||
А9РОЗОАИ: "уarlИЫ • |
,-о. 1IJICJIe про,, |
||
МW1Шtе'llнwе, облака |
|
|
|
КOЛJIOIf4На. с.стеlf. "е 06р."Уетеа |
|||
. ..... |
• |
..;. |
|
7
Сочетание Г!г не образует при обычных условиях гете
рогенной системы. Такая система может образоваться только
при высоких давлениях, напрмер, при синтезе aMMJtIaKa
3 По nодвu;жносmu дисперсной фазы. Если в системе
может свободно перемещатъся дисперсная фаза, то такую систему называют свободно - дисперсной, если не может (пористые тела, твердые золи)) ТО СВЯЗНО - дисперсной.
4. По взаимодействию дисперсной фазы и дtlсnерсuон
ной среды Различие термодинамических свойств в системе могут быть велики тогда межфазное натяжение 01-2 будет
большим, такие системы обычно называют лиофобными, на
пример~ металл в воде., или малым - такие системы назыIают
лиофилъными, (гидраты ОКИСЛОВ в воде, растворы коллоид
ных ПАВ).
3. Термодинамика поверхностных явлений.
3. 1. Вклад межфазного C40~ в теРМО1!и...нам.~ч..еские свойства
диспеРС!fЬ~ систем.
Как отмечалось в введении~ молекулы в межфазном
~
слое отличаются по термодинамическим своиствам от тако-
ВЫХ в объеме При высокой дисперсности дисперсной фазы
ДОЛЯ молекул в поверхностном слое может достигать значи
тельной величины, ~ 50% для золей. ПозтоА-1У такая система
""
ПО термодинамическим своиствам в целом может сильно ОТ-
личаться от нераздробленной и это ПРИВОДИТ к необходимо
сти учесть зто. В настоящее время известны два мeroда, ко
торыми можно определить ЭТОi вклад:
·1) Метод избыточных величин Гиббса.
2)Метод слоев конечной толщины.
Рассмотрим применение метода избыточных величин
Гиббса. Для описания термодинамических свойств межфаз
ного слоя Гиббс применил разработанный им ранее метод
термодинамичеСКllХ функций со следующими дополнитель НЫМИ условиями. Он предложил рассматривать термодина
мические свойства слоя, как избьrrки термодинамических
~ |
..., |
) СВОИСТВ гетерогеннои системы после удаления из нее чи:стых
8
составляющих ее фаз, по отношению к гипотетической гете
рогенной системе, в которой фазы граничат по некоторой плоскости внутри межфазного СЛОЯ, названной им поверхно
стью разрыва. Следует OTMeтJiTb) Гиббс определил «поверх
ность разрыва» не как математическое понятие, а как неодно- ,
РОДИЫЙ слой (surface of discontinuity)~ разделяющий об'ьемные фазы и., следовательно, обладающий некоторой толщиной. Поскольку в межфазном слое происходит резкий переход от
свойств ОДНОЙ фазы а I< другой ~, то вьщелить этот слой по
толщине, составляющей в конденсированных фазах вдали от
критических параметров несколько молекулярных слоев,
чрезвычайно трудно, особенно во времена Гиббса. Гиббс ОТ
нес избытки термодинамических свойств слоя не к единице
объема слоя, а к единице поверхности разрыва. Очевидно, что
при таком отнесении избьrгoк объема в ОТЛJ1tlие от остальных
изБЫТ1<ОВ, термодинамических свойств будет равен нулю.
Гиббс использовал выражение для объединенного первого и
второго закона термодинамики. Согласно первому закону
(закону сохранения энергии), подведенная к системе тепловая
"'"
энерг~ия расходуется на увеличение внутреннеи энергии сис-
темы dU и производст~о работы БW~ (последнее включает все
ВИДЫ работы)
Или
oQ ~ dU + БW(рdV, - аdSnл, - ~tlIdni и др.) |
(6) |
где в скобках приведены работы расширения, работа
против поверхностных сил li химических сил соответственно.
из второго закона термодинамики следует |
|
dS =oQIТ |
(7) |
Подставляя (7) в (6) получим первое фундаментальное
уравнение Гиббса для гетерогенной открытой системы |
|
dU = TdS - PdV + аdSnл + LJ,Lidni |
(8)., |
которое лежит в основе получения и других фундамен
талЬНЫХ уравнений. Используя известные термодинамиче
ские соотношения, можно получить уравнения ДЛЯ dG, dF) dH, (полный дифференциал энергии Гиббса, энергии Гельм
гольца и знтальпии соответственно)
dG=-SdТ+VdР+crdSпл+LllidЛi |
(9) |
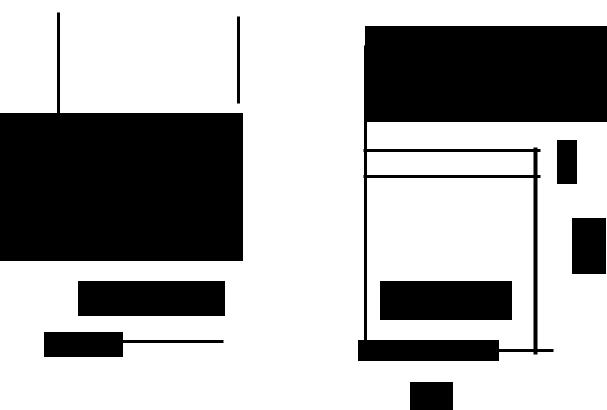
dF=-SdТ-РdV+аdSпл+~llidПi |
(1 О) |
dН~ТdS+VdР+(jdSIIЛ+LJ.Lldni |
(11) |
Эти уравнения НОСЯТ название фундаментальных. С их
помощью можно получить большое количество (256) термо-
~ ""'
динамиqеских соотношении, ЧТО и является ОСНОВОИ метода
термодинамических ФУНКЦИЙ (СМ. курс Химической термоди
намики).
l~ BpIaд 'фундаментальных термодинамич~ских уравнени~
11л!! IJЛОСКОГО межфазноro слоя.
Используя отмеченные вьппе условия~ Ги6бс получил
фундамеIПальные уравнения для плоского межфазноro слоя.
Схема для вывода представлена на рис. з.
i
-----
,
Рис.3
Рассматривая свойства СЛОЯ, как избытки, МОЖНО пред-
ставить
l!=ureт..tr_I!
SS=Srer~Sa-SP
G8=Qreт_Ga -aJЗ
s _ |
гет |
а А |
n i-ni |
-ni |
-nj'" |
YS=vгет•уа..~
(12)
(13)
(14)
(15)
(16)
Аналогичные уравнения можно написать и для прира
щений (полньfX дифференциалов)Ф Тогда фундаментальные
уравнения для межфазноro слоя МОЖНО представить
dUfет=ТdSГ~-Рdvгет+оdSnл+}.;Jlidni (17)

]0
dlF=Tdsa-Рdva+LtJ,idI1i |
Ц |
(18) |
|
|
|
||
dlf=TdS13-РdvP+LJ.1idПi |
Р |
(19) |
|
|
|||
Вычитая из (17) уравнения (18) и (19) ,И учитывая усло
вия термодинамического равновесия Гиббса
т.е. |
|
Treт=TCt=T~ |
(20) |
preт=pa=p~ |
(21) |
~ireт=J.liQ=JlifJ |
(22) |
получим |
|
dUS=TdSS+аdSол+LlJ,id11is |
(23) |
Заметим, что фазы а. и JЗ имеют одну общую rpаницу, но
распространяются до бесконечности. Уравнение (23) и явля ется основным фундаментальным уравнением для дифферен циала полной энергии межфазноro слоя. Остальные уравне
ния dGs, dFs, dIr можно получить аналогичным образом:
dFS=..SSdT+аdSпл+LJJ-idniS |
(24) |
dGS=-SdТ+аdSIШ+~J.1idПiS |
(25) |
dН=ТdS+аdSnл+LlJ.idПiS |
(26) |
Следует иметь в ВИДУ, что величины GS, |
S·, US,IГ не |
имеют абсоmoтного значения, а npедставJUIЮТ избьrrки ЭТИХ
величин реальной системы (рис. 3 а), по отношенmo к гипо
тетической (рис. 3 б), Т. е. фактически |
(27) |
U~_ut'еальн_UnШоте1ИЧ |
Кроме того, полученные фундаментальные уравнения
дают большое количество термодинамических соотношений для межфазноro (поверхностного) слоя.
Например, с; = |
aJts |
, BF$ |
|
дТ |
|||
|
'" |
||
|
|
==Т ИТ.Д.
в ЭТОМ случае CSv, S8, Т - зто величины не объемного, а
поверхностного слоя.
Уравнения (23), (24), (25), (26) - это фундаментальные
уравнения для межфазного поверхностного слоя. из фунда·
..,
менталъныx уравнении следует термодинамическое опреде-
11
ление поверхностного натяжения, как частная ПРОИЗ80ДНая ОТ
термодинамических потенциалов по площади, при ПОСТОЯН
стве соответСТВУЮЩИХ естественных переменных
6'~ |
|
auS |
= BF S |
ааВ |
= gJ!.S |
|
|
(28) |
|
|
|||||||
|
|
oS1111 SS ,11/$ |
oS1IIl Т,11; |
as/IJI т,1I! |
as1IIl SS ,n,s |
|||
|
|
|
||||||
|
|
|
||||||
Легко видегь, что фундаментальные уравнения (23), (24), (25), (26) отличаются от (8), (9), (10), (11) тем, tfГ() в НИХ объ-
ем заменен на IIЛОСКОСТЬ. |
|
2. Метод слоев конечной тощины. |
.~: |
Этот метод предложен Ван-дер-Ваалъсом и Гуггенгей
МОМ~СМЫСЛ его СВОДИТСЯ к тому, что для выделения межфаз
ного слоя используются две поверхности раздела ( рис. За) и
сохраняется объем слоя oYS. При ЭТОМ термодинамические
"'" v
своиства слоя рассматриваются как разница между своиства-
ми гетерогенной системы в целом и фазами ее составляющи-
ми, итак для слоя 5 получим
dUreт |
TdS-РdV+аdSпл+LlJ.idni |
(29) |
-(dt?=Тdsа.РdVX+l:J!idПi(l) |
(30) |
|
~d{/=ТdsР-РdvP+kJlidIliР) |
(31) |
|
dtr=TdS3-Рd~+аdSШI+~Jlidni8 |
(32) |
|
Уравнение (32) аналогично по форме полученному ме
тодом избыточных величин Гиббса. Однако, трудности, свя
занные с определением толщины слоя б остаются, и остается
проблема выбора положения плоскостей, ограничивающих
межфазный слой. для определения резко меняющихея
свойств межфазного СЛОЯ, необходимо знаНllе межl\<lолеку-
..,
~pHOГO потенциала взаимодеиствия и его градиента по тол-
щине слоя. Такие расчеты чрез:вычайно сложны и MOryт быть
выполнены только для дисперсных сил, поэтому до настоя
щего времени этот метод не получил распространения. Наи
более широко используется метод избыточных величин Гиб-
бса. |
. |
Очевидно, 'fr() от способа представления термодинами-
~
ческие своиства слоя не меняются, поэтому его можно пред-
ставить как набор параллельных плоскосте~ в которых натя
жение меняется от нулевого значения в одной фазе к нулево-- .
